
В химии и физике , энергия активации минимальное количество энергии , которое должно быть предусмотрено , чтобы в результате соединений в химической реакции . [1] Энергия активации ( E a ) реакции измеряется в джоулях на моль (Дж / моль), килоджоулях на моль (кДж / моль) или килокалориях на моль (ккал / моль). [2] энергия активации можно рассматривать как величины потенциального барьера (иногда называемый энергетический барьер) разделение минимумов от потенциальной энергииповерхность, относящаяся к начальному и конечному термодинамическому состоянию . Чтобы химическая реакция протекала с разумной скоростью, температура системы должна быть достаточно высокой, чтобы существовало заметное количество молекул с поступательной энергией, равной или большей энергии активации. Термин «энергия активации» был введен в 1889 году шведским ученым Сванте Аррениусом . [3]
Другое использование [ править ]
Хотя энергия активации используется реже, она также применяется к ядерным реакциям [4] [5] и различным другим физическим явлениям. [6] [7] [8] [9]
Температурная зависимость и связь с уравнением Аррениуса [ править ]
Уравнение Аррениуса дает количественную основу для связи между энергией активации и скоростью, с которой протекает реакция. Из уравнения можно найти энергию активации через соотношение
где A - предэкспоненциальный множитель для реакции, R - универсальная газовая постоянная , T - абсолютная температура (обычно в градусах Кельвина ), а k - коэффициент скорости реакции . Даже не зная A , E a можно оценить по изменению коэффициентов скорости реакции как функции температуры (в рамках справедливости уравнения Аррениуса).
На более продвинутом уровне член чистой энергии активации Аррениуса из уравнения Аррениуса лучше всего рассматривать как экспериментально определенный параметр, который указывает на чувствительность скорости реакции к температуре. Есть два возражения против того, чтобы связать эту энергию активации с пороговым барьером элементарной реакции. Во-первых, часто неясно, протекает ли реакция в одну стадию; пороговые барьеры, усредненные по всем элементарным шагам, имеют небольшое теоретическое значение. Во-вторых, даже если изучаемая реакция является элементарной, спектр отдельных столкновений вносит вклад в константы скорости, полученные в результате экспериментов с объемными («баллончиками») с участием миллиардов молекул, с множеством различных геометрий и углов столкновения реагентов,разные поступательные и (возможно) колебательные энергии - все это может привести к разным микроскопическим скоростям реакции.[ необходима цитата ]
Катализаторы [ править ]
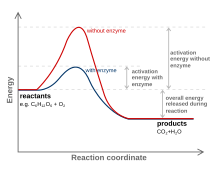
Вещество, которое изменяет переходное состояние для снижения энергии активации, называется катализатором ; Катализатор, состоящий только из белка и (если применимо) низкомолекулярных кофакторов, называется ферментом . Катализатор увеличивает скорость реакции, не расходясь при этом. [10] Кроме того, катализатор снижает энергию активации, но не изменяет энергии исходных реагентов или продуктов и, следовательно, не меняет равновесия. [11] Напротив, энергия реагента и энергия продукта остаются прежними, и изменяется (понижается) только энергия активации .
Катализатор может снизить энергию активации за счет более благоприятного формирования переходного состояния. Катализаторы по своей природе создают более «удобную» посадку для субстрата реакции для перехода в переходное состояние. Это возможно из-за высвобождения энергии, которое происходит, когда субстрат связывается с активным центром катализатора. Эта энергия известна как связывающая энергия. При связывании с катализатором субстраты участвуют в многочисленных стабилизирующих силах, находясь внутри активного центра (например, водородная связь , силы Ван-дер-Ваальса). Специфическое и благоприятное связывание происходит внутри активного центра до тех пор, пока субстрат не сформируется, чтобы перейти в высокоэнергетическое переходное состояние. Формирование переходного состояния более благоприятно для катализатора, поскольку благоприятные стабилизирующие взаимодействия внутри активного центра высвобождаютэнергия. Химическая реакция способна более легко производить молекулу с переходным состоянием с высокой энергией, когда есть стабилизирующая подгонка в активном центре катализатора. Энергия связи реакции - это энергия, выделяемая при благоприятных взаимодействиях между субстратом и катализатором. Высвободившаяся энергия связи способствует достижению нестабильного переходного состояния. В противном случае реакции без катализаторов требуют более высоких затрат энергии для достижения переходного состояния. Некаталитические реакции не имеют свободной энергии, доступной в результате взаимодействий, стабилизирующих активный центр, таких как каталитические ферментативные реакции. [12]
Связь с энергией активации Гиббса [ править ]
В уравнении Аррениуса термин энергия активации ( E a ) используется для описания энергии, необходимой для достижения переходного состояния , и выполняется экспоненциальная зависимость k = A exp (- E a / RT ). В теории переходного состояния для описания скорости реакции используется более сложная модель связи между скоростями реакции и переходным состоянием, внешне похожее математическое соотношение, уравнение Эйринга : k = ( k B T / h ) exp (–Δ G ‡ /RT ). Однако вместо феноменологического моделирования температурной зависимости скорости реакции уравнение Эйринга моделирует отдельные элементарные стадии реакции. Таким образом, для многоступенчатого процесса нет прямой связи между двумя моделями. Тем не менее, функциональные формы уравнений Аррениуса и Эйринга схожи, и для одношагового процесса можно провести простые и химически значимые соответствия между параметрами Аррениуса и Эйринга.
Вместо того, чтобы также использовать E a , уравнение Эйринга использует понятие энергии Гиббса и символ Δ G ‡ для обозначения энергии Гиббса активации для достижения переходного состояния . В уравнении k B и h - постоянные Больцмана и Планка соответственно. Хотя уравнения выглядят похожими, важно отметить, что энергия Гиббса содержит энтропийный член в дополнение к энтальпийному. В уравнении Аррениуса, этот термин энтропийный объясняются предэкспоненциальным фактор А . Более конкретно, мы можем записать свободную энергию активации Гиббса через энтальпию иэнтропия активации : Δ G ‡ = Δ H ‡ - T Δ S ‡ . Тогда для мономолекулярной одностадийной реакции справедливы приближенные соотношения E a = Δ H ‡ + RT и A = ( k B T / h ) exp (1 + Δ S ‡ / R ). Заметим, однако, что в собственно теории Аррениуса A не зависит от температуры, тогда как здесь существует линейная зависимость от T. Для одностадийного мономолекулярного процесса, период полураспада которого при комнатной температуре составляет около 2 часов, Δ G ‡ составляет примерно 23 ккал / моль. Это также примерно величина E a для реакции, которая протекает в течение нескольких часов при комнатной температуре. Из-за относительно небольшой величины T Δ S ‡ и RT при обычных температурах для большинства реакций, в небрежном дискурсе E a , Δ G ‡ и Δ H ‡ часто объединяются и все называются «энергией активации».
Энтальпия, энтропия и энергия Гиббса активации более правильно записывать как Δ ‡ H o , Δ ‡ S o и Δ ‡ G o соответственно, где o означает величину, оцениваемую между стандартными состояниями . [13] [14] Однако некоторые авторы опускают o, чтобы упростить обозначения. [15] [16]
Однако полное изменение свободной энергии реакции не зависит от энергии активации. Физические и химические реакции могут быть как экзергоническими, так и эндергоническими , но энергия активации не связана со спонтанностью реакции. Общее изменение энергии реакции не зависит от энергии активации.
Отрицательная энергия активации [ править ]
В некоторых случаях скорость реакции снижается с повышением температуры. Если следовать приблизительно экспоненциальной зависимости, чтобы константа скорости все еще соответствовала выражению Аррениуса, это приводит к отрицательному значению E a . Элементарные реакции, демонстрирующие эти отрицательные энергии активации, обычно являются безбарьерными реакциями, в которых протекание реакции зависит от захвата молекул в потенциальной яме. Повышение температуры приводит к уменьшению вероятности захвата сталкивающихся молекул друг друга (при этом большее количество скользящих столкновений не приводит к реакции, поскольку более высокий импульс уносит сталкивающиеся частицы из потенциальной ямы), выраженную в виде сечения реакциикоторая уменьшается с повышением температуры. Такая ситуация уже не приводит к прямым интерпретациям как высота потенциального барьера. [17]
Энергия активации на двумерной поверхности потенциальной энергии [ править ]
Энергия активации может быть представлена в виде двумерных поверхностей потенциальной энергии (PES), где соотношение между геометрией реагентов и задействованной энергией представлено в виде топографической карты.
На следующем рисунке представлена реакция между водородом в газовой фазе и металлом: вольфрамом. Потенциальная энергия получена с помощью расчетов PES и согласуется с положением H из расчетов методом NEB . Двумерная интерполяция методом сплайнов может использоваться для оценки потенциальной энергии в этих положениях. [18] Продукты и реагенты можно найти на синей поверхности, однако красная поверхность соответствует стационарному приближению.
Изображения соответствуют траекториям. Чем голубее поверхность, тем сильнее водородные связи, поэтому синие цвета представляют минимум энергии, а красные цвета - максимум. PES вольфрама является симметричным и имеет провал в месте перемычки, этот провал соответствует изменению цвета в центре изображения.
Чем синее поверхность между энергетическими минимумами, тем ниже энергетические барьеры и, следовательно, тем легче водород перемещается по поверхностям.
См. Также [ править ]
- Асимптотика энергии активации
- Химическая кинетика
- Точка возгорания
- Средняя кинетическая температура
- Квантовое туннелирование
- Водородная безопасность
- Взрыв пыли
- Свеча зажигания
Ссылки [ править ]
- ^ «Энергия активации» . www.chem.fsu.edu . Архивировано из оригинала на 2016-12-07 . Проверено 13 января 2017 .
- ^ Эспенсон, Джеймс (1995). Химическая кинетика и механизмы реакций . Макгроу-Хилл. ISBN 0070202605.
- ^ "Энергия активации и уравнение Аррениуса - Введение в химию - 1-е канадское издание" . opentextbc.ca . Проверено 5 апреля 2018 .
- ^ http://www.physics.ohio-state.edu/~kagan/phy367/Lectures/P367_lec_14.html [ требуется полная ссылка ]
- ^ «Лекция XIV» . www.asc.ohio-state.edu . Проверено 22 марта 2019 .
- ^ Пратт, Томас Х. "Электростатические возгорания при пожарах и взрывах" Центр Wiley-AIChE (15 июля 1997 г.) по безопасности химических процессов [ необходима страница ]
- ^ Ван, Дженкдо; Радж, Риши (1990). «Оценка энергии активации для граничной диффузии от спекания с регулируемой скоростью чистого оксида алюминия и оксида алюминия, легированного диоксидом циркония или титана». Журнал Американского керамического общества . 73 (5): 1172. DOI : 10.1111 / j.1151-2916.1990.tb05175.x .
- ^ Kiraci, A; Юрцевен, Х (2012). "Температурная зависимость частоты комбинационного рассеяния, постоянной затухания и энергии активации мягко-оптической моды в сегнетоэлектрическом титанате бария". Сегнетоэлектрики . 432 : 14–21. DOI : 10.1080 / 00150193.2012.707592 . S2CID 121142463 .
- ^ Terracciano, Энтони C; Де Оливейра, Самуэль; Васкес-Молина, Деметриус; Урибе-Ромо, Фернандо Дж. Васу, Субит С; Орловская, Нина (2017). «Влияние каталитически активного покрытия Ce 0.8 Gd 0.2 O 1.9 на гетерогенное горение метана в пористой керамике ZrO 2, стабилизированной MgO». Горение и пламя . 180 : 32–39. DOI : 10.1016 / j.combustflame.2017.02.019 .
- ^ "General Chemistry Online: FAQ: Химические изменения: Каковы некоторые примеры реакций, в которых участвуют катализаторы?" . antoine.frostburg.edu . Проверено 13 января 2017 .
- ^ Буй, Мэтью. «Закон Аррениуса: энергии активации» . Химия LibreTexts . Калифорнийский университет в Дэвисе . Проверено 17 февраля 2017 года .
- ^ Берг, Джереми (2019). Биохимия - Девятое издание . Нью-Йорк, штат Нью-Йорк: WH Freeman and Company. С. 240–244. ISBN 978-1-319-11467-1.
- ^ «Энтальпия активации» . Золотая книга ИЮПАК (2-е издание, онлайн-версия) . IUPAC (Международный союз теоретической и прикладной химии). 2019 . Дата обращения 10 мая 2020 .
- ^ Steinfeld, Джеффри I .; Франциско, Джозеф С .; Хасе, Уильям Л. (1999). Химическая кинетика и динамика (2-е изд.). Прентис Холл. п. 301. ISBN. 0-13-737123-3.
- ^ Аткинс, Питер; де Паула, Хулио (2006). Физическая химия Аткинса (8-е изд.). WHFreeman. п. 883 . ISBN 0-7167-8759-8.
... но мы опускаем стандартный знак состояния, чтобы не перегружать обозначения.
- ^ Laidler, Кейт Дж .; Мейзер, Джон Х. (1982). Физическая химия . Бенджамин / Каммингс. п. 381. ISBN. 0-8053-5682-7.
- ^ Mozurkewich, Майкл; Бенсон, Сидней (1984). «Отрицательные энергии активации и кривые графики Аррениуса. 1. Теория реакций над потенциальными ямами». J. Phys. Chem . 88 (25): 6429–6435. DOI : 10.1021 / j150669a073 .
- ^ Kristinsdóttir, Лиля; Скуласон, Эгилл (01.09.2012). "Систематическое исследование диффузии водорода на поверхностях переходных металлов методом DFT" . Наука о поверхности . 606 (17): 1400–1404. DOI : 10.1016 / j.susc.2012.04.028 . ISSN 0039-6028 .

