 | |
 | |
| Имена | |
|---|---|
| Предпочтительное название IUPAC Этоксиэтан | |
| Другие имена Диэтиловый эфир; Детер; Этиловый эфир; Этилоксид; 3-оксапентан; Этоксиэтан; Диэтилоксид; Растворитель эфирный; Серный эфир | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| 1696894 | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| ChemSpider | |
| ECHA InfoCard | 100.000.425 |
| Номер ЕС |
|
| 25444 | |
| КЕГГ | |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 1155 |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| С 4 Н 10 О | |
| Молярная масса | 74,123 г · моль -1 |
| Внешность | Бесцветная жидкость |
| Запах | Сухой, ромовый, сладковатый запах [1] |
| Плотность | 0,7134 г / см 3 , жидкость |
| Температура плавления | -116,3 ° С (-177,3 ° F, 156,8 К) |
| Точка кипения | 34,6 ° С (94,3 ° F, 307,8 К) [2] |
| 6,05 г / 100 мл [3] | |
| журнал P | 0,98 [4] |
| Давление газа | 440 мм рт. Ст. При 20 ° C (58,66 кПа при 20 ° C) [1] |
| −55,1 · 10 −6 см 3 / моль | |
Показатель преломления ( n D ) | 1,353 (20 ° С) |
| Вязкость | 0,224 сП (25 ° C) |
| Структура | |
Дипольный момент | 1,15 D (газ) |
| Термохимия | |
Теплоемкость ( C ) | 172,5 Дж / моль · К |
Стандартная мольная энтропия ( S | 253,5 Дж / моль · К |
Std энтальпия формации (Δ F H ⦵ 298 ) | −271,2 ± 1,9 кДж / моль |
Std энтальпии сгорания (Δ с Н ⦵ 298 ) | -2732,1 ± 1,9 кДж / моль |
| Фармакология | |
Код УВД | N01AA01 ( ВОЗ ) |
| Опасности | |
| Основные опасности | Чрезвычайно легковоспламеняющийся, вредный для кожи, разлагается до взрывоопасных перекисей в воздухе и свете [1] |
| Паспорт безопасности | См .: страницу данных Внешний паспорт безопасности материала |
| Пиктограммы GHS | |
| Сигнальное слово GHS | Опасность |
Положения об опасности GHS | H224 , H302 , H336 |
Меры предосторожности GHS | P210 , P233 , P240 , P241 , P242 , P243 , P261 , P264 , P270 , P271 , P280 , P301 + 312 , P303 + 361 + 353 , P304 + 340 , P312 , P330 , P370 + 378 , P403 + 233 , P403 + 235 , P405 , P501 |
| NFPA 704 (огненный алмаз) |  2 4 1 |
| точка возгорания | -45 ° С (-49 ° F, 228 К) [7] |
самовоспламенения температуру | 160 ° C (320 ° F, 433 K) [7] |
| Пределы взрываемости | 1,9–48,0% [5] |
| Смертельная доза или концентрация (LD, LC): | |
ЛК 50 ( средняя концентрация ) | 73000 частей на миллион (крыса, 2 часа) 6500 частей на миллион (мышь, 1,65 часа) [6] |
LC Lo ( самый низкий опубликованный ) | 106 000 частей на миллион (кролик) 76 000 частей на миллион (собака) [6] |
| NIOSH (пределы воздействия на здоровье в США): | |
PEL (Допустимо) | TWA 400 частей на миллион (1200 мг / м 3 ) [1] |
REL (рекомендуется) | REL не установлен [1] |
IDLH (Непосредственная опасность) | 1900 страниц в минуту [1] |
| Родственные соединения | |
Связанные эфиры | Диметиловый эфир Метоксипропан |
Родственные соединения | Диэтилсульфид Бутанолы ( изомер ) |
| Страница дополнительных данных | |
Структура и свойства | Показатель преломления ( n ), диэлектрическая проницаемость (ε r ) и т. Д. |
Термодинамические данные | Фазовое поведение твердое тело – жидкость – газ |
Спектральные данные | УФ , ИК , ЯМР , МС |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
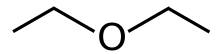
Диэтиловый эфир , или просто эфир , представляет собой органическое соединение , в эфирном класса с формулой ( С
2ЧАС
5)
2O , иногда сокращенно Et
2O (см. Символы псевдоэлементов ). Это бесцветная, очень летучая , сладко пахнущая («эфирный запах»), чрезвычайно легковоспламеняющаяся жидкость . Обычно он используется в качестве растворителя в лабораториях и в качестве пусковой жидкости для некоторых двигателей. Раньше он использовался в качестве общего анестетика , пока не были разработаны негорючие препараты, такие как галотан . Он использовался в качестве рекреационного наркотика, чтобы вызвать интоксикацию . Это структурный изомер из бутанола .
Производство [ править ]
Наиболее простой диэтиловый эфир получают в качестве побочного продукта в паровой фазе гидратации из этилена , чтобы сделать этанол . В этом процессе используются катализаторы на основе фосфорной кислоты на твердой подложке, и при необходимости его можно отрегулировать для получения большего количества эфира. [8] Парофазная дегидратация этанола на некоторых катализаторах из оксида алюминия может дать выход диэтилового эфира до 95%. [9]
Диэтиловый эфир может быть получен как в лабораториях, так и в промышленных масштабах путем синтеза кислого эфира. [10] Этанол смешивают с сильной кислотой, обычно серной кислотой , H 2 SO 4 . Кислота диссоциирует в водной среде с образованием ионов гидроксония H 3 O + . Ион водорода протонирует на электроотрицательный атом кислорода в этаноле , давая молекуле этанола положительный заряд:
- СН 3 СН 2 ОН + Н 3 О + → СН 3 СН 2 ОН 2 + + Н 2 О
Нуклеофильный атом кислорода непротонированного этанола вытесняет молекулу воды от протонированного ( электрофильной ) молекулы этанола, производя воду, ион водорода и диэтиловый эфир.
- CH 3 CH 2 OH 2 + + CH 3 CH 2 OH → H 2 O + H + + CH 3 CH 2 OCH 2 CH 3
Эта реакция должна проводиться при температурах ниже 150 ° C, чтобы гарантировать, что продукт элиминирования ( этилен ) не является продуктом реакции. При более высоких температурах этанол дегидратируется с образованием этилена. Реакция образования диэтилового эфира обратима, поэтому в конечном итоге достигается равновесие между реагентами и продуктами. Получение хорошего выхода эфира требует, чтобы эфир был отогнан из реакционной смеси, прежде чем он превратится в этанол, используя принцип Ле Шателье . [ необходима цитата ]
Другая реакция , которая может быть использована для получения простых эфиров является синтезом эфира Williamson , в котором алкоксид (получает путь растворения щелочного металла в спирте , который будет использоваться) выполняет нуклеофильное замещение , при возникновении алкилгалогенида . [ необходима цитата ]
Использует [ редактировать ]
Он особенно важен в качестве растворителя при производстве целлюлозных пластиков, таких как ацетат целлюлозы . [8]
Топливо [ править ]
Диэтиловый эфир имеет высокое цетановое число 85–96 и используется в качестве стартовой жидкости в сочетании с нефтяными дистиллятами для бензиновых и дизельных двигателей [11] из-за его высокой летучести и низкой температуры вспышки . Эфирная пусковая жидкость продается и используется в странах с холодным климатом, поскольку она может помочь при холодном запуске двигателя при минусовых температурах. По той же причине он также используется в качестве компонента топливной смеси для карбюраторных двигателей с воспламенением от сжатия . В этом отношении диэтиловый эфир очень похож на один из его предшественников, этанол . [ необходима цитата ]
Лаборатория использует [ править ]
Диэтиловый эфир представляет собой твердое основание Льюиса, которое реагирует с различными кислотами Льюиса, такими как I 2 , фенол и Al (CH 3 ) 3 , и его основные параметры в модели ECW составляют E B = 1,80 и C B = 1,63. Диэтиловый эфир - распространенный апротонный растворитель в лабораторных условиях . Он имеет ограниченную растворимость в воде (6,05 г / 100 мл при 25 ° C [3] ) и растворяет 1,5 г / 100 г (1,0 г / 100 мл) воды при 25 ° C. [12] Это, в сочетании с его высокой летучестью, делает его идеальным для использования в качестве неполярного растворителя при экстракции жидкость-жидкость.. При использовании с водным раствором слой диэтилового эфира находится сверху, поскольку он имеет более низкую плотность, чем вода. Это также обычный растворитель для реакции Гриньяра в дополнение к другим реакциям с участием металлоорганических реагентов. Поскольку он применяется при производстве запрещенных веществ, он включен в перечень прекурсоров Таблицы II в соответствии с Конвенцией Организации Объединенных Наций о борьбе с незаконным оборотом наркотических средств и психотропных веществ, а также таких веществ, как ацетон , толуол и серная кислота . [13]
Использование анестетиков [ править ]
Уильям Т.Г. Мортон участвовал в публичной демонстрации эфирной анестезии 16 октября 1846 года в Ether Dome в Бостоне, штат Массачусетс . Однако теперь известно , что Кроуфорд Уильямсон Лонг в частном порядке продемонстрировал его использование в качестве общего анестетика в хирургии чиновникам в Джорджии еще 30 марта 1842 года, а Лонг публично продемонстрировал использование эфира в качестве хирургического анестетика шесть раз перед демонстрацией в Бостоне. . [14] [15] [16] Британские врачи знали об анестезирующих свойствах эфира еще в 1840 году, когда его широко прописывали вместе с опиумом. [17] Диэтиловый эфир в значительной степени вытеснил использованиехлороформ в качестве общего анестетика из-за более благоприятного терапевтического индекса эфира , то есть большей разницы между эффективной дозой и потенциально токсичной дозой. [18]
Диэтиловый эфир не угнетает миокард, а скорее стимулирует симпатическую нервную систему, что приводит к гипертонии и тахикардии. Он безопасно используется у пациентов с шоком, так как сохраняет барорецепторный рефлекс . [19] Его минимальное воздействие на угнетение миокарда, респираторный драйв, низкая стоимость и высокий терапевтический индекс позволяют ему продолжать использование в развивающихся странах. [20] Диэтиловый эфир можно также смешивать с другими анестетиками, такими как хлороформ, чтобы получить смесь CE , или хлороформ и спирт, чтобы приготовить смесь ACE.. В 21 веке эфир используется редко. Использование легковоспламеняющегося эфира было заменено негорючими анестетиками на основе фторированных углеводородов. Галотан был первым таким анестетиком, а другие используемые в настоящее время ингаляционные анестетики, такие как изофлуран, десфлуран и севофлуран, являются галогенированными эфирами. [21] Было обнаружено, что диэтиловый эфир имеет нежелательные побочные эффекты, такие как тошнота и рвота после анестезии. Современные анестетики уменьшают эти побочные эффекты. [14]
До 2005 года он входил в Список основных лекарственных средств Всемирной организации здравоохранения для использования в качестве анестетика. [22] [23]
Медицинское использование [ править ]
Когда-то эфир использовался в фармацевтических препаратах. Смесь спирта и эфира, одна часть диэтилового эфира и три части этанола, была известна как «Дух эфира» , анодин Хоффмана или капли Хоффмана. В Соединенных Штатах эта смесь была исключена из Фармакопеи в какой-то момент до июня 1917 года [24], поскольку исследование, опубликованное Уильямом Проктером-младшим в American Journal of Pharmacy еще в 1852 году, показало, что существуют различия в формулировке. можно найти между коммерческими производителями, между международной фармакопеей и оригинальным рецептом Хоффмана. [25] Он также используется для лечения икоты.путем закапывания в полость носа. [26]
Рекреационное использование [ править ]
Обезболивающее и опьяняющее действие эфира сделали его наркотиком для развлечения. Диэтиловый эфир в дозировке анестетика - это средство для ингаляции, которое давно используется в рекреационных целях. Одним из недостатков является высокая воспламеняемость, особенно в сочетании с кислородом. Одним из преимуществ является четко определенная разница между терапевтическими и токсическими дозами, что означает, что человек потеряет сознание до того, как будет достигнут опасный уровень растворенного эфира в крови. Обладая сильным густым запахом, эфир вызывает раздражение слизистой оболочки дыхательных путей и вызывает дискомфорт при дыхании, а при передозировке вызывает слюноотделение, рвоту, кашель или спазмы. При концентрациях в воздухе 3–5% анестезирующий эффект может медленно достигаться за 15–20 минут дыхания примерно 15–20 мл эфира, в зависимости от массы тела и физического состояния.Эфир вызывает очень долгую стадию возбуждения перед потемнением.[ необходима цитата ]
Использование эфира в рекреационных целях также имело место на организованных вечеринках в 19 веке, называемых эфирными шалостями , где гостей поощряли вдыхать терапевтические количества диэтилового эфира или закиси азота , вызывая состояние возбуждения. Лонг, а также его коллеги-стоматологи Гораций Уэллс , Уильям Эдвард Кларк и Уильям Т.Г. Мортон заметили, что во время этих собраний люди часто получали незначительные травмы, но, похоже, не проявляли никакой реакции на травму или не вспоминали, что это произошло, демонстрируя обезболивающий эффект эфира. . [27]
В XIX и начале XX веков среди польских крестьян было популярно употребление эфира. [28] Это традиционный и все еще относительно популярный рекреационный наркотик среди лемков . [29] Обычно его употребляют в небольшом количестве ( кропка , или «точка»), поливая молоком , сахарной водой или апельсиновым соком в рюмке . Известно, что как наркотик он вызывает психологическую зависимость , иногда называемую эфироманией. [30] [ требуется медицинская ссылка ]
Метаболизм [ править ]
Предполагается, что фермент цитохрома P450 метаболизирует диэтиловый эфир. [31]
Диэтиловый эфир ингибирует алкогольдегидрогеназу и, таким образом, замедляет метаболизм этанола . [32] Он также подавляет метаболизм других лекарств, требующих окислительного метаболизма . Например, диазепам требует окисления в печени, тогда как его окисленный метаболит оксазепам - нет. [33]
Безопасность и стабильность [ править ]
Диэтиловый эфир легко воспламеняется и может образовывать взрывоопасные смеси пар / воздух. [34]
Поскольку эфир тяжелее воздуха, он может собираться низко к земле, а пар может перемещаться на значительные расстояния к источникам возгорания, которые не обязательно должны быть открытым пламенем, но могут быть горячей плитой, паровой трубой, нагревателем и т. Д. [34] Пар может воспламениться статическим электричеством, которое может накапливаться, когда эфир переливается из одного сосуда в другой. Температура самовоспламенения диэтилового эфира составляет 160 ° C (320 ° F). Обычной практикой в химических лабораториях является использование пара (таким образом, ограничение температуры до 100 ° C (212 ° F)), когда эфир необходимо нагревать или перегонять. Диффузия диэтилового эфира в воздухе составляет 9,18 × 10 -6 м 2 / с (298 К, 101,325 кПа). [ необходима цитата ]
Эфир чувствителен к свету и воздуху, склонен к образованию взрывоопасных пероксидов . [34] Пероксиды эфира имеют более высокую температуру кипения, чем эфир, и при высыхании являются контактными взрывчатыми веществами. [34] Коммерческий диэтиловый эфир обычно поставляется со следовыми количествами антиоксиданта, бутилированного гидрокситолуола (ВНТ), который снижает образование пероксидов. Хранение над гидроксидом натрия приводит к осаждению промежуточных гидропероксидов простого эфира. Воду и пероксиды можно удалить либо перегонкой из натрия и бензофенона , либо пропусканием через колонку активированного оксида алюминия . [35]
История [ править ]
Это соединение могло быть синтезировано либо Джабиром ибн Хайяном в 8 веке [36], либо Рамоном Лулллом в 1275 году. [36] [37] Оно было синтезировано в 1540 году Валериусом Кордусом , который назвал его «сладким маслом купороса» ( oleum dulce vitrioli ) - название отражает тот факт, что его получают путем дистилляции смеси этанола и серной кислоты (тогда известной как купоросное масло), и отмечены некоторые его лечебные свойства . [36] Примерно в то же время Парацельс обнаружил обезболивающие свойства молекулы у собак. [36]Название эфир дал веществу в 1729 году Август Зигмунд Фробениус . [38]
Считалось, что это соединение серы, пока эта идея не была опровергнута примерно в 1800 году [39].
Ссылки [ править ]
- ^ a b c d e f Карманный справочник NIOSH по химической опасности. «# 0277» . Национальный институт охраны труда и здоровья (NIOSH).
- ^ "Диэтиловый эфир" . ChemSpider . Проверено 19 января 2017 года .
- ^ a b Merck Index , 10-е издание, Марта Виндхольц, редактор, Merck & Co., Inc, Рэуэй, Нью-Джерси, 1983, стр. 551
- ^ "Diethyl ether_msds" .
- ^ Карл Л. Yaws, химические свойства Handbook , McGraw-Hill, НьюЙорк, 1999, стр 567
- ^ a b «Этиловый эфир» . Немедленно опасная для жизни или здоровья концентрация (IDLH) . Национальный институт охраны труда и здоровья (NIOSH).
- ^ a b «Паспорт безопасности этилового эфира» . Дж. Т. Бейкер. Архивировано из оригинала на 2012-03-28 . Проверено 24 июня 2010 .
- ^ a b "Эфиры, Лоуренс Карас и У. Дж. Пиль". Энциклопедия химической технологии Кирк-Отмера . Джон Уайли и сыновья, Inc. 2004.
- ^ Этиловый эфир, Chem. Справочник по экономике . Менло-Парк, Калифорния: SRI International. 1991 г.
- ^ Коэн, Юлиус Беренд (1920). Учебник органической химии, том 1 . Лондон: Macmillan and Co., стр. 39 .
структура этилового спирта диэтилового эфира cohen julius.
- ^ «Пусковая жидкость повышенной прочности: как это работает» . Валвовин. Архивировано из оригинала на 2007-09-27 . Проверено 5 сентября 2007 .
- ^ HH Роули; Wm. Р. Рид (1951). «Растворимость воды в диэтиловом эфире при 25 °». Варенье. Chem. Soc . 73 (6): 2960. DOI : 10.1021 / ja01150a531 .
- ^ Microsoft Word - RedListE2007.doc Архивировано 27 февраля 2008 г., на Wayback Machine
- ^ a b Хилл, Джон В. и Колб, Дорис К. Химия для изменения времен: 10-е издание . п. 257. Пирсон: Прентис Холл. Река Аппер Сэдл, Нью-Джерси. 2004 г.
- ↑ Мэдден, М. Лесли (14 мая 2004 г.). «Кроуфорд Лонг (1815–1878)» . Энциклопедия Новой Джорджии . Пресса Университета Джорджии . Проверено 13 февраля 2015 года .
- ^ "Кроуфорд У. Лонг" . День врача . Южная медицинская ассоциация. Архивировано из оригинального 13 февраля 2015 года . Проверено 13 февраля 2015 года .
- ^ Граттан, Н. "Лечение маточного кровотечения". Провинциальный медико-хирургический журнал . Vol. 1, No. 6 (7 ноября 1840 г.), p. 107.
- Перейти ↑ Calderone, FA (1935). «Исследования дозировки эфира после преанестезиологического лечения наркотиками (барбитураты, сульфат магния и морфин)» (PDF) . Журнал фармакологии и экспериментальной терапии . 55 (1): 24–39.
- ^ https://anesthesiageneral.com/ether-effects/
- ^ «Эфир и его эффекты в анестезии» . 2010-10-31. Цитировать журнал требует
|journal=( помощь ) - ^ Морган, Г. Эдвард, младший и др. (2002). Клиническая анестезиология 3-е изд. Нью-Йорк: Мак Гроу-Хилл. п. 3.
- ^ "Основные лекарственные средства Примерный перечень ВОЗ (пересмотрен в апреле 2003 г.)" (PDF) . apps.who.int (13-е изд.). Женева, Швейцария: Всемирная организация здравоохранения. Апрель 2003 . Проверено 6 сентября 2017 года .
- ^ "Основные лекарственные средства Примерный перечень ВОЗ (пересмотренный в марте 2005 г.)" (PDF) . apps.who.int (14-е изд.). Женева, Швейцария: Всемирная организация здравоохранения. Март 2005. Архивировано из оригинального (PDF) 5 августа 2005 года . Проверено 6 сентября 2017 года .
- ^ Национальный аптекарь, Том 47, июнь 1917, pp.220
- ^ Проктер младший, Уильям (1852). "На анодином ликере Хоффмана" . Американский фармацевтический журнал . 28 .
- ^ ncbi, Лечение икоты закапыванием эфира в полость носа.
- ^ «Как эфир перешел от развлекательного« веселого »препарата до первого хирургического анестетика» . Смитсоновский журнал . Проверено 11 октября 2020 .
- ^ Зандберг, Адриан (2010). «Краткая статья« Деревни… Пахнет эфирными парами »: Эфирное питье в Силезии до 1939 года» . История болезни . 54 (3): 387–396. DOI : 10,1017 / s002572730000466x . PMC 2890321 . PMID 20592886 .
- ^ Kaszycki, Нестор (2006-08-30). "Emkowska Watra w dyni 2006 - pilnowanie ognia pamięci" . Histmag.org - история од подшевки (на польском языке). Краков, Польша: i-Press . Проверено 25 ноября 2009 .
Dawniej eteru używało się w lecznictwie do narkozy, ponieważ ma właściwości halucynogenne, a już kilka kropel inhalacji wystarczyło do silnego znieczulenia pacjenta. Jednak eter, jak każda ciecz, może teoretycznie być napojem. Łemkowie tę teorię praktykują. Mimo to, название skroplonego eteru - "kropki" - их "napojem narodowym" byłoby przesadą. Chociaż stanowi to pewną część mitu "bycia emkiem".
- ^ Кренц, Соня; Циммерманн, Грегуар; Колли, Стефан; Зуллино, Даниэле Фабио (август 2003 г.). «Эфир: забытая зависимость» . Зависимость . 98 (8): 1167–1168. DOI : 10,1046 / j.1360-0443.2003.00439.x . PMID 12873252 .
- ^ 109. Мутантный штамм 241 Aspergillus flavus, заблокированный при биосинтезе афлатоксина, не накапливает транскрипт aflR. Мэтью П. Браун и Гэри А. Пейн, Университет штата Северная Каролина , Роли, Северная Каролина 27695 fgsc.net
- ^ PT Норманн; А. Рипель; Дж. Морланд (1987). «Диэтиловый эфир ингибирует метаболизм этанола in vivo за счет взаимодействия с алкогольдегидрогеназой». Алкоголизм: клинические и экспериментальные исследования . 11 (2): 163–166. DOI : 10.1111 / j.1530-0277.1987.tb01282.x . PMID 3296835 .
- ^ Ларри К. Кифер; Уильям А. Гарланд; Нил Ф. Олдфилд; Джеймс Э. Свагздис; Брюс А. Мико (1985). «Ингибирование метаболизма N-нитрозодиметиламина у крыс эфирной анестезией» (PDF) . Исследования рака . 45 (11 Pt 1): 5457–60. PMID 4053020 .
- ^ a b c d «Архивная копия» (PDF) . Архивировано из оригинального (PDF) 13 ноября 2014 года . Проверено 15 февраля 2014 . CS1 maint: заархивированная копия как заголовок ( ссылка )
- ^ WLF Armarego; CLL Chai (2003). Очистка лабораторных химикатов . Бостон: Баттерворт-Хайнеманн. ISBN 978-0-7506-7571-0.
- ^ а б в г Тоски, Джудит А; Бэкон, Дуглас Р.; Калверли, Род К. (2001). История анестезиологии . В: Бараш, Пол Г; Каллен, Брюс Ф; Стултинг, Роберт К. Клиническая анестезия (4-е изд.). Липпинкотт Уильямс и Уилкинс. п. 3. ISBN 978-0-7817-2268-1.
- ^ Hademenos, Джордж Дж .; Мерфри, Шон; Захлер, Кэти; Уорнер, Дженнифер М. (12 ноября 2008 г.). PCAT Макгроу-Хилла . Макгроу-Хилл. п. 39. ISBN 978-0-07-160045-3. Проверено 25 мая 2011 .
- ^ "VIII. Отчет о spiritus vini æthereus, вместе с несколькими экспериментами, предпринятыми с ним". Философские труды Лондонского королевского общества . 36 (413): 283–289. 1730 DOI : 10.1098 / rstl.1729.0045 . S2CID 186207852 .
- Перейти ↑ Chisholm, Hugh, ed. (1911). . Британская энциклопедия . 9 (11-е изд.). Издательство Кембриджского университета. п. 806.
Внешние ссылки [ править ]
| Викискладе есть медиафайлы, связанные с диэтиловым эфиром . |
- Объявление Майклом Фарадеем эфира в качестве анестетика в 1818 году
- Расчет давления пара , плотности жидкости , динамической вязкости жидкости , поверхностного натяжения диэтилового эфира, ddbonline.ddbst.de
- CDC - Карманный справочник NIOSH по химическим опасностям