Эта статья требует дополнительных ссылок для проверки . ( октябрь 2014 г. ) ( Узнайте, как и когда удалить этот шаблон сообщения ) |
Ион водорода создается , когда атом водорода теряет или приобретает электрон . Положительно заряженный ион водорода (или протон) может легко объединяться с другими частицами и поэтому виден изолированным только тогда, когда он находится в газообразном состоянии или в пространстве, почти свободном от частиц. [1] Из-за его чрезвычайно высокой плотности заряда, примерно в 2 × 10 10 раз превышающей плотность заряда иона натрия, чистый ион водорода не может свободно существовать в растворе, поскольку он легко гидратируется, то есть быстро связывается. [2] ион водорода , рекомендованный IUPAC как общий термин для всех ионов из водорода и его изотопов . [3] В зависимости отзаряд иона, можно выделить два разных класса: положительно заряженные ионы и отрицательно заряженные ионы.
Катион (положительно заряженный) [ править ]
Атом водорода состоит из ядра с зарядом +1 и одного электрона. Следовательно, единственный возможный положительно заряженный ион имеет заряд +1. Отмечается H + .
В зависимости от рассматриваемого изотопа катион водорода имеет разные названия:
- Гидрон : общее название, относящееся к положительному иону любого изотопа водорода (H + ).
- Протон : 1 H + (т.е. катион протия )
- Дейтрон : 2 H + , D +
- Тритон : 3 Н + , Т +
Кроме того, ионы, образующиеся в результате реакции этих катионов с водой, а также их гидраты , называются ионами водорода:
- Ион гидроксония : H 3 O +
- Катион Цунделя : H 5 O 2 + (назван в честь Георга Цунделя )
- Собственный катион : H 9 O 4 + (или H 3 O + • 3H 2 O) (назван в честь Манфреда Эйгена )
Катионы Цунделя и собственные катионы играют важную роль в диффузии протонов согласно механизму Гроттуса .
В отношении кислот «ионы водорода» обычно относятся к гидронам.
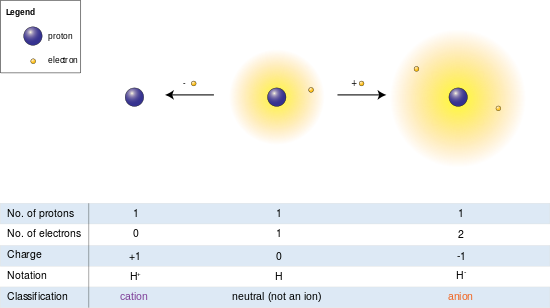
На изображении слева атом водорода (в центре) содержит один протон и один электрон. Удаление электрона дает катион (слева), а добавление электрона дает анион (справа). Анион водорода с его слабо удерживаемым двухэлектронным облаком имеет больший радиус, чем нейтральный атом, который, в свою очередь, намного больше, чем голый протон катиона. Водород образует единственный катион, у которого нет электронов, но даже катионы, которые (в отличие от водорода) все еще удерживают один или несколько электронов, все же меньше нейтральных атомов или молекул, от которых они произошли.
Анион (отрицательно заряженный) [ править ]
Анионы водорода образуются при приобретении дополнительных электронов:
- Гидрид : общее название, относящееся к отрицательному иону любого изотопа водорода (H - ).
- Протид: 1 H -
- Дейтерид: 2 H - , D -
- Тритид: 3 H - , T -
Использует [ редактировать ]
Ионы водорода управляют АТФ-синтазой в фотосинтезе . Это происходит, когда ионы водорода проталкиваются через мембрану, создавая высокую концентрацию внутри тилакоидной мембраны и низкую концентрацию в цитоплазме. Однако из-за осмоса H + вытеснит себя из мембраны через АТФ-синтазу. Используя свою кинетическую энергию для побега, протоны будут вращать АТФ-синтазу, которая, в свою очередь, будет создавать АТФ . Это происходит и при клеточном дыхании, хотя концентрированная мембрана вместо этого будет внутренней мембраной митохондрий .
Концентрация ионов водорода, измеряемая как pH, также отвечает за кислотную или основную природу соединения. Молекулы воды расщепляются с образованием H + и гидроксид-анионов. Этот процесс называется самоионизацией воды .
Подкисление океана [ править ]
Концентрация ионов водорода и pH обратно пропорциональны; в водном растворе повышенная концентрация ионов водорода приводит к низкому pH и, следовательно, к кислому продукту. По определению, кислота - это ион или молекула, которая может отдавать протон, и при введении в раствор она будет реагировать с молекулами воды (H 2 O) с образованием иона гидроксония (H 3 O + ), сопряженной кислоты с водой. . [4] Для упрощения рассуждений ион водорода (H + ) часто используется для сокращения иона гидроксония.
Подкисление океана является прямым следствием повышенных концентраций ионов водорода и карбонатного насыщения в результате значительного поглощения двуокиси углерода (CO 2 ) мировым океаном. [5] Доиндустриальное состояние карбонатной химии океана было особенно стабильным, включая баланс его pH. [6] После промышленной революции антропогенные выбросы в результате сжигания ископаемого топлива, производства цемента и изменений в землепользовании увеличили поглощение океанами двуокиси углерода из атмосферы на 30%. [7] В океане способность поглощения этого парникового газа в 59 раз выше, чем в атмосфере; [8]океан действует как крупнейший поглотитель углерода на планете, играя важную роль в регулировании климата. [9] Помимо потоков углерода, естественный процесс связывания углерода из атмосферы в глубоководный океан обеспечивается двумя системами: биологическим насосом и насосом растворимости. Насос для растворения - это физико-химический процесс, который переносит CO 2 на границе раздела воздух-море. [10] Согласно закону Генри количество растворенного CO 2 в водном растворе прямо пропорционально парциальному давлению CO 2 в атмосфере. [11] Для поддержания равновесия состояние высокого парциального давления CO 2. приводит к усиленному обмену этого газа в океане за счет молекулярной диффузии.
В поверхностных водах растворенный атмосферный углекислый газ (CO 2 (водн.) ) Реагирует с молекулами воды с образованием угольной кислоты (H 2 CO 3 ), слабой дипротонной кислоты. Дипротоновые кислоты состоят из двух ионизируемых атомов водорода в каждой молекуле. [12] В водном растворе частичная диссоциация угольной кислоты высвобождает протон водорода (H + ) и ион бикарбоната (HCO 3 - ), а затем ион бикарбоната диссоциирует на дополнительный протон водорода и ион карбоната (CO 3 2 - ). [13] Растворение и диссоциация этих неорганических разновидностей углерода приводит к увеличению концентрации ионов водорода и, наоборот, понижает pH окружающей поверхности океана. Карбонатная буферная система регулирует кислотность морской воды, поддерживая химическое равновесие растворенных неорганических углеродных частиц.
Химическое уравнение состоит из реагентов и продуктов, которые могут реагировать в любом направлении. Дополнительные реагенты, добавленные в систему, приводят к большему производству продукта (химическая реакция смещается вправо), и если добавляется больше продукта, образуются дополнительные реагенты, смещая химическую реакцию влево. Следовательно, в этой модели высокая концентрация исходного реагента, диоксида углерода, дает повышенное количество конечного продукта (H + и CO 3 2- ), тем самым снижая pH и создавая более кислый раствор. Естественная буферная система океана противостоит изменению pH, производя больше ионов бикарбоната, генерируемых протонами свободной кислоты, реагирующими с ионами карбоната, с образованием щелочного характера. [14] Однако увеличение содержания CO 2 в атмосфереконцентрации могут превышать порог буферной емкости, что, как следствие, приводит к более высоким темпам закисления океана. Изменения в химическом составе карбонатов океана могут влиять на биогеохимические циклы океана для многих элементов и соединений, оказывая глубокое воздействие на морские экосистемы. Кроме того, растворимость CO 2 зависит от температуры; повышенные температуры поверхностных вод снижают растворимость CO 2 . Постоянное повышение парциального давления CO 2 в атмосфере может потенциально превратить океан из функции стока (вертикальный перенос углерода в глубины океана) в источник ( дегазация CO 2 из океана), что приведет к дальнейшему повышению глобальной температуры. [15]
См. Также [ править ]
- Кислота
- Протонирование
- Катион дигидрогена
- Трехводородный катион
Ссылки [ править ]
- ^ «Ион водорода - химия» . britannica.com . Проверено 18 марта 2018 .
- ^ из-за его чрезвычайно высокой плотности заряда примерно в 2 × 10 10 раз больше, чем уиона натрия
- ^ Компендиум химической терминологии , 2-е издание McNaught, AD и Wilkinson, A. Blackwell Science, 1997 ISBN 0-86542-684-8 , также онлайн. Архивировано 12 декабря 2005 г.на Wayback Machine.
- ^ OpenStax, Химия. OpenStax CNX. 20 июня 2016 г. http://cnx.org/contents/[email protected] .
- ^ WS Broecker, T. Takahashi (1997) Нейтрализация ископаемого топлива CO 2 морским карбонатом кальция
- ↑ PN Pearson, MR Palmer (2000) Концентрации двуокиси углерода в атмосфере за последние 60 миллионов лет Nature, 406, стр. 695-699
- ^ CL Sabine, et al. (2004). Океанический сток для антропогенного CO 2 Science, 305 (5682), стр. 367-371.
- ^ Лал Р. (2008). Связывание углерода. Философские труды Лондонского королевского общества. Серия B, Биологические науки, 363 (1492), 815–830. https://doi.org/10.1098/rstb.2007.2185
- ^ Бен I. Mcneil & Richard J. Matear (2007). Ответы изменения климата на подкисление океана в будущем, Tellus B: Chemical and Physical Meteorology, 59: 2, 191-198
- ^ Hessen Д., Агрен Г., Андерсон Т., Элзер, J., & De Ruiter, P. (2004). Секвестрация углерода в экосистемах: роль стехиометрии. Экология, 85 (5), 1179-1192. Получено 22 ноября 2020 г. с http://www.jstor.org/stable/3450161.
- ^ Авишай DM, Тенни KM. Закон Генри. [Обновлено 7 сентября 2020 г.]. В: StatPearls [Интернет]. Остров сокровищ (Флорида): StatPearls Publishing; 2020 Янв. Доступно по ссылке : https://www.ncbi.nlm.nih.gov/books/NBK544301/
- ^ OpenStax, Химия. OpenStax CNX. 20 июня 2016 г. http://cnx.org/contents/[email protected] .
- ^ OpenStax, Химия. OpenStax CNX. 20 июня 2016 г. http://cnx.org/contents/[email protected] .
- ^ Мидделбурга, JJ, Soetaert, К., и Хагенс, М. (2020). Щелочность океана, буферность и биогеохимические процессы. Обзоры геофизики (Вашингтон, округ Колумбия: 1985), 58 (3), e2019RG000681. https://doi.org/10.1029/2019RG000681
- Перейти ↑ Matsumoto, K. (2007). Биогеологический контроль температуры в атмосферном pCO2 и биогеохимии океана. Письма о геофизических исследованиях, 34 (20). DOI: 10.1029 / 2007gl031301
| Эта статья включает список связанных элементов с одинаковыми (или похожими именами). Если внутренняя ссылка привела вас сюда неправильно, вы можете изменить ссылку, чтобы она указывала прямо на предполагаемую статью. |