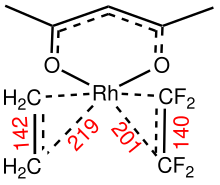Алкеновый комплекс переходного металла
В металлоорганической химии алкеновый комплекс переходного металла представляет собой координационное соединение , содержащее один или несколько алкеновых лигандов . Такие соединения являются промежуточными продуктами во многих каталитических реакциях, превращающих алкены в другие органические продукты. [1]
Простейшим моноалкеном является этен . Известно много комплексов этена, в том числе соль Цейзе (см. рисунок), Rh 2 Cl 2 (C 2 H 4 ) 4 , Cp* 2 Ti(C 2 H 4 ) и гомолептический Ni(C 2 H 4 ) 3 . Замещенный моноалкен включает циклический циклооктен , обнаруженный в димере хлорбис(циклооктен)родия . Алкены с электроноакцепторными группами обычно прочно связываются с низковалентными металлами. Примерами таких лигандов являются TCNE ,тетрафторэтилен , малеиновый ангидрид , эфиры фумаровой кислоты . Эти акцепторы образуют аддукты со многими нульвалентными металлами. [1]
Бутадиен , циклооктадиен и норборнадиен являются хорошо изученными хелатирующими агентами. Триены и даже некоторые тетраены могут связываться с металлами через несколько соседних углеродных центров. Типичными примерами таких лигандов являются циклогептатриен и циклооктатетраен . Связь часто обозначается с помощью формализма тактильности . Кето-алкены представляют собой тетрагапто-лиганды, которые стабилизируют сильно ненасыщенные низковалентные металлы, обнаруженные в (бензилиденацетоне)трикарбониле железа и трис(дибензилиденацетоне)дипалладии(0) .
Связь между алкенами и переходными металлами описывается моделью Дьюара-Чатта-Дункансона , которая включает передачу электронов с пи-орбитали алкена на пустые орбитали металла. Это взаимодействие усиливается обратной связью, которая влечет за собой разделение электронов на орбиталях других металлов на пустой пи-антисвязывающий уровень алкена. Ранние металлы низкой степени окисления (Ti(II), Zr(II), Nb(III) и др.) являются сильными пи-донорами, а их алкеновые комплексы часто описывают как металлоциклопропаны. Обработка таких видов кислотами дает алканы. Поздние металлы (Ir (I), Pt (II)), которые являются более бедными пи-донорами, имеют тенденцию взаимодействовать с алкеном как взаимодействие кислоты Льюиса с основанием Льюиса . Точно так же C 2 F 4является более сильным пи-акцептором, чем C 2 H 4 , что отражено в расстояниях связи металл-углерод. [2]
Барьер для вращения алкена вокруг вектора М-центроида является мерой прочности пи-связи М-алкена. Комплексы с низкой симметрией подходят для анализа этих вращательных барьеров , связанных со связью металл - этен . но вращения вокруг связи Rh-C 2 F 4 не наблюдается . [3]
Алкеновые лиганды теряют большую часть своего ненасыщенного характера при комплексообразовании. Наиболее известен алкеновый лиганд, подвергающийся мигрирующей вставке , при которой он внутримолекулярно атакуется алкильными и гидридными лигандами с образованием новых алкильных комплексов. Катионные алкеновые комплексы подвержены атаке нуклеофилов. [1]