Стойкий карбен
Стойкий карбен (также известный как стабильный карбен ) - это тип карбена , демонстрирующий особую стабильность. Наиболее известными примерами и, безусловно, самой крупной подгруппой являются N -гетероциклические карбены (NHC) [1] (иногда называемые карбенами Ардуенго ), например диаминокарбены с общей формулой (R 2 N) 2 C :, где четыре группы R обычно представляют собой алкильные и арильные группы. Группы могут быть связаны с образованием гетероциклических карбенов, таких как производные имидазола , имидазолина , тиазола илитриазол .
Традиционно карбены считаются настолько реактивными, что их изучали лишь косвенно, например, путем реакций захвата. Эта ситуация резко изменилась с появлением стойких карбенов. Хотя они являются довольно реактивными веществами, подвергающимися димеризации , многие из них могут быть выделены как чистые вещества.
Стойкие карбены, как правило, присутствуют в синглете . Их стабильность лишь частично объясняется стерическими препятствиями со стороны громоздких групп. Некоторые синглетные карбены термодинамически стабильны , их можно изолировать и хранить неограниченное время. Другие димеризуются медленно в течение нескольких дней. Период полураспада карбенов в триплетном состоянии измеряется секундами, поэтому их можно наблюдать, но нельзя хранить.
История
Ранние свидетельства
В 1957 году Рональд Бреслоу предположил, что относительно стабильный нуклеофильный карбен, производное тиазол-2-илидена , участвует в каталитическом цикле витамина B 1 (тиамина), который дает фуроин из фурфурола . [2] [3] В этом цикле тиазолиевое кольцо витамина обменивает атом водорода (связанный с углеродом 2 кольца) на остаток фурфурола. Было обнаружено, что в дейтерированной воде протон C2- быстро обменивается на дейтрон в статистическом равновесии . [4]
Этот обмен был предложен для осуществления через тиазол-2-илиден. В 2012 г. сообщалось о выделении так называемого интермедиата Бреслоу . [5] [6]
В 1960 году Ханс-Вернер Ванзлик и его коллеги предположили, что карбены, полученные из дигидроимидазол-2-илидена , были получены вакуумным пиролизом соответствующих соединений 2-трихлорметилдигидроимидазола с потерей хлороформа . [7] [8] [9] Они предположили, что карбен существует в равновесии со своим димером , производным тетрааминоэтилена , так называемое равновесие Ванзлика . Это предположение было оспорено Лемалом и его сотрудниками в 1964 году, которые представили доказательства того, что димер не диссоциирует; [10]и Винбергом в 1965 году. [11] Однако последующие эксперименты Денка, Херрманна и других подтвердили это равновесие, хотя и при определенных обстоятельствах. [12] [13]
Выделение стойких карбенов
В 1970 году группа Ванзлика получила имидазол-2-илиденкарбены путем депротонирования соли имидазолия . [14] Ванзлик, а также Роальд Хоффманн [ 9] [15] предположили, что эти карбены на основе имидазола должны быть более стабильными, чем их 4,5-дигидроаналоги, из-за ароматичности типа Хюккеля . Однако Ванзлик не выделил имидазол-2-илидены, а вместо этого выделил их координационные соединения с ртутью и изотиоцианатом :
В 1988 году Гай Бертран и другие выделили фосфинокарбен . Эти разновидности могут быть представлены либо как λ 3 -фосфинокарбен, либо как λ 5 - фосфацетилен : [16] [17]
Эти соединения были названы «двухтактными карбенами» из-за разного сродства к электрону атомов фосфора и кремния. Они проявляют как карбеновую, так и щелочную реакционную способность. Рентгеновская структура этой молекулы не была получена, и на момент публикации оставались некоторые сомнения относительно их точной карбенической природы.
В 1991 году Ардуенго и его коллеги кристаллизовали диаминокарбен путем депротонирования катиона имидазолия: [18]
Этот карбен, предшественник большого семейства карбенов с имидазол-2-илиденовым ядром, бесконечно стабилен при комнатной температуре в отсутствие кислорода и влаги. Плавится при 240–241 ° C без разложения. Спектр ЯМР 13 C показывает сигнал при 211 м.д. для атома карбеновой кислоты. [19] Рентгеновская структура выявила более длинные связи N – C в кольце карбена, чем в исходном имидазолиевом соединении, что указывает на очень слабый характер двойной связи для этих связей. [20]
Первый стабильный на воздухе илидовый карбен, хлорированный член семейства имидазол-2-илидена, был получен в 1997 году [21] .
В 2000 г. Бертран получил дополнительные карбены фосфанильного типа, включая (фосфанил) (трифторметил) карбен, стабильный в растворе при -30 ° C [22] , и умеренно стабильный (амино) (арил) карбен с одним гетероатомом, примыкающим к карбеновый атом. [23] [24]
Факторы, влияющие на стабильность карбенов, стабилизированных гетероатомами
( Просмотр 3D-структуры с помощью внешнего средства просмотра )
Стабильность карбенов Arduengo первоначально приписывалась объемным заместителям N - адамантила , которые предотвращают димеризацию карбена из-за стерических затруднений . Замена N -адамантильных групп метильными группами также дает стабильные NHC. [25] Таким образом, имидазол-2-илидены термодинамически стабильны .
Также предполагалось, что двойная связь между атомами углерода 4 и 5 основной цепи имидазолиевого кольца, которая придает ароматический характер этой системе, важна для стабильности карбена. Это предположение было опровергнуто в 1995 году группой Ардуенго, которая получила производное дигидроимидазол-2-илидена , лишенное двойной связи. [26] Термодинамическая стабильность в этом соединении и роль стерической защиты в предотвращении димеризации были предметом некоторых споров. [27] [28]
О первом ациклическом стойком карбене было сообщено в 1996 г. [29] , что показало, что циклический каркас не является необходимым для их стабильности. В отличие от циклических производных ациклические карбены гибки в отношении вращения связей с карбеновым атомом. Измеряя барьер для вращения этих связей, можно было измерить степень их характера двойной связи и определить илидную природу этого карбена. Как и циклические диаминокарбены, беспрепятственные варианты имеют тенденцию к димеризации. [28] [30] [31]
Наиболее стойкие карбены стабилизируются двумя фланкирующими азотными центрами. Аминотиокарбен и аминооксикарбен - выбросы. [32] и ан. [33] В этих стабильных соединениях карбеновый атом находится между атомом азота и атомом серы или кислорода:
В отличие от NHC, эти карбены не являются термодинамически стабильными, но имеют тенденцию к димеризации.
В бис (диизопропиламино) циклопропенилидене , который стабилен при комнатной температуре, атом карбена связан с двумя атомами углерода в трехчленном кольце, которое сохраняет ароматичность и геометрию циклопропенилиденового кольца. Этот пример продемонстрировал, что присутствие гетероатомов рядом с карбеном также не обязательно для стабильности. [34]
Классы стабильных карбенов
Ниже приведены примеры выделенных на сегодняшний день стабильных карбенов:
Имидазол-2-илидены
Первые выделенные стабильные карбены основывались на имидазольном кольце с удаленным водородом в углероде 2 кольца (между двумя атомами азота) и заменой других атомов водорода различными группами. Эти имидазол-2-илидены по- прежнему являются наиболее стабильным и наиболее хорошо изученным семейством стойких карбенов.
Синтезирован значительный диапазон имидазол-2-илиденов, в том числе те, в которых 1,3-положения функционализированы алкил , арилом , [25] алкилокси, алкиламино, алкилфосфино [35] и даже хиральными заместителями: [35]
( Просмотрите 3D-структуру с помощью внешнего средства просмотра. )
В частности, замещение двух атомов хлора на два атома водорода в положениях кольца 4 и 5 дает первый стабильный на воздухе карбен. [21] Его дополнительная стабильность, вероятно, является результатом электроноакцепторного эффекта хлорных заместителей, которые уменьшают электронную плотность на атоме углерода, несущем неподеленную пару , за счет индукции через сигма-скелет.
Синтезированы также молекулы, содержащие две и даже три имидазол-2-илиденовые группы. [36] [37]
Карбены на основе имидазола термодинамически стабильны и обычно имеют диагностические значения химического сдвига 13 C ЯМР между 210 и 230 ppm для карбенового углерода. Обычно на рентгеновских структурах этих молекул наблюдаются валентные углы N – C – N 101–102 °.
Триазол-5-илидены
В зависимости от расположения трех атомов азота в триазол-5-илидене существуют два возможных изомера, а именно 1,2,3-триазол-5-илидены и 1,2,4-триазол-5-илидены.
Триазол -5-илидены на основе 1,2,4-триазольного кольца показаны ниже и были впервые получены Эндерсом и сотрудниками [38] путем вакуумного пиролиза путем потери метанола из 2-метокситриазолов. Сообщалось только об ограниченном диапазоне этих молекул, при этом трифенилзамещенная молекула коммерчески доступна.
Карбены на основе триазола термодинамически стабильны и имеют диагностические значения химического сдвига 13 C ЯМР от 210 до 220 ppm для карбенового углерода. Рентгеновская структура трифенилзамещенного карбена выше показывает валентный угол N – C – N около 101 °. Предшественник 5-метокситриазола для этого карбена был получен обработкой соли триазолия метоксидом натрия, который атакует как нуклеофил . [38] Это может указывать на то, что эти карбены менее ароматичны, чем имидазол-2-илидены, поскольку предшественники имидазолия не реагируют с нуклеофилами из-за потери ароматичности.
Другие диаминокарбены
Два вышеуказанных семейства можно рассматривать как частные случаи более широкого класса соединений, в которых атом карбена соединяет два атома азота. Ряд таких диаминокарбенов был получен в основном исследовательской группой Роджера Алдера . В некоторых из этих соединений звено N – C – N является членом пяти- или шестичленного неароматического кольца [26] [27] [39] , включая бициклический пример. В других примерах соседние атомы азота связаны только через атом карбена и могут быть или не быть частью отдельных колец. [29] [30] [31]
В отличие от ароматических имидазол-2-илиденов или триазол-5-илиденов, эти карбены, по-видимому, не являются термодинамически стабильными, как показано димеризацией некоторых беспрепятственных циклических и ациклических примеров. [27] [30] Исследования [28] предполагают, что эти карбены димеризуются посредством катализируемой кислотой димеризации (как в равновесии Ванзлика ).
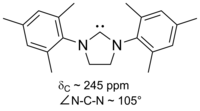
Диаминокарбены имеют диагностические значения химического сдвига 13 C ЯМР от 230 до 270 ppm для карбенового атома. Рентгеновская структура дигидроимидазол-2-илидена показывает валентный угол N – C – N около 106 °, в то время как угол ациклического карбена составляет 121 °, оба значения больше, чем наблюдаемые для имидазол-2-илиденов.
Гетероамино карбены
Существует несколько вариантов указанных выше стабильных карбенов, в которых один из атомов азота, примыкающих к карбеновому центру (α-атомы азота), заменен альтернативным гетероатомом, таким как кислород, сера или фосфор . [16] [17] [32] [33]
В частности, формальное замещение серой одного из атомов азота в имидазоле дает ароматическое гетероциклическое соединение тиазол . Карбен на основе тиазола (аналог карбена, постулированный Бреслоу) [40] был получен и охарактеризован методом рентгеновской кристаллографии. [32] Были получены другие неароматические аминокарбены с атомами O, S и P, соседними (т.е. альфа) с карбеновым центром, например, карбены на основе тио- и оксиминия были охарактеризованы с помощью рентгеновской кристаллографии. [33]
Поскольку кислород и сера двухвалентны , стерическая защита карбенового центра ограничена, особенно когда звено N – C – X является частью кольца. Эти ациклические карбены имеют диагностические значения химического сдвига 13 C ЯМР между 250 и 300 ppm для карбенового углерода, что является более слабым полем, чем любые другие типы стабильного карбена. Рентгеновские структуры показали валентные углы N – C – X около 104 ° и 109 ° соответственно.
Ожидается, что карбены, которые формально являются производными имидазол-2-илиденов путем замещения обоих α-азота серой, кислородом или другими халькогенами , будут нестабильными, поскольку они могут диссоциировать до алкина (R 1 C≡CR 2 ) и дихалькогенид углерода (X 1 = C = X 2 ). [ нужна ссылка ]
Неаминные карбены
Предполагается, что реакция сероуглерода (CS 2 ) с электронодефицитными производными ацетилена дает переходные карбены 1,3-дитиолия (т.е. где X 1 = X 2 = S), которые затем димеризуются с образованием производных тетратиафульвена . Таким образом, возможно, что обратный процесс может происходить в подобных карбенах. [41] [42]
Карбены Бертрана
В стойких карбенах Бертрана ненасыщенный углерод связан с фосфором и кремнием . [43] Однако эти соединения, кажется, проявляют некоторые щелочные свойства, и после публикации точная карбеновая природа этих красных масел обсуждалась. [17]
Другие нуклеофильные карбены
Один стабильный N -гетероциклический карбен [44] имеет структуру, аналогичную боразину , с заменой одного атома бора на метиленовую группу . Это приводит к плоскому шестиэлектронному соединению.
Циклопропенилидены
Другое семейство карбенов основано на циклопропенилиденовой сердцевине, трехуглеродном кольце с двойной связью между двумя атомами, соседними с карбеновым атомом. Примером этого семейства является бис (диизопропиламино) циклопропенилиден . [34]
Триплетные состояния карбенов
В 2001 году Хидео Томиока и его сотрудники смогли получить сравнительно стабильный триплетный карбен ( бис (9-антрил) карбен с периодом полураспада 19 минут), воспользовавшись делокализацией электронов . [45] [46]
В 2006 году та же группа сообщила о триплетном карбене с периодом полураспада 40 минут. [47] Этот карбен получают путем фотохимического разложения предшественника диазометана под действием света 300 нм в бензоле с вытеснением газообразного азота .
Воздействие кислорода (триплетный бирадикал) превращает этот карбен в соответствующий бензофенон . Соединение дифенилметана образуется, когда оно улавливается циклогекса-1,4-диеном . Как и другие карбены, этот вид содержит большие объемные заместители, а именно бром и трифторметильные группы на фенильных кольцах, которые экранируют карбен и предотвращают или замедляют процесс димеризации до 1,1,2,2-тетра (фенил ) алкен. На основе компьютерного моделирования заявлено , что расстояние от атома двухвалентного углерода до его соседей составляет 138 пикометров с валентным углом 158,8 °. Плоскости фенильных групп почти перпендикулярны друг другу (двугранный угол равен 85,7°).
Мезоионные карбены
Мезоионные карбены (MIC) аналогичны N -гетероциклическим карбенам (NHC), за исключением того, что канонические резонансные структуры с изображенным карбеном нельзя нарисовать без добавления дополнительных зарядов. Мезоионные карбены также называют аномальными N -гетероциклическими карбенами (aNHC) или отдаленными N -гетероциклическими карбенами (rNHC). Можно выделить множество свободных карбенов, которые стабильны при комнатной температуре. Другие свободные карбены нестабильны и подвержены путям межмолекулярного разложения.
Химические свойства
Основность и нуклеофильность
Имидазол-2-илидены представляют собой сильные основания, имеющие p K a ≈ 24 для конъюгированной кислоты в диметилсульфоксиде (ДМСО): [48]
Однако дальнейшие исследования показали, что диаминокарбены будут депротонировать растворитель ДМСО, в результате чего образующийся анион вступает в реакцию с образующейся солью амидиния.
Реакция имидазол-2-илиденов с 1-бромгексаном дала 90% 2-замещенного аддукта и только 10% соответствующего алкена , что указывает на то, что эти молекулы также являются достаточно нуклеофильными .
Значения p K a для конъюгированных кислот нескольких семейств NHC были исследованы в водном растворе. Значения pKa ионов триазолия лежат в диапазоне 16,5–17,8 [ 49] , примерно на 3 единицы pK a более кислые, чем соответствующие ионы имидазолия. [50]
Димеризация
Когда-то считалось, что стабильные карбены обратимо димеризуются через так называемое равновесие Ванзлика . Однако имидазол-2-илидены и триазол-5-илидены термодинамически стабильны, не димеризуются и в течение многих лет хранятся в растворе в отсутствие воды и воздуха. Предположительно это связано с ароматической природой этих карбенов, которая теряется при димеризации. Фактически имидазол-2-илидены настолько термодинамически стабильны, что только в очень ограниченных условиях эти карбены могут димеризоваться.
Чен и Татон [51] получили диимидазол-2-илиден с двойной связью путем депротонирования соответствующей соли диимидазолия. Только депротонирование дважды связанной соли диимидазолия более коротким метиленовым мостиком (–CH 2 -) привело к димеру дикарбена:
Если бы этот димер существовал как дикарбен, неподеленные пары электронов на карбеновом углероде были бы вынуждены находиться в непосредственной близости. Предположительно возникающие отталкивающие электростатические взаимодействия будут иметь значительный дестабилизирующий эффект. Чтобы избежать этого электронного взаимодействия, карбеновые звенья димеризуются.
С другой стороны, было показано, что гетероаминокарбены (такие как R 2 N – C – OR или R 2 N – C – SR) и неароматические карбены, такие как диаминокарбены (такие как R 2 N – C – NR 2 ), димериз [52] , хотя и довольно медленно. Предполагается, что это связано с высоким барьером для димеризации синглетного состояния :
Диаминокарбены на самом деле не димеризуются, а скорее образуют димер в результате реакции через соли формамидиния , протонированные соединения-предшественники. [28] Соответственно, эту реакцию можно катализировать кислотой. Эта реакция происходит потому, что, в отличие от карбенов на основе имидазолия, при протонировании карбена не происходит потери ароматичности.
В отличие от димеризации карбенов в триплетном состоянии , эти карбены в синглетном состоянии не приближаются лицом к лицу («наименьшее движение»), а скорее неподеленная пара карбена атакует пустую углеродную р-орбиталь («не наименьшее движение»). Димеризация карбена может катализироваться как кислотами, так и металлами.
Реактивность
Химия стабильных карбенов до конца не изучена. Однако Enders et al. [38] [53]
[54]
выполнили ряд органических реакций с участием триазол-5-илидена. Эти реакции описаны ниже и могут рассматриваться как модель для других карбенов.
| а | 3,6-дифенил-1,2,4,5-тетразин, толуол | 92% | е | 2 экв., PhNCO, толуол, кипячение с обратным холодильником | 92% | |
|---|---|---|---|---|---|---|
| б | RXH, RT | 95–97% | ж | CS 2 , толуол или PhNCS, THF, RT | 71–90% | |
| c | O 2 , S 8 или Se, толуол, кипячение с обратным холодильником | 54–68% | г | Малеимид, ТГФ, RT | 47–84% | |
| d | R 1 CH = CHR 2 , THF, RT | 25–68% | час | Диметилацетилендикарбоксилат, ТГФ, кипячение с обратным холодильником | 21% |
Эти карбены имеют тенденцию вести себя нуклеофильным образом ( e и f ), выполняя реакции вставки ( b ), реакции присоединения ( c ), [2 + 1] циклоприсоединения ( d , g и h ), [4 + 1] циклоприсоединения ( a ), а также простые депротонации . Реакции вставки ( b ), вероятно, протекают посредством депротонирования, что приводит к образованию нуклеофила ( -XR ), который может атаковать образовавшуюся соль, создавая впечатление вставки H – X.
Сообщаемый стабильный карбен изотиазола ( 2b ), полученный из перхлората изотиазолия ( 1 ) [55] , был поставлен под сомнение. [56] Исследователи смогли выделить только 2-имино-2 H -тиет ( 4 ). Промежуточное соединение 3 было предложено посредством реакции перегруппировки . Карбен 2b больше не считается стабильным. [57]
Комплексообразование карбенов
Было показано, что имидазол-2-илидены, триазол-5-илидены (и в меньшей степени диаминокарбены) координируются с множеством элементов, от щелочных металлов , элементов основных групп , переходных металлов и даже лантаноидов и актинидов . Периодическая таблица элементов дает некоторое представление о комплексах, которые были получены, и во многих случаях они были идентифицированы с помощью рентгеновской кристаллографии монокристаллов . [39] [58] [59] Считается, что стабильные карбены ведут себя аналогично органофосфинам в своих координационных свойствах с металлами. Эти лигандысчитаются хорошими σ-донорами через неподеленную карбеновую пару , но плохими π-акцепторами из-за обратного донорства внутреннего лиганда от атомов азота , прилегающих к карбеновому центру, и поэтому способны координироваться даже с относительно электронодефицитными металлами. Эндерс [60] и Герман [61] [62] показали, что эти карбены являются подходящими заменами фосфиновых лигандов в нескольких каталитических циклах. . Хотя они обнаружили, что эти лиганды не активируют металлический катализатор в такой степени, как фосфиновые лиганды, они часто приводят к более надежным катализаторам. Несколько каталитических систем были изучены Германом и Эндерсом с использованием катализаторов, содержащих имидазольные и триазолкарбеновые лиганды, с умеренным успехом. [58] [60] [61] [62] Граббс [63] сообщил о замене фосфинового лиганда (PCy 3 ) на имидазол-2-илиден в катализаторе метатезиса олефинов RuCl 2 (PCy 3 ) 2CHPh, и отметил повышенный метатезис с замыканием кольца, а также продемонстрировал «замечательную стабильность в воздухе и воде». Молекулы, содержащие два и три карбеновых фрагмента, были получены в качестве потенциальных бидентатных и тридентатных карбеновых лигандов. [36] [37]
| Группа → | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ↓ Период | ||||||||||||||||||||
| 1 | 1 ЧАС | 2 Он | ||||||||||||||||||
| 2 | 3 Ли | 4 Быть | 5 B | 6 C | 7 N | 8 О | 9 F | 10 Ne | ||||||||||||
| 3 | 11 Na | 12 мг | 13 Al | 14 Si | 15 п | 16 S | 17 Cl | 18 Ar | ||||||||||||
| 4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30 Zn | 31 Ga | 32 Ge | 33 В виде | 34 Se | 35 год Br | 36 Kr | ||
| 5 | 37 Руб. | 38 Sr | 39 Y | 40 Zr | 41 год Nb | 42 Мо | 43 год Tc | 44 RU | 45 Rh | 46 Pd | 47 Ag | 48 Компакт диск | 49 В | 50 Sn | 51 Sb | 52 Te | 53 я | 54 Xe | ||
| 6 | 55 CS | 56 Ба | 71 Лу | 72 Hf | 73 Та | 74 Вт | 75 Re | 76 Операционные системы | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 год Tl | 82 Pb | 83 би | 84 По | 85 В | 86 Rn | ||
| 7 | 87 Пт | 88 Ра | 103 Лр | 104 Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn | 113 Нч | 114 Fl | 115 Mc | 116 Ур. | 117 Ц | 118 Og | ||
| 57 Ла | 58 Ce | 59 Пр | 60 Nd | 61 Вечера | 62 См | 63 Евросоюз | 64 Б-г | 65 Tb | 66 Dy | 67 Хо | 68 Э | 69 Тм | 70 Yb | |||||||
| 89 Ac | 90 Чт | 91 Па | 92 U | 93 Np | 94 Пу | 95 Являюсь | 96 См | 97 Bk | 98 Cf | 99 Es | 100 FM | 101 Мкр | 102 Нет | |||||||
- Легенда
- Карбеновый комплекс с известным элементом
- Неизвестно ни одного карбенового комплекса с элементом
Карбены в металлоорганической химии и катализе
Карбены можно стабилизировать как металлорганические соединения . Эти карбеновые комплексы переходных металлов делятся на две категории:
- Карбены Фишера , в которых карбены связаны с металлом и электроноакцепторной группой (обычно карбонилом),
- Карбены шрока; в котором карбены связаны с металлом и электронодонорной группой . Реакции, в которых участвуют такие карбены, сильно отличаются от реакций, в которых участвуют органические карбены.
Химия карбенов в триплетном состоянии
Стойкие карбены в триплетном состоянии, вероятно, будут иметь очень такую же реакционную способность, как и другие непостоянные карбены в триплетном состоянии .
Физические свойства
Те карбены, которые были выделены на сегодняшний день, обычно представляют собой бесцветные твердые вещества с низкими температурами плавления. Эти карбены имеют тенденцию к сублимации при низких температурах в высоком вакууме.
Одним из наиболее полезных физических свойств является диагностический химический сдвиг карбенового атома углерода в спектре 13 C -ЯМР . Обычно этот пик находится в диапазоне от 200 до 300 м.д., где несколько других пиков появляются в спектре 13 C -ЯМР . Пример показан слева для циклического диаминокарбена, который имеет пик карбеновой кислоты при 238 м.д.
При координации с металлическими центрами резонанс карбена 13 C обычно смещается в сильное поле в зависимости от кислотности Льюиса комплексного фрагмента. Основываясь на этом наблюдении, Huynh et al. разработали новую методологию определения силы донора лиганда с помощью 13 C ЯМР-анализа комплексов транс - палладий (II) -карбен. Использование 13 C-меченного N-гетероциклического карбенового лиганда также позволяет изучать смешанные карбен-фосфиновые комплексы, которые подвергаются транс - цис -изомеризации из-за транс-эффекта . [64]
Приложения
NHC широко используются в качестве вспомогательного лиганда в металлоорганической химии. Одним из практических приложений является катализатор Граббса на основе рутения и комплексы NHC-палладий для реакций кросс-сочетания. [65] [66] [67] Комплексы NHC-металл, в частности комплексы Ag (I) -NHC, были широко протестированы для их биологических применений. [68]
Методы подготовки
NHC часто бывают сильно основными ( значение pKa сопряженной кислоты имидазол-2-илидена было измерено примерно при 24) [48] и реагируют с кислородом . Очевидно, что эти реакции проводят безвоздушными методами , избегая соединений даже умеренной кислотности . Хотя соли имидазолия устойчивы к нуклеофильному присоединению, другие неароматические соли - нет (т.е. соли формамидиния ). [69]
В этих случаях избегают сильных беспрепятственных нуклеофилов, независимо от того, образуются ли они in situ или присутствуют в качестве примеси в других реагентах (таких как LiOH в BuLi).
Для получения стабильных карбенов было разработано несколько подходов, которые описаны ниже.
Депротонирование
Депротонирование солей-предшественников карбена сильными основаниями оказалось надежным путем практически ко всем стабильным карбенам:
Имидазол-2-илидены и дигидроимидазол-2-илидены, такие как IM , были получены депротонированием соответствующих солей имидазолия и дигидроимидазолия . Ациклические карбены [29] [30] и карбены на основе тетрагидропиримидинила [39] были получены депротонированием с использованием сильных гомогенных оснований.
С переменным успехом использовали несколько оснований и условий реакции. Степень успеха в основном зависела от природы депротонируемого предшественника . Основным недостатком этого способа получения является проблема отделения свободного карбена от ионов металлов, используемых при их получении.
Металлогидридные основания
Можно подумать, что гидрид натрия или калия [26] [32] будет идеальным основанием для депротонирования этих солей-предшественников. Гидрид должен необратимо реагировать с потерей водорода с образованием желаемого карбена, при этом неорганические побочные продукты и избыток гидрида удаляются фильтрацией. На практике эта реакция часто протекает слишком медленно и требует добавления ДМСО или трет -БуОН . [18] [25] Эти реагенты образуют растворимые катализаторы , которые увеличивают скорость реакции этой гетерогенной системы за счет образования трет-бутоксида или димсил-аниона.. Однако эти катализаторы оказались неэффективными для получения неимидазолиевых аддуктов, поскольку они имеют тенденцию действовать как нуклеофилы по отношению к солям-предшественникам и при этом разрушаются. Присутствие гидроксид - ионов в качестве примеси в гидриде металла также может разрушать неароматические соли.
Сообщалось о депротонировании с помощью гидрида натрия или калия в смеси жидкий аммиак / ТГФ при -40 ° C [35] для карбенов на основе имидазола. Ардуенго и соавторам [32] удалось получить дигидроимидазол-2-илиден с использованием NaH. Однако этот метод не применялся для получения диаминокарбенов. В некоторых случаях трет-бутоксид калия можно использовать без добавления гидрида металла. [25]
Алкиллитий
Использование алкиллитий в качестве сильных оснований [18] не было широко изучено и было ненадежным для депротонирования солей-предшественников. С неароматическими солями n-BuLi и PhLi могут действовать как нуклеофилы, в то время как t-BuLi может иногда действовать как источник гидрида, восстанавливая соль с образованием изобутена :
Амидные основания
Амиды лития, такие как диизопропиламид (LDA) и ( тетраметилпиперидид (LiTMP) ) [29] [30] , обычно хорошо подходят для депротонирования всех типов солей, при условии, что не слишком много LiOH присутствует в н - бутиллитии , используемом для получения амид лития. Титрование амида лития можно использовать для определения количества гидроксида в растворе. Депротонирование солей-предшественников гексаметилдисилазидами металлов [39] очень чисто работает для депротонирования всех типов солей, за исключением беспрепятственных солей формамидиния, где это основание может действовать как нуклеофил, давая аддукт триаминометана.
Безметалловый препарат карбена
Стремление к получению стабильных карбенов, свободных от катионов металлов, позволило провести дальнейшее изучение карбеновых разновидностей отдельно от этих металлов. Отделение карбена от комплекса карбен-металл может быть проблематичным из-за стабильности комплекса. Соответственно, предпочтительно, чтобы карбен в первую очередь не содержал этих металлов. В самом деле, некоторые ионы металлов, а не стабилизация карбена, были вовлечены в каталитическую димеризацию беспрепятственных примеров.
Справа показана рентгеновская структура, показывающая комплекс между диаминокарбеном и ГМДС калия . Этот комплекс образовался, когда избыток KHMDS был использован в качестве сильного основания для депротонирования соли формамидиния . Удаление ионов лития, образующихся в результате депротонирования с помощью таких реагентов, как диизопропиламид лития (LDA), может быть особенно проблематичным. Побочные продукты соли калия и натрия имеют тенденцию выпадать в осадок из раствора и могут быть удалены. Ионы лития можно удалить химическим путем путем связывания с такими видами, как криптанды или краун-эфиры .
Карбены, не содержащие металлов, получали несколькими способами, описанными ниже:
Дехалькогенизация
Другой подход к получению карбенов основан на обессеривании тиомочевин калием в ТГФ . [27] [70] Фактором, способствующим успеху этой реакции, является то, что побочный продукт, сульфид калия , нерастворим в растворителе. Повышенные температуры предполагают, что этот метод не подходит для получения нестабильных димеризующихся карбенов. Сообщается также об одном примере дезоксигенации мочевины карбеном, производным от флуорена , с образованием тетраметилдиаминокарбена и флуоренона: [71]
Десульфуризация тиомочевин расплавленным калием с получением имидазол-2- илиденов или диаминокарбенов не получила широкого распространения. Метод был использован для получения карбенов дигидроимидазола. [27]
Вакуумный пиролиз
Вакуумный пиролиз с удалением нейтральных летучих побочных продуктов, например метанола или хлороформа, был использован для получения карбенов на основе дигидроимидазола и триазола. Исторически удаление хлороформа путем вакуумного пиролиза аддуктов A использовалось Ванзликом [8] в его ранних попытках получить дигидроимидазол-2-илидены, но этот метод не получил широкого распространения. Лаборатория Эндерса [38] использовала вакуумный пиролиз аддукта B для получения триазол-5-илидена.
Бис (триметилсилил) ртуть
Бис (триметилсилил) ртуть (CH 3 ) 3 Si-Hg-Si (CH 3 ) 3 реагирует с солями хлориминия и хлорамидиния с образованием безметаллового карбена и элементарной ртути . [72] Например:
- (CH 3 ) 3 Si − Hg − Si (CH 3 ) 3 + R 2 N = C (Cl) - NR+
2Cl - → R 2 N − C − NR 2 + Hg (l) + (CH 3 ) 3 SiCl
Фотохимическое разложение
Стойкие карбены в триплетном состоянии были получены фотохимическим разложением диазометанового продукта путем выделения газообразного азота при длине волны 300 нм в бензоле.
Очищение
Стабильные карбены очень реакционноспособны, поэтому желательно минимальное количество обработки с использованием безвоздушных методов . Однако при использовании строго сухих, относительно некислотных и безвоздушных материалов стабильные карбены сами по себе достаточно устойчивы к обращению . Например, стабильный карбен, полученный из гидрида калия, может быть отфильтрован через сухую подушку из целита для удаления избытка KH (и образующихся солей) из реакции. В относительно небольших масштабах суспензии, содержащей стабильный карбен в растворе, можно дать осесть, а надосадочный раствор протолкнуть через высушенный мембранный шприцевой фильтр . Стабильные карбены легко растворяются в неполярных растворителях, таких как гексан, поэтому обычно происходит перекристаллизация.стабильных карбенов может быть затруднено из-за отсутствия подходящих некислотных полярных растворителей. Безвоздушная сублимация , как показано справа, может быть эффективным методом очистки, хотя предпочтительны температуры ниже 60 ° C в высоком вакууме, поскольку эти карбены относительно летучие и также могут начать разлагаться при этих более высоких температурах. Действительно, сублимация в некоторых случаях может дать монокристаллы, пригодные для рентгеноструктурного анализа. Однако сильное комплексообразование с ионами металлов, таких как литий , в большинстве случаев предотвращает сублимацию.
использованная литература
- ^ Хопкинсон, Миннесота; Richter, C .; Schedler, M .; Глориус, Ф. (2014). «Обзор N - гетероциклических карбенов». Природа . 510 (7506): 485–496. Bibcode : 2014Natur.510..485H . DOI : 10,1038 / природа13384 . PMID 24965649 . S2CID 672379 .
- ↑ Рональд Бреслоу (1957). «Механизм действия тиамина: участие цвиттериона тиазолия». Chem. Инд 26 : 893.
- ↑ Рональд Бреслоу (1958). «О механизме действия тиамина. IV.1 Данные исследований модельных систем». Варенье. Chem. Soc. 80 (14): 3719–3726. DOI : 10.1021 / ja01547a064 .
- ^ Р. Бреслоу (1957). «Быстрый обмен дейтерия в солях тиазолия». Варенье. Chem. Soc. 79 (7): 1762–1763. DOI : 10.1021 / ja01564a064 .
- ^ Беркессель А .; Elfert S .; Yatham VR; Neudörfl J.-M .; Schlörer NE; Телес JH (2012). «Умполунг N -гетероциклическими карбенами: образование и реакционная способность неуловимых 2,2-диаминоенолов (промежуточные соединения Бреслоу)». Энгью. Chem. Междунар. Эд. 51 (49): 12370–12374. DOI : 10.1002 / anie.201205878 . PMID 23081675 .
- ^ Химики приближаются к неуловимому промежуточному звену в Бреслоу Кармен Драл
- ^ Ханс-Вернер Ванзлик; Э. Шикора (1960). "Ein neuer Zugang zur Carben-Chemie" [Новый путь в химию карбенов]. Энгью. Chem. 72 (14): 494. Bibcode : 1960AngCh..72..494W . DOI : 10.1002 / ange.19600721409 .
- ^ а б Х. В. Ванзлик; Э. Шикора (1960). «Эйн нуклеофилы карбен» [нуклеофильный карбен]. Chem. Бер. 94 (9): 2389–2393. DOI : 10.1002 / cber.19610940905 .
- ^ а б Х. В. Ванзлик (1962). «Аспекты химии нуклеофильных карбенов». Энгью. Chem. Междунар. Эд. 1 (2): 75–80. DOI : 10.1002 / anie.196200751 .
- ^ DM Lemal; Р.А. Ловальд; К.И. Кавано (1964). «Тетрааминоэтилены. Вопрос о диссоциации». Варенье. Chem. Soc. 86 (12): 2518–2519. DOI : 10.1021 / ja01066a044 .
- ^ HE Winberg; Дж. Э. Карнахан; Д. Д. Коффман; М. Браун (1965). «Тетрааминоэтилены». Варенье. Chem. Soc. 87 (9): 2055–2056. DOI : 10.1021 / ja01087a040 .
- ^ Денк МК; Hatano K .; Ма М. (1999). "Нуклеофильные карбены и повторное исследование равновесия Ванзлика". Tetrahedron Lett. 40 (11): 2057–2060. DOI : 10.1016 / S0040-4039 (99) 00164-1 .
- ^ Бём Фолькер PW; Херрманн Вольфганг А. (2000). «Равновесие Ванзлика». Энгью. Chem. Междунар. Эд. 39 (22): 4036–4038. DOI : 10.1002 / 1521-3773 ( 20001117 ) 39:22 <4036 :: AID-ANIE4036> 3.0.CO; 2-L .
- ^ а б Х. В. Ванзлик; HJ Schonherr (1970). "Chemie nucleophiler Carbene, XVIII, 1) 1.3.4.5-Tetraphenyl-imidazoliumperchlorat" [Семия нуклеофильных карбенов, XVIII. 1) перхлорат 1,3,4,5-тетрафенилимидазолия]. Liebigs Ann. Chem. 731 : 176–179. DOI : 10.1002 / jlac.19707310121 .
- ^ Р. Глейтер; Р. Хоффманн (1968). «Стабилизация синглетного метилена». Варенье. Chem. Soc. 90 (20): 5457–5460. DOI : 10.1021 / ja01022a023 .
- ^ а б А. Игау; Х. Груцмахер; А. Басейредо; Дж. Бертран (1988). «Аналогичный α, α′-бис-карбеноид, трехсвязанный вид: синтез стабильного λ 3 -фосфинкарбена-λ 3 -фосфацетилена». Варенье. Chem. Soc. 110 (19): 6463–6466. DOI : 10.1021 / ja00227a028 .
- ^ a b c Г. Бертран; Р. Рид (1994). «λ 3 -фосфинокарбены λ 5 -фосфацетилены». Coord. Chem. Откр. 137 : 323–355. DOI : 10.1016 / 0010-8545 (94) 03005-B .
- ^ а б в Ардуенго, Эй Джей; Харлоу, Р.Л .; Клайн, М. (1991). «Стабильный кристаллический карбен». Варенье. Chem. Soc. 113 (1): 361–363. DOI : 10.1021 / ja00001a054 .
- ^ Тапу, Даниэла; Диксон, Дэвид А .; Роу, Кристофер (12 августа 2009 г.). «Спектроскопия ЯМР 13С карбенов типа« Ардуенго и их производных ». Chem. Ред. 109 (8): 3385–3407. DOI : 10.1021 / cr800521g . PMID 19281270 .
- ^ Ардуенго, Энтони Дж .; Харлоу, Ричард Л .; Клайн, Майкл (январь 1991). «Стабильный кристаллический карбен». Варенье. Chem. Soc. 113 (1): 361–363. DOI : 10.1021 / ja00001a054 .
- ^ a b А. Дж. Ардуенго; Ф. Дэвидсон; HVR Dias; JR Goerlich; Д. Хаснис; У. Дж. Маршалл; Т.К. Пракаша (1997). "Димеры" стабильного на воздухе карбена и смешанного карбена " . Варенье. Chem. Soc. 119 (52): 12742–12749. DOI : 10.1021 / ja973241o .
- ^ Кристоф Бурон; Хайнц Горницка; Вадим Романенко; Гай Бертран (2000). «Стабильные версии переходных двухтактных карбенов: увеличение срока службы с наносекунд до недель». Наука . 288 (5467): 834–836. Bibcode : 2000Sci ... 288..834B . DOI : 10.1126 / science.288.5467.834 . PMID 10796999 .
- ^ Соле, Стефан; Горницка, Хайнц; Schoeller, Wolfgang W .; Бурису, Дидье; Бертран, Гай (2001). «(Амино) (арил) карбены: стабильные синглетные карбены с заместителем для наблюдения». Наука . 292 (5523): 1901–1903. Bibcode : 2001Sci ... 292.1901S . DOI : 10.1126 / science.292.5523.1901 . PMID 11397943 .
- ^ Лай Чунь-Лян; Го Вэнь-Синь; Ли Мин-Цунг; Ху Чин-Хан (2005). «Лигандные свойства N -гетероциклических карбенов и карбенов Бертрана: исследование с функциональной плотностью». J. Organomet. Chem. 690 (24–25): 5867–5875. DOI : 10.1016 / j.jorganchem.2005.07.058 .
- ^ а б в г А. Дж. Ардуенго; HVR Dias; Р.Л. Харлоу; М. Клайн (1992). «Электронная стабилизация нуклеофильных карбенов». Варенье. Chem. Soc. 114 (14): 5530–5534. DOI : 10.1021 / ja00040a007 .
- ^ a b c Дж. Ардуенго; JR Goerlich; У. Дж. Маршалл (1995). «Стабильный диаминокарбен». Варенье. Chem. Soc. 117 (44): 11027–11028. DOI : 10.1021 / ja00149a034 .
- ^ a b c d e М. К. Денк; А. Тадани; К. Хатано; AJ Lough (1997). «Стерическая стабилизация нуклеофильных карбенов». Энгью. Chem. Междунар. Эд. 36 (23): 2607–2609. DOI : 10.1002 / anie.199726071 .
- ^ a b c d Ольха, RW; Чакер, L; Паолини, ФП (2004). «Бис (диэтиламино) карбен и механизм димеризации простых диаминокарбенов». Chemical Communications (Кембридж, Англия) (19): 2172–2173. DOI : 10.1039 / b409112d . PMID 15467857 .
- ^ a b c d Р. В. Алдер; PR Аллен; М. Мюррей; А.Г. Орпен (1996). «Бис (диизопропиламино) карбен». Энгью. Chem. Междунар. Эд. 35 (10): 1121–1123. DOI : 10.1002 / anie.199611211 .
- ^ a b c d e Р. В. Алдер; ME Блейк (1997). «Бис ( N -пиперидил) карбен и его медленная димеризация до тетракис ( N - пиперидил) этена». Chem. Commun. (16): 1513–1514. DOI : 10.1039 / a703610h .
- ^ a b Р. В. Алдер; ME Блейк; Дж. М. Олива (1999). «Диаминокарбены; Расчет барьеров для вращения вокруг C- карбен - N-связей, барьеров для димеризации, сродства протонов и сдвигов 13 C ЯМР». J. Phys. Chem. А . 103 (50): 11200–11211. Bibcode : 1999JPCA..10311200A . DOI : 10,1021 / jp9934228 .
- ^ a b c d e А. Дж. Ардуенго, Дж. Р. Гёрлих и В. Дж. Маршалл (1997). «Стабильный тиазол-2-илиден и его димер». Liebigs Ann. Chem. 1997 (2): 365–374. DOI : 10.1002 / jlac.199719970213 .
- ^ a b c Р. В. Алдер; CP Butts; А.Г. Орпен (1998). «Стабильные аминоокси- и аминотиокарбены». Варенье. Chem. Soc. 120 (44): 11526–11527. DOI : 10.1021 / ja9819312 .
- ^ а б Лавалло, Винсент; Канак, Ив; Доннадье, Бруно; Schoeller, Wolfgang W .; Бертран, Гай (2006). «Циклопропенилидены: от межзвездного пространства к изолированному производному в лаборатории» . Наука . 312 (5774): 722–724. Bibcode : 2006Sci ... 312..722L . DOI : 10.1126 / science.1126675 . PMC 2427275 . PMID 16614171 .
- ^ a b c В. А. Херрманн; К. Кочер; LJ Goossen; GRJ Artus (1996). «Гетероциклические карбены: высокоэффективный синтез новых функционализированных N -гетероциклических карбенов в жидком аммиаке». Chem. Евро. J. 2 (12): 1627–1636. DOI : 10.1002 / chem.19960021222 .
- ^ a b W. A. Herrmann; М. Элисон; Дж. Фишер; К. Кочер; GRJ Artus (1996). « N -Гетероциклические карбены: образование в мягких условиях и образование комплексов переходных металлов 8–10 групп, имеющих отношение к катализу». Chem. Евро. J. 2 (7): 772–780. DOI : 10.1002 / chem.19960020708 .
- ^ а б Х. В.Р. Диас; У. К. Джин (1994). «Стабильный тридентатный карбеновый лиганд». Tetrahedron Lett. 35 (9): 1365–1366. DOI : 10.1016 / S0040-4039 (00) 76219-8 .
- ^ а б в г Д. Эндерс; К. Брейер; Г. Раабе; Дж. Рансинк; JH Teles; JP Melder; К. Эбель; С. Броде (1995). «Получение, структура и реакционная способность 1,3,4-трифенил-4,5-дигидро- 1H -1,2,4-триазол-5-илидена, нового стабильного карбена». Энгью. Chem. Междунар. Эд. 34 (9): 1021–1023. DOI : 10.1002 / anie.199510211 .
- ^ a b c d Р. В. Алдер; ME Блейк; К. Бортолотти; С. Буффали; CP Butts; Э. Лайнхэм; JM Oliva; А.Г. Орпен; MJ Quayle (1999). «Комплексообразование стабильных карбенов со щелочными металлами». Chem. Commun. (3): 241–242. DOI : 10.1039 / a808951e .
- ^ Р. Бреслоу (1957). «Быстрый обмен дейтерия в солях тиазолия». Варенье. Chem. Soc. 79 (7): 1762–1763. DOI : 10.1021 / ja01564a064 .
- ↑ HD Haztzler (1970). «Нуклеофильные 1,3-дитиолиевые карбены». Варенье. Chem. Soc. 92 (5): 1412–1413. DOI : 10.1021 / ja00708a058 .
- ^ HD Hartzler (1972). «1,3-Дитиолиевые карбены из ацетиленов и сероуглерода». Варенье. Chem. Soc. 95 (13): 4379–4387. DOI : 10.1021 / ja00794a039 .
- ^ Г. Бертран; А. Игау; А. Басейредо; Г. Тринкье (1989). «[Бис (диизопропиламино) фосфино] триметилсилилкарбен: стабильный нуклеофильный карбен». Энгью. Chem. Междунар. Эд. 28 (5): 621–622. DOI : 10.1002 / anie.198906211 .
- ^ a b Präsang, C; Доннадье, Б; Бертран, Г. (2005). «Стабильные плоские шести-π-электронные шестичленные N -гетероциклические карбены с настраиваемыми электронными свойствами» . Варенье. Chem. Soc. 127 (29): 10182–10183. DOI : 10.1021 / ja052987g . PMC 2440681 . PMID 16028925 .
- ^ Томиока, H; Ивамото, Э; Itakura, H; Хираи, К. (2001). «Создание и характеристика довольно стабильного триплетного карбена». Природа . 412 (6847): 626–628. Bibcode : 2001Natur.412..626T . DOI : 10,1038 / 35088038 . PMID 11493917 . S2CID 4373216 .
- ↑ Майкл Фримантл (13 августа 2001). «Триплет карбен имеет долгую жизнь» . Новости химии и машиностроения . 79 (33): 11. DOI : 10.1021 / cen- v079n033.p011a .
- ^ Ито, Т; Наката, Y; Хираи, К. Томиока, Х (2006). «Триплет дифенилкарбенов, защищенный трифторметильной и бромной группами. Триплетный карбен, выживший в течение дня в растворе при комнатной температуре». Варенье. Chem. Soc. 128 (3): 957–967. DOI : 10.1021 / ja056575j . PMID 16417387 .
- ^ a b Р. В. Алдер; PR Аллен; SJ Уильямс (1995). «Стабильные карбены как сильные основания». Chem. Commun. (12): 1267. DOI : 10.1039 / c39950001267 .
- Перейти ↑ Massey Richard S (2012). «Реакции переноса протона триазол-3-илиденов: кинетические кислотности и значения pKaValue для двадцати триазолиевых солей в водном растворе» (PDF) . Варенье. Chem. Soc. 134 (50): 20421–20432. DOI : 10.1021 / ja308420c . PMID 23173841 .
- ^ Хиггинс, Элеонора М .; Шервуд, Дженнифер А .; Линдси, Анита Дж .; Армстронг, Джеймс; Мэсси, Ричард С .; Олдер, Роджер В .; О'Донохью, Аннмари К. (2011). «p K a s сопряженных кислот N -гетероциклических карбенов в воде» . Chem. Commun. 47 (5): 1559–1561. DOI : 10.1039 / C0CC03367G . PMID 21116519 . S2CID 205757477 .
- ^ Т.А. Татон; П. Чен (1996). «Стабильный тетраазафульвален». Энгью. Chem. Междунар. Эд. 35 (9): 1011–1013. DOI : 10.1002 / anie.199610111 .
- ^ Олдер, Роджер В .; Блейк, Майкл Э .; Чакер, Лейла; Харви, Джереми Н .; Паолини, Франсуа; Шютц, Ян (2004). «Когда и как диаминокарбены димеризуются?». Энгью. Chem. Междунар. Эд. 43 (44): 5896–5911. DOI : 10.1002 / anie.200400654 . PMID 15457494 .
- ^ Эндерс, D .; Breuer, K .; Runsink, J .; Телес, JH (1996). «Химические реакции стабильного карбена 1,3,4-трифенил-4,5-дигидро- 1H -1,2,4-триазол-5-илидена». Liebigs Ann. Chem. 1996 (12): 2019–2028. DOI : 10.1002 / jlac.199619961212 .
- ^ а б Эндерс, Д .; Breuer, K .; Телес, JH; Эбель, К. (1997). «1,3,4-Трифенил-4,5-дигидро- 1H -1,2,4-триазол-5-илиден - применение стабильного карбена в синтезе и катализе». J. Prakt. Chem. 339 : 397–399. DOI : 10.1002 / prac.19973390170 .
- ^ Вольф, J; Böhlmann, W; Findeisen, M; Гельбрих, Т; Hofmann, HJ; Шульце, Б. (2007). «Синтез стабильных изотиазольных карбенов». Энгью. Chem. Междунар. Эд. 46 (17): 3118–3121. DOI : 10.1002 / anie.200604305 . PMID 17372997 .
- ^ а б ДеХоуп, А; Lavallo, V; Доннадье, Б; Schoeller, WW; Бертран, Г. (2007). «Недавно сообщенные кристаллические карбены изотиазола: миф или реальность». Энгью. Chem. Междунар. Эд. 46 (36): 6922–6925. DOI : 10.1002 / anie.200702272 . PMID 17661300 .
- ^ Вольф Жанин; Бельманн Винфрид; Findeisen Matthias; Гельбрих Томас; Хофманн Ханс-Йорг; Шульце Борбель (2007). "Ответ на" Недавно опубликованные кристаллические карбены изотиазола: миф или реальность " ". Энгью. Chem. Междунар. Эд. 46 (36): 6926. DOI : 10.1002 / anie.200702746 .
- ^ a b Вольфганг А. Херрманн ; Кристиан Кехер (1997). « N -гетероциклические карбены». Энгью. Chem. Междунар. Эд. 36 (20): 2162–2187. DOI : 10.1002 / anie.199721621 .
- ^ Гернот Бош; Кристоф Хильф; Клаус Хармс; Майкл Марш; Джон К. В. Лоренц (1995). «Кристаллическая структура димерного (4 - трет -бутилтиазолато) (глима) лития: карбеновый характер эквивалента формил-аниона». Энгью. Chem. Междунар. Эд. 34 (4): 487–489. DOI : 10.1002 / anie.199504871 .
- ^ а б Д. Эндерс; Х. Гилен; Г. Раабе; Дж. Рансинк; Дж. Х. Телес (1996). «Синтез и стереохимия первых хиральных (имидазолинилиден) - и (триазолинилиден) комплексов палладия (II)». Chem. Бер. 129 (12): 1483–1488. DOI : 10.1002 / cber.19961291213 .
- ^ a b Вольфганг А. Херрманн ; Мартина Элисон; Якоб Фишер; Кристиан Кехер; Георг Р. Дж. Артус (1995). «Металлические комплексы N - гетероциклических карбенов - новый структурный принцип для катализаторов в гомогенном катализе». Энгью. Chem. Междунар. Эд. 34 (21): 2371–2374. DOI : 10.1002 / anie.199523711 .
- ^ a b Вольфганг А. Херрманн ; Лукас Дж. Гуссен; Кристиан Кехер; Георг Р. Дж. Артус (1996). «Хиральные гетероциклические карбены в асимметричном гомогенном катализе». Энгью. Chem. Междунар. Эд. 35 (23–24): 2805–2807. DOI : 10.1002 / anie.199628051 .
- ^ М. Шолль; ТМ Трнка; JP Morgan; Р. Х. Граббс (1999). «Повышенная активность метатезиса при замыкании цикла катализаторов метатезиса олефинов на основе рутения, координированных с имидазолин-2-илиденовыми лигандами». Tetrahedron Lett. 40 (12): 2247–2250. DOI : 10.1016 / S0040-4039 (99) 00217-8 .
- ^ Хан Винь Хюинь; и другие. (2009). «13С ЯМР-спектроскопическое определение силы донора лиганда с использованием N-гетероциклических карбеновых комплексов палладия (II)» . Металлоорганические соединения . 28 (18): 5395–5404. DOI : 10,1021 / om900667d .
- ↑ SP Nolan [редактор] (2006). N-Гетероциклические карбены в синтезе , Wiley-VCH ISBN 3-527-31400-8
- ^ F. Glorius [редактор] (2007) N-гетероциклические карбены в катализе переходных металлов , Springer ISBN 3-540-36929-5
- ↑ Диес-Гонсалес, Сильвия; Марион, Николас; Нолан, Стивен П. (12 августа 2009 г.). «N-Гетероциклические карбены в катализе поздних переходных металлов» . Chem. Ред. 109 (8): 3612–3676. DOI : 10.1021 / cr900074m . ISSN 0009-2665 . PMID 19588961 . S2CID 206902952 .
- ↑ Гарнизон Джред С . ; Янгс Уайли Дж. (2005). «Комплексы Ag (I) N-гетероциклического карбена: синтез, структура и применение» . Chem. Rev. _ 105 (11): 3978–4008. DOI : 10.1021 / cr050004s . PMID 16277368 . S2CID 43090499 .
- ^ Роджер В. Олдер; Майкл Э. Блейк; Симоне Буфали; Крейг П. Баттс; А. Гай Орпен; Ян Шютц; Стюарт Дж. Уильямс (2001). «Получение солей тетраалкилформамидиния и родственных видов в качестве предшественников стабильных карбенов». J. Chem. Soc., Perkin Trans. 1 (14): 1586–1593. DOI : 10.1039 / b104110j .
- ^ Н. Кун; Т. Кратц (1993). «Синтез имидазол-2-илиденов восстановлением имидазол-2 (3 H ) -тионов». Синтез . 1993 (6): 561–562. DOI : 10,1055 / с-1993-25902 .
- ^ Д. Ковач; MS Lee; Д. Олсон; Дж. Э. Джексон (1996). «Перенос атома кислорода из карбена в карбен». Варенье. Chem. Soc. 118 (34): 8144–8145. DOI : 10.1021 / ja961324j .
- ^ Майкл Отто; Сальвадор Конехеро; Ив Канак; Вадим Дмитриевич Романенко; Валентин Рудзевич; Гай Бертран (2004). «Моно- и диаминокарбены из солей хлориминия и -амидиния: синтез безметаллового бис (диметиламино) карбена». Варенье. Chem. Soc. 126 (4): 1016–1017. DOI : 10.1021 / ja0393325 . PMID 14746458 .
дальнейшее чтение
Отзывы о стойких карбенах:
- Хопкинсон, Миннесота; Richter, C .; Schedler, M .; Глориус, Ф. (2014). «Обзор N-гетероциклических карбенов». Природа . 510 (7506): 485–496. Bibcode : 2014Natur.510..485H . DOI : 10,1038 / природа13384 . PMID 24965649 . S2CID 672379 ..
- Химия карбенов: от мимолетных промежуточных продуктов к мощным реагентам (Глава 4, Хидео Томиока (триплетное состояние); Глава 5 (синглетное состояние), Роджер У. Олдер) - ред. Гай Бертран
- Реакционная промежуточная химия Роберт А. Мосс, Мэтью Платц, Мейтленд Джонс (Глава 8, Стабильные синглетные карбены, Гай Бертран)
- RW Alder, в «Диаминокарбены: изучение структуры и реакционной способности», под ред. Дж. Бертран, Нью-Йорк, 2002 г.
- М. Регитц (1996). «Стабильные карбены - иллюзия или реальность?». Энгью. Chem. Междунар. Эд. 30 (6): 674–676. DOI : 10.1002 / anie.199106741 .
Для обзора физико-химических свойств (электроника, стерика, ...) N-гетероциклических карбенов:
- Т. Дрёге; Ф. Глориус (2010). «Мера всех колец - N-гетероциклические карбены». Энгью. Chem. Междунар. Эд. 49 (39): 6940–6952. DOI : 10.1002 / anie.201001865 . PMID 20715233 .
- Функциональные группы
- Карбены
- Металлоорганическая химия
- Органические соединения