| Семья пентаксинов | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
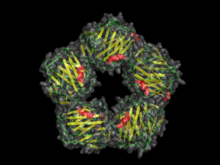 CRP взяты из PDB : 1B09 | ||||||||||
| Идентификаторы | ||||||||||
| Символ | Пентаксин | |||||||||
| Pfam | PF00354 | |||||||||
| ИнтерПро | IPR001759 | |||||||||
| ПРОФИЛЬ | PDOC00261 | |||||||||
| SCOP2 | 1sac / SCOPe / SUPFAM | |||||||||
| CDD | cd00152 | |||||||||
| ||||||||||
Пентраксины ( PTX ), также известные как пентаксины , представляют собой эволюционно консервативное семейство белков, характеризующееся тем, что они содержат домен белка пентраксина . Белки семейства пентраксинов участвуют в острых иммунологических ответах. [1] Они представляют собой класс рецепторов распознавания образов (PRR). Они представляют собой суперсемейство многофункциональных консервативных белков, некоторые из которых являются компонентами гуморального звена врожденного иммунитета и действуют как функциональные предки антител (Abs). Они известны как классические белки острой фазы (APP), известные уже более века. [2]
Структура [ править ]
Пентраксины характеризуются зависимым от кальция связыванием лиганда и характерной уплощенной структурой β-желейного валика, аналогичной структуре лектинов бобовых культур . [3] Название «пентраксин» происходит от греческого слова, обозначающего пять (пента) и ось (ось), относящееся к радиальной симметрии пяти мономеров, образующих кольцо примерно 95 Å в поперечнике и 35 Å в глубину, наблюдаемое у первых членов этого семейства, чтобы быть идентифицированным. «Короткие» пентраксины включают компонент сывороточного амилоида P (SAP) и C-реактивный белок (CRP). «Длинные» пентраксины включают РТХ3 (молекула, модулированная цитокинами) и несколько нейрональных пентраксинов.
Члены семьи [ править ]
Три основных члена семейства пентраксинов - это сывороточные белки: а именно, C-реактивный белок (CRP), [4] сывороточный амилоидный P-компонентный белок (SAP) [5] и женский белок (FP). [6] Белок PTX3 (или TSG-14) представляет собой индуцированный цитокинами белок, гомологичный CRP и SAP, но его функция еще не определена.
С-реактивный белок [ править ]
С-реактивный белок экспрессируется во время острой фазы ответа на повреждение ткани или воспаление у млекопитающих. Белок похож на антитело и выполняет несколько функций, связанных с защитой хозяина: он способствует агглютинации, набуханию бактериальной капсулы и фагоцитозу, а также активирует классический путь комплемента через его кальций-зависимое связывание с фосфохолином. [4] СРБ также были секвенированы у беспозвоночного Limulus polyphemus (атлантический подковообразный краб), где они являются нормальным компонентом гемолимфы.
Пентраксин 3 [ править ]
Пентраксин 3 (PTX3) - это белок острой фазы, уровень которого повышается во время тяжелых инфекций у людей. В случае инфекций центральной нервной системы PTX3 помогает различать бактериальный и асептический менингоэнцефалит: на самом деле, этот показатель значительно выше при бактериальном менингоэнцефалите. [7]
Амилоидный компонент P сыворотки [ править ]
Амилоидный Р-компонент сыворотки представляет собой белок позвоночных, идентичный тканевым формам амилоидного Р-компонента. Он обнаружен во всех типах амилоидных отложений, в базальной мембране клубочков и в эластических волокнах кровеносных сосудов. SAP связывается с различными липопротеидными лигандами кальций-зависимым образом, и было высказано предположение, что у млекопитающих это может иметь важные последствия при атеросклерозе и амилоидозе. [5]
Белок самки хомяка [ править ]
Белок самки хомяка является гомологом SAP, обнаруженным у Mesocricetus auratus (золотой хомяк). Концентрация этого белка плазмы изменяется половыми стероидами и стимулами, которые вызывают реакцию острой фазы. [6]
Нервная система [ править ]
Белки пентраксина, экспрессируемые в нервной системе, представляют собой нервный пентраксин I ( NPTXI ) и II ( NPTXII ). [8] NPTXI и NPTXII гомологичны и могут существовать в пределах одного вида. Предполагается, что оба белка опосредуют захват синаптических макромолекул и играют роль в синаптической пластичности. Апексин, акросомный белок сперматозоидов, является гомологом NPTXII, обнаруженного у Cavia porcellus ( морская свинка). [9]
Человек [ править ]
Человеческие гены, кодирующие белки, содержащие этот домен, включают:
- АСУ ТП
- CRP
- GPR144
- NPTX1 ; NPTX2 ; NPTXR
- PTX3
- SVEP1
Ссылки [ править ]
- ^ Gewurz H, Zhang XH, Lint TF (февраль 1995). «Структура и функции пентраксинов». Текущее мнение в иммунологии . 7 (1): 54–64. DOI : 10.1016 / 0952-7915 (95) 80029-8 . PMID 7772283 .
- ^ Мартинес де ла Торре Y, Fabbri M, Jaillon S, Bastone A, Nebuloni M, Vecchi A и др. (Май 2010 г.). «Эволюция семейства пентраксинов: новая запись PTX4» . Журнал иммунологии . 184 (9): 5055–64. DOI : 10.4049 / jimmunol.0901672 . PMID 20357257 .
- ^ Эмсли Дж, Белый ОН, О'Хара ВР, Олива G, Сринивазан N, Тикл И.Я. и др. (Январь 1994 г.). «Структура пентамерного амилоидного P компонента сыворотки крови человека». Природа . 367 (6461): 338–45. Bibcode : 1994Natur.367..338E . DOI : 10.1038 / 367338a0 . PMID 8114934 . S2CID 4284282 .
- ^ a b Romero IR, Morris C, Rodriguez M, Du Clos TW, Mold C (май 1998 г.). «Воспалительный потенциал С-реактивных белковых комплексов по сравнению с иммунными комплексами». Клиническая иммунология и иммунопатология . 87 (2): 155–62. DOI : 10,1006 / clin.1997.4516 . PMID 9614930 .
- ^ Б Li XA, Ютани C, Shimokado K (март 1998). «Амилоидный Р-компонент сыворотки связан с липопротеином высокой плотности, а также с липопротеином очень низкой плотности, но не с липопротеином низкой плотности». Сообщения о биохимических и биофизических исследованиях . 244 (1): 249–52. DOI : 10.1006 / bbrc.1998.8248 . PMID 9514915 .
- ^ a b Coe JE, Росс MJ (август 1997). «Электрофоретический полиморфизм пентраксина хомяка, женский белок (амилоидный компонент P)» . Скандинавский журнал иммунологии . 46 (2): 180–6. DOI : 10.1046 / j.1365-3083.1997.d01-109.x . PMID 9583999 . S2CID 6361670 .
- ^ Затта М., Ди Белла С., Боттацци Б., Росси Ф., Д'Агаро П., Сегат Л. и др. (Декабрь 2019 г.). «Определение уровня пентраксина 3 в спинномозговой жидкости при инфекциях центральной нервной системы». Европейский журнал клинической микробиологии и инфекционных заболеваний . 39 (4): 665–670. DOI : 10.1007 / s10096-019-03767-ш . hdl : 11368/2972747 . PMID 31813079 . S2CID 208812200 .
- ^ Omeis И.А., Hsu YC, Перин MS (сентябрь 1996). «Мышиный и человеческий нейрональный пентраксин 1 (NPTX1): сохранение, геномная структура и хромосомная локализация». Геномика . 36 (3): 543–5. DOI : 10.1006 / geno.1996.0503 . PMID 8884281 .
- Перейти ↑ Reid MS, Blobel CP (декабрь 1994 г.). «Апексин, акросомальный пентаксин». Журнал биологической химии . 269 (51): 32615–20. PMID 7798266 .