Короткой шпильки РНК или небольшая шпилька РНК ( shRNA / Шпилька Вектор) представляет собой искусственный РНК - молекулы с жесткой свою очередь шпильки , которые могут быть использованы для экспрессии гена - мишени с помощью молчание интерференции РНК (RNAi). [1] [2] Экспрессия shRNA в клетках обычно осуществляется путем доставки плазмид или через вирусные или бактериальные векторы . shRNA является выгодным медиатором РНКи в том смысле, что она имеет относительно низкую скорость деградации и оборота. Однако это требует использования вектора экспрессии , который может вызывать побочные эффекты при применении в медицине. [3]
Выбор промотора важен для достижения устойчивой экспрессии кшРНК. Сначала использовались промоторы полимеразы III, такие как U6 и H1; однако эти промоторы лишены пространственного и временного контроля. [3] Таким образом, произошел переход к использованию промоторов полимеразы II для регулирования экспрессии shРНК.
Доставка [ править ]
Экспрессия shRNA в клетках может быть получена путем доставки плазмид или через вирусные или бактериальные векторы .
Доставка плазмид в клетки посредством трансфекции для получения экспрессии shРНК может осуществляться с использованием коммерчески доступных реагентов in vitro . Однако этот метод неприменим in vivo и поэтому имеет ограниченное применение.
Использование бактериального вектора для получения экспрессии shРНК в клетках - относительно недавний подход. Он основан на исследованиях, показывающих, что рекомбинантная Escherichia coli , содержащая плазмиду с shРНК, скармливаемая мышам, может подавлять экспрессию целевого гена в эпителии кишечника. [4] Этот подход использовался в 2012 году в клинических испытаниях, чтобы попытаться лечить пациентов с семейным аденоматозным полипозом. [5]
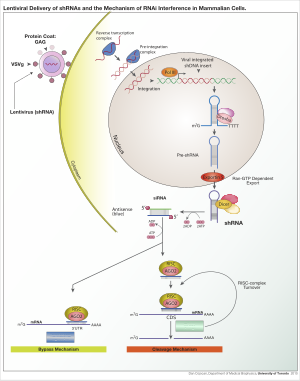
Для получения экспрессии shРНК в клетках можно использовать различные вирусные векторы, включая аденоассоциированные вирусы (AAV), аденовирусы и лентивирусы.. У аденоассоциированных вирусов и аденовирусов геномы остаются эписомальными. Это выгодно, поскольку исключается инсерционный мутагенез. Его недостаток состоит в том, что потомство клетки будет быстро терять вирус в результате деления клетки, если клетка не делится очень медленно. AAV отличаются от аденовирусов тем, что вирусные гены удалены, и они имеют пониженную упаковочную способность. Лентивирусы интегрируются в участки транскрипционно активного хроматина и, таким образом, передаются клеткам потомства. При таком подходе повышается риск инсерционного мутагенеза; однако риск можно снизить, если использовать лентивирус с дефицитом интегразы. [6]
Механизм действия [ править ]
Как только вектор интегрирован в геном хозяина, кшРНК затем транскрибируется в ядре полимеразой II или полимеразой III в зависимости от выбора промотора. Продукт имитирует pri-microRNA (pri-miRNA) и обрабатывается Drosha . Полученная пре-shРНК экспортируется из ядра с помощью Exportin 5. Этот продукт затем обрабатывается Dicer и загружается в РНК-индуцированный комплекс сайленсинга (RISC). Смысловая (пассажирская) нить деградирована. Антисмысловая (направляющая) цепь направляет RISC к мРНК, которая имеет комплементарную последовательность. В случае полной комплементарности RISC расщепляет мРНК. В случае несовершенной комплементарности RISC подавляет трансляцию мРНК. В обоих случаях shРНК приводит к молчанию гена-мишени.
Применение в генной терапии [ править ]
Из-за способности shRNA обеспечивать специфическое, продолжительное, молчание генов, существует большой интерес к использованию shRNA для приложений генной терапии. Ниже обсуждаются три примера терапии на основе shRNA.
Компания Gradalis, Inc. разработала вакцину FANG, которая используется для лечения запущенных форм рака. FANG полагается на бифункциональную shRNA (bi-shRNA) против иммуносупрессивных трансформирующих факторов роста (TGF) β1 и β2. [8] Аутологичные опухолевые клетки собирали у пациентов, и плазмиду, кодирующую бифункциональную shРНК и гранулоцитарно-макрофагальный колониестимулирующий фактор (GMCSF), вводили ex vivo посредством электропорации. Эти клетки позже были облучены и снова введены пациенту.
Марина Биотех разработала CEQ508, который используется для лечения семейного аденоматозного полипоза. CEQ508 использует бактериальный вектор для доставки shРНК против β-катенина.
Компания Gradalis, Inc. разработала бифункциональную shRNA-STMN1 (pbi-shRNA STMN1), которая используется для лечения запущенных и / или метастатических форм рака. Эта pbi-shRNA STMN1 действует против статмина 1 и доставляется внутри опухоли через липоплекс (LP) биламеллярных инвагинированных пузырьков ( BIV) .
С некоторыми проблемами обычно сталкиваются терапевтические средства на основе shRNA. Самая большая проблема - это доставка. shRNA обычно доставляется с использованием вектора, и хотя они обычно эффективны, они создают серьезные проблемы с безопасностью. В частности, подходы к вирусной генной терапии оказались опасными в прошлых клинических испытаниях. В первом поколении ретровирусной генной терапии у некоторых пациентов, получавших вирусные векторы для лечения синдрома Вискотта – Олдрича, развился острый Т-клеточный лейкоз. Было установлено, что это было вызвано местоположением инсерции вирусного вектора. [9] Возможное перенасыщение RISC также является проблемой. Если кшРНК экспрессируется на слишком высоких уровнях, клетка может быть не в состоянии правильно обрабатывать эндогенную РНК, что может вызвать серьезные проблемы. Другой проблемой является возможность того, что у пациента может развиться иммунный ответ против терапии. [10] Наконец, могут быть эффекты нецелевые, и кшРНК может заставить замолчать другие непредусмотренные гены. При разработке успешных новых терапевтических средств на основе shRNA необходимо принимать во внимание все эти проблемы.
См. Также [ править ]
- Малая интерферирующая РНК
Ссылки [ править ]
- ^ Paddison PJ, Caudy А. Бернштейн Е, Ханнон GJ, Конклин DS (апрель 2002). «Короткие шпильчатые РНК (кшРНК) индуцируют специфичное для последовательности молчание в клетках млекопитающих» . Гены и развитие . 16 (8): 948–58. DOI : 10,1101 / gad.981002 . PMC 152352 . PMID 11959843 .
- ^ Brummelkamp TR, Бернардс R , R Агами (апрель 2002). «Система для стабильной экспрессии коротких интерферирующих РНК в клетках млекопитающих». Наука . 296 (5567): 550–3. DOI : 10.1126 / science.1068999 . hdl : 1874/15573 . PMID 11910072 .
- ^ a b Ван З., Рао Д.Д., Сензер Н., Нямунайтис Дж. (декабрь 2011 г.). «РНК-интерференция и терапия рака». Фармацевтические исследования . 28 (12): 2983–95. DOI : 10.1007 / s11095-011-0604-5 . PMID 22009588 .
- Перейти ↑ Xiang S, Fruehauf J, Li CJ (июнь 2006 г.). «Бактерии, экспрессирующие РНК с короткой шпилькой, вызывают интерференцию РНК у млекопитающих». Природа Биотехнологии . 24 (6): 697–702. DOI : 10.1038 / nbt1211 . PMID 16699500 .
- ^ Burnett JC, Росси JJ, Tiemann K (сентябрь 2011). «Текущий прогресс терапии миРНК / шРНК в клинических испытаниях» . Биотехнологический журнал . 6 (9): 1130–46. DOI : 10.1002 / biot.201100054 . PMC 3388104 . PMID 21744502 .
- ↑ Lombardo A, Genovese P, Beausejour CM, Colleoni S, Lee YL, Kim KA, Ando D, Urnov FD, Galli C, Gregory PD, Holmes MC, Naldini L (ноябрь 2007 г.). «Редактирование генов в стволовых клетках человека с использованием нуклеаз цинковых пальцев и доставки лентивирусных векторов с дефектом интегразы». Природа Биотехнологии . 25 (11): 1298–306. DOI : 10.1038 / nbt1353 . PMID 17965707 .
- ^ Macrae IJ, Чжоу K, Li F, Repic A, Брукс А.Н., Cande WZ, Adams PD, Doudna JA (январь 2006). «Структурная основа процессинга двухцепочечной РНК с помощью Dicer». Наука . 311 (5758): 195–8. DOI : 10.1126 / science.1121638 . PMID 16410517 .
- ^ Senzer N, Барвы М, Куна - J, Мельника А, Beitsch Р, Лазар М, Лифшиц S, Маги М, О , J, Мельница СВ, Беделлом С, Хиггс С, Кумар Р, Ю У, Норвелл Ж, Phalon С, Taquet N, Рао Д.Д., Ван З., Джей С.М., Паппен Б.О., Валлравен Дж., Бруникарди ФК, Шанахан Д.М., Мейплс П.Б., Немунайтис Дж. (Март 2012 г.). «Фаза I испытания вакцины« bi-shRNAi (фурин) / ДНК GMCSF / аутологичных опухолевых клеток »(FANG) при распространенном раке» . Молекулярная терапия . 20 (3): 679–86. DOI : 10.1038 / mt.2011.269 . PMC 3293620 . PMID 22186789 .
- Перейти ↑ Persons DA, Baum C (февраль 2011 г.). «Решение проблемы γ-ретровирусных векторов, содержащих длинные концевые повторы» . Молекулярная терапия . 19 (2): 229–31. DOI : 10.1038 / mt.2010.305 . PMC 3034864 . PMID 21289636 .
- ^ Уайтхед К.А., Dahlman JE, Langer RS, Anderson DG (2011). «Молчание или стимуляция? SiRNA доставки и иммунной системы». Ежегодный обзор химической и биомолекулярной инженерии . 2 : 77–96. DOI : 10,1146 / annurev-chembioeng-061010-114133 . PMID 22432611 .
