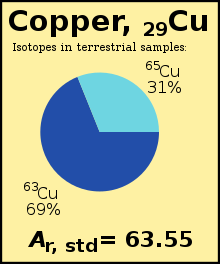
Стандартный атомный вес ( г, стандартный (Е)) из химического элемента представляет собой взвешенное среднее арифметическое из относительных изотопных масс всех изотопов этого элемента , взвешенного по обилию каждого изотопа на Земле . Например, изотоп 63 Cu ( A r = 62,929) составляет 69% меди на Земле, остальное - 65 Cu ( A r = 64,927), поэтому
Поскольку относительные изотопные массы являются безразмерными величинами , это средневзвешенное значение также безразмерно. Его можно преобразовать в меру массы (с размером M ), умножив ее на дальтон , также известный как константа атомной массы.
Среди различных вариантов понятия атомного веса ( A r , также известного как относительная атомная масса ), используемых учеными, стандартный атомный вес ( A r, стандартный ) является наиболее распространенным и практичным. Стандартный атомный вес каждого химического элемента определяется и публикуется Комиссией по изотопному содержанию и атомным весам (CIAAW) Международного союза чистой и прикладной химии (IUPAC) на основе естественных, стабильных, наземныхисточники элемента. В определении указывается использование образцов из многих репрезентативных источников с Земли, так что это значение можно широко использовать в качестве «атомного веса» для веществ, которые встречаются в действительности, например, в фармацевтике и научных исследованиях. Нестандартизированные атомные веса элемента зависят от источников и образцов, например, атомный вес углерода в конкретной кости из определенного археологического памятника. Стандартный атомный вес усредняет такие значения в диапазоне атомных весов, который химик мог бы ожидать от многих случайных образцов с Земли. Этот диапазон является обоснованием для обозначения интервала, данного для некоторых стандартных значений атомного веса.
Из 118 известных химических элементов 80 имеют стабильные изотопы, а 84 имеют значение, основанное на земной среде. Обычно таким значением является, например, гелий: A r, стандарт (He) = 4.002 602 (2) . «(2)» указывает на погрешность последней показанной цифры, чтобы читать4.002 602 ± 0.000 002 . ИЮПАК также публикует сокращенные значения , округленные до пяти значащих цифр. Для гелия A r сокращенно (He) = 4.0026 .
Для тринадцати элементов образцы расходятся по этому значению, потому что их источники образцов имели разную историю распада. Например, таллий (Tl) в осадочных породах имеет другой изотопный состав, чем в магматических породах и вулканических газах. Для этих элементов стандартный атомный вес обозначен как интервал: A r, standard (Tl) = [204,38, 204,39] . С таким интервалом для менее сложных ситуаций IUPAC также публикует обычное значение . Для таллия A r условно (Tl) = 204,38 .
Определение [ править ]

Стандартный атомный вес особое значение относительной атомной массы. Он определяется как "рекомендуемые значения" относительных атомных масс источников в локальной среде земной коры и атмосферы, определенные Комиссией IUPAC по атомным весам и изотопному содержанию (CIAAW). [2]В общем, значения из разных источников подвержены естественным колебаниям из-за разной радиоактивной истории источников. Таким образом, стандартные атомные веса - это ожидаемые значения атомных весов из ряда образцов или источников. Ограничивая источники только земным происхождением, значения, определенные CIAAW, имеют меньшую дисперсию и являются более точным значением для относительных атомных масс (атомных масс), фактически обнаруженных и используемых в мирских материалах.
В CIAAW-опубликованные значения используются , а иногда и на законном основании требуется в массовых расчетах. Значения имеют неопределенность (указано в скобках) или являются интервалом ожидания (см. Пример на иллюстрации непосредственно выше). Эта неопределенность отражает естественную изменчивость изотопного распределения для элемента, а не неопределенность измерения (которая намного меньше с качественными приборами). [3]
Хотя существует попытка охватить диапазон изменчивости на Земле стандартными значениями атомного веса, известны случаи, когда образцы минералов содержат элементы с атомным весом, который отличается от стандартного диапазона атомного веса. [2]
Для синтетических элементов образующийся изотоп зависит от средств синтеза, поэтому концепция естественного изотопного содержания не имеет значения. Поэтому для синтетических элементов общее количество нуклонов [ сомнительно ] наиболее стабильного изотопа (т.е. изотопа с самым длинным периодом полураспада) указано в скобках вместо стандартного атомного веса.
Когда в химии используется термин «атомный вес», обычно подразумевается более конкретный стандартный атомный вес. Это стандартные атомные веса, которые используются в периодических таблицах и во многих стандартных справочниках по обычной химии Земли.
Литий представляет собой уникальный случай, когда в некоторых случаях было обнаружено, что естественное содержание изотопов нарушается деятельностью человека по разделению изотопов до такой степени, что это влияет на неопределенность его стандартного атомного веса, даже в образцах, полученных из природных источников, таких как реки. [ необходима цитата ] [ сомнительно ]
Наземное определение [ править ]
Примером того, почему «обычные земные источники» должны быть указаны при указании стандартных значений атомного веса, является элемент аргон. В разных точках Солнечной системы атомный вес аргона варьируется до 10% из-за крайних различий в изотопном составе. Если основным источником аргона является распад40K в породах,40
Ar будет доминирующим изотопом. К таким локациям относятся планеты Меркурий и Марс, а также луна Титан. На Земле соотношение трех изотопов 36 Ar: 38 Ar: 40 Ar составляет приблизительно 5: 1: 1600, что дает земному аргону стандартный атомный вес 39,948 (1).
Однако в остальной вселенной дело обстоит иначе. В аргоне, образующемся непосредственно в результате звездного нуклеосинтеза , преобладает нуклид альфа-процесса.36
Ar . Соответственно в солнечном аргоне содержится 84,6%36
Ar (согласно измерениям солнечного ветра ) [4], а соотношение трех изотопов 36 Ar: 38 Ar: 40 Ar в атмосферах внешних планет составляет 8400: 1600: 1. [5] Атомный вес аргона в Солнце и большая часть Вселенной, следовательно, будет только приблизительно 36,3. [6]
Причины неопределенности на Земле [ править ]
Как известно, опубликованное значение атомной массы сопровождается неопределенностью. Эта неопределенность (и связанная с ней точность) следует из ее определения, поскольку источник является «наземным и стабильным». Систематические причины неопределенности:
- Пределы измерений. Как всегда, физическое измерение никогда не бывает конечным. Всегда есть больше подробностей, которые можно найти и прочитать. Это относится к каждому одного , чистому изотопу Found. Например, сегодня массу основного природного изотопа фтора ( фтора-19 ) можно измерить с точностью до одиннадцати знаков после запятой:18.998 403 163 (6) . Но может появиться еще более точная система измерения, дающая больше десятичных знаков.
- Несовершенные смеси изотопов. В отобранных и измеренных образцах смесь (относительное содержание) этих изотопов может варьироваться. Например медь. В то время как в целом два его изотопа составляют 69,15% и 30,85% от всей обнаруженной меди, измеряемый природный образец мог иметь неполное «перемешивание», и поэтому процентные значения различаются. Разумеется, точность улучшается за счет измерения большего количества образцов, но остается эта причина неопределенности. (Пример: образцы свинца настолько разнятся, что точнее четырех цифр не подобрать:207,2 )
- Земные источники с разной историей. Источник является областью больше , исследуются, например , «воды океана» или «вулканических породы» (в отличие от «образца»: единая куча материальных существ исследована). Похоже, что некоторые элементы имеют разный изотопный состав для каждого источника. Например, таллий в вулканической породе имеет больше легких изотопов, а в осадочной породе - больше тяжелых изотопов. Нет среднего земного числа. Эти элементы показывают обозначение интервала: A r, standard (Tl) = [204,38 , 204,39 ]. Из практических соображений публикуется также упрощенный «условный» номер (для Tl: 204,38).
Эти три неопределенности суммируются. Опубликованная стоимость является результатом всего этого.
Определение относительной атомной массы [ править ]
Современные относительные атомные массы (термин, характерный для данного образца элемента) рассчитываются на основе измеренных значений атомной массы (для каждого нуклида) и изотопного состава образца. Доступны высокоточные атомные массы [7] [8] практически для всех нерадиоактивных нуклидов, но изотопные составы труднее измерить с высокой точностью и более подвержены вариациям между образцами. [9] [10] По этой причине относительные атомные массы 22 мононуклидных элементов(которые равны изотопным массам для каждого из отдельных встречающихся в природе нуклидов этих элементов) известны с особенно высокой точностью. Например, для относительной атомной массы фтора существует погрешность только в одну часть на 38 миллионов , точность, которая превышает текущее лучшее значение для постоянной Авогадро (одна часть на 20 миллионов).
| Изотоп | Атомная масса [8] | Изобилие [9] | |
|---|---|---|---|
| Стандарт | Классифицировать | ||
| 28 Si | 27,976 926 532 46 (194) | 92,2297 (7)% | 92,21–92,25% |
| 29 Si | 28,976 494 700 (22) | 4,6832 (5)% | 4,67–4,69% |
| 30 Si | 29 973 770 171 (32) | 3,0872 (5)% | 3,08–3,10% |
Расчет приведен на примере кремния , относительная атомная масса которого особенно важна в метрологии . Кремний существует в природе как смесь трех изотопов: 28 Si, 29 Si и 30 Si. Атомные массы этих нуклидов известны с точностью до одной части на 14 миллиардов для 28 Si и примерно одной части на миллиард для остальных. Однако диапазон естественного содержания изотопов таков, что стандартное содержание может составлять только около ± 0,001% (см. Таблицу). Расчет
- A r (Si) = (27,97693 × 0,922297) + (28,97649 × 0,046832) + (29,97377 × 0,030872) = 28,0854
Оценка неопределенности затруднена [11], особенно потому, что распределение выборки не обязательно симметрично: стандартные относительные атомные массы ИЮПАК указаны с расчетными симметричными неопределенностями [12], а значение для кремния составляет 28,0855 (3). Относительная стандартная неопределенность этого значения составляет 1 × 10 –5 или 10 ppm. Чтобы еще больше отразить эту естественную изменчивость, в 2010 году ИЮПАК принял решение перечислить относительные атомные массы 10 элементов как интервал, а не фиксированное число. [13]
Споры по поводу названий [ править ]
Использование названия «атомный вес» вызвало много споров среди ученых. [14] Противники названия обычно предпочитают термин «относительная атомная масса» (не путать с атомной массой ). Основное возражение состоит в том, что атомный вес - это не вес , то есть сила, действующая на объект в гравитационном поле и измеряемая в единицах силы, таких как ньютон или фунталь .
В ответ сторонники термина «атомный вес» указывают (среди прочих аргументов) [14], что
- название постоянно использовалось для одного и того же количества с тех пор, как оно было впервые сформулировано в 1808 году; [15]
- в течение большей части этого времени атомные веса действительно измерялись взвешиванием (то есть гравиметрическим анализом ), и название физической величины не должно изменяться просто потому, что изменился метод ее определения;
- термин «относительная атомная масса» следует использовать для обозначения массы конкретного нуклида (или изотопа ), а термин « атомный вес » следует использовать для обозначения средневзвешенного значения атомных масс по всем атомам в образце;
- нередки случаи, когда названия физических величин вводят в заблуждение, которые сохраняются по историческим причинам, например,
- электродвижущая сила , которая не является силой
- разрешающая способность , которая не является величиной мощности
- молярная концентрация , которая не является молярным количеством (количество, выраженное на единицу количества вещества).
Можно добавить, что атомный вес часто не является действительно «атомным», поскольку он не соответствует свойству какого-либо отдельного атома. Тот же аргумент можно было бы привести против «относительной атомной массы», употребляемой в этом смысле.
Опубликованные значения [ править ]
ИЮПАК публикует одно формальное значение для каждого стабильного элемента, называемое стандартным атомным весом . [16] [17] Любые обновления публикуются два раза в год (в разные годы). В 2015 году был обновлен атомный вес иттербия. [16] В 2017 году было изменено 14 атомных весов, включая изменение аргона с единственного числа на интервальное значение. [18] [19]
Опубликованное значение может иметь неопределенность, как для неона: 20.1797 (6) , или может быть интервалом, как для бора: [10.806, 10.821].
Наряду с этими 84 значениями IUPAC также публикует сокращенные значения (только до пяти цифр на номер), а для двенадцати значений интервалов - обычные значения (значения с одним числом).
Символ A r представляет собой относительную атомную массу, например, для определенного образца. Чтобы быть конкретным, стандартный атомный вес можно обозначить как A r, standard (E) , где (E) - символ элемента.
Сокращенный атомный вес [ править ]
Сокращенном атомный вес , а также опубликованный CIAAW, является производным от стандартного атомного веса уменьшая число до пяти цифр (пяти значащих цифр). В названии не сказано «округлый».
Интервал границы закругленные вниз для первой (lowmost) границы, и вверх для вверх () границ первостепенных. Таким образом, полностью покрывается более точный исходный интервал. [20]
Примеры:
- Кальций: A r, стандартный (Ca) = 40,078 (4) → A r, сокращенный (Ca) = 40,078
- Гелий: A r, стандартный (He) = 4,002602 (2) → A r, сокращенный (He) = 4,0026
- Водород: A r, стандарт (H) = [1,00784, 1,00811] → A r, сокращенный (H) = [1,0078, 1,0082]
Условный атомный вес [ править ]
Тринадцать химических элементов имеют стандартный атомный вес, который определяется не как одно число, а как интервал. Например, водород имеет A r, стандарт (H) = [1,00 784, 1,00811] . Это обозначение указывает на то, что различные источники на Земле имеют существенно разный изотопный состав, и в эти два числа включены неопределенности. Для этих элементов не существует «среднего для Земли» строения, и «правильное» значение не является его средним (это будет 1,007975 для водорода с погрешностью (± 0,000135), которая заставит его просто покрыть интервал). Однако для ситуаций, когда приемлемо менее точное значение, CIAAW опубликовал однозначный условный атомный вес, который можно использовать, например, в торговле. Для водорода Ar, условное (H) = 1,008 . Тринадцать элементов: водород, литий, бор, углерод, азот, кислород, магний, кремний, сера, хлор, аргон, бром и таллий. [21]
Формальный короткий атомный вес [ править ]
Используя сокращенное значение и обычное значение для тринадцати значений интервалов, можно дать короткое значение, определенное IUPAC (5 цифр плюс неопределенность), для всех стабильных элементов. Во многих ситуациях и в периодических таблицах это может быть достаточно подробно. [22]
Обзор: формальные значения стандартного атомного веса [1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Элемент (Е) | A r, стандарт (E) Таблица 1 [17] | Тип значения | A r, стандартное сокращение (E) Таблица 2 [20] | A r, стандартное (E) Таблица 3 [21] | A r, стандартное формальное сокращение (E) Таблицы 2 и 3 [22] | Массовое число [наиболее стабильный изотоп] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| водород | 1 ч | [1.007 84 , 1.008 11 ] | Интервал | [1.0078 , 1.0082 ] | 1,008 | 1,008 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| азот | 7 с.ш. | [14.006 43 , 14.007 28 ] | Интервал | [14.006 , 14.008 ] | 14.007 | 14.007 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| фтор | 9 F | 18,998 403 163 (6) | Значение (неопределенность) | 18,998 | 18,998 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| кальций | 20 Ca | 40.078 (4) | Значение (неопределенность) | 40.078 (4) | 40.078 (4) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| технеций | 43 Тс | (никто) | Самый стабильный изотоп | [97] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Список атомных весов [ править ]
| Z | Символ | Имя | A r, стандарт | сокращенный | общепринятый | → формальный, короткий | год изменился |
|---|---|---|---|---|---|---|---|
| 1 | ЧАС | водород | [1.007 84 , 1.008 11 ] | [1.0078 , 1.0082 ] | 1,008 | 1,008 | 2009 г. |
| 2 | Он | гелий | 4,002 602 (2) | 4,0026 | 4,0026 | 1983 г. | |
| 3 | Ли | литий | [6,938 , 6,997 ] | [6,938 , 6,997 ] | 6,94 | 6,94 | 2009 г. |
| 4 | Быть | бериллий | 9,012 1831 (5) | 9,0122 | 9,0122 | 2013 | |
| 5 | B | бор | [10.806 , 10,821 ] | [10.806 , 10,821 ] | 10,81 | 10,81 | 2009 г. |
| 6 | C | углерод | [12.0096 , 12.0116 ] | [12.009 , 12.012 ] | 12,011 | 12,011 | 2009 г. |
| 7 | N | азот | [14.006 43 , 14.007 28 ] | [14.006 , 14.008 ] | 14.007 | 14.007 | 2009 г. |
| 8 | О | кислород | [15.999 03 , г. 15,999 77 ] | [15,999 , 16,000 ] | 15,999 | 15,999 | 2009 г. |
| 9 | F | фтор | 18,998 403 163 (6) | 18,998 | 18,998 | 2013 | |
| 10 | Ne | неон | 20,1797 (6) | 20,180 | 20,180 | 1985 г. | |
| 11 | Na | натрий | 22,989 769 28 (2) | 22,990 | 22,990 | 2005 г. | |
| 12 | Mg | магний | [24.304 , г. 24.307 ] | [24.304 , г. 24.307 ] | 24.305 | 24.305 | 2011 г. |
| 13 | Al | алюминий | 26.981 5384 (3) | 26,982 | 26,982 | 2017 г. | |
| 14 | Si | кремний | [28.084 , 28.086 ] | [28.084 , 28.086 ] | 28,085 | 28,085 | 2009 г. |
| 15 | п | фосфор | 30,973 761 998 (5) | 30 974 | 30 974 | 2013 | |
| 16 | S | сера | [32.059 , 32.076 ] | [32.059 , 32.076 ] | 32.06 | 32.06 | 2009 г. |
| 17 | Cl | хлор | [35,446 , 35.457 ] | [35,446 , 35.457 ] | 35,45 | 35,45 | 2009 г. |
| 18 | Ar | аргон | [39,792 , 39.963 ] | [39,792 , 39.963 ] | 39,95 [23] | 39,95 | 2017 г. |
| 19 | K | калий | 39,0983 (1) | 39,098 | 39,098 | 1979 г. | |
| 20 | Ca | кальций | 40.078 (4) | 40.078 (4) | 40.078 (4) | 1983 г. | |
| 21 год | Sc | скандий | 44,955 908 (5) | 44,956 | 44,956 | 2013 | |
| 22 | Ti | титан | 47,867 (1) | 47,867 | 47,867 | 1993 г. | |
| 23 | V | ванадий | 50,9415 (1) | 50,942 | 50,942 | 1977 г. | |
| 24 | Cr | хром | 51,9961 (6) | 51,996 | 51,996 | 1983 г. | |
| 25 | Mn | марганец | 54.938 043 (2) | 54,938 | 54,938 | 2017 г. | |
| 26 | Fe | утюг | 55,845 (2) | 55,845 (2) | 55,845 (2) | 1993 г. | |
| 27 | Co | кобальт | 58,933 194 (3) | 58,933 | 58,933 | 2017 г. | |
| 28 | Ni | никель | 58,6934 (4) | 58,693 | 58,693 | 2007 г. | |
| 29 | Cu | медь | 63,546 (3) | 63,546 (3) | 63,546 (3) | 1969 г. | |
| 30 | Zn | цинк | 65,38 (2) | 65,38 (2) | 65,38 (2) | 2007 г. | |
| 31 год | Ga | галлий | 69,723 (1) | 69,723 | 69,723 | 1987 г. | |
| 32 | Ge | германий | 72,630 (8) | 72,630 (8) | 72,630 (8) | 2009 г. | |
| 33 | В качестве | мышьяк | 74,921 595 (6) | 74,922 | 74,922 | 2013 | |
| 34 | Se | селен | 78.971 (8) | 78.971 (8) | 78.971 (8) | 2013 | |
| 35 год | Br | бром | [79.901 , 79,907 ] | [79.901 , 79,907 ] | 79,904 | 79,904 | 2011 г. |
| 36 | Kr | криптон | 83,798 (2) | 83,798 (2) | 83,798 (2) | 2001 г. | |
| 37 | Руб. | рубидий | 85,4678 (3) | 85,468 | 85,468 | 1969 г. | |
| 38 | Sr | стронций | 87,62 (1) | 87,62 | 87,62 | 1969 г. | |
| 39 | Y | иттрий | 88,905 84 (1) | 88,906 | 88,906 | 2017 г. | |
| 40 | Zr | цирконий | 91,224 (2) | 91,224 (2) | 91,224 (2) | 1983 г. | |
| 41 год | Nb | ниобий | 92,906 37 (1) | 92,906 | 92,906 | 2017 г. | |
| 42 | Пн | молибден | 95,95 (1) | 95,95 | 95,95 | 2013 | |
| 43 | Tc | технеций | - | - | |||
| 44 | RU | рутений | 101,07 (2) | 101,07 (2) | 101,07 (2) | 1983 г. | |
| 45 | Rh | родий | 102,905 49 (2) | 102,91 | 102,91 | 2017 г. | |
| 46 | Pd | палладий | 106,42 (1) | 106,42 | 106,42 | 1979 г. | |
| 47 | Ag | серебро | 107,8682 (2) | 107,87 | 107,87 | 1985 г. | |
| 48 | CD | кадмий | 112,414 (4) | 112,41 | 112,41 | 2013 | |
| 49 | В | индий | 114,818 (1) | 114,82 | 114,82 | 2011 г. | |
| 50 | Sn | банка | 118,710 (7) | 118,71 | 118,71 | 1983 г. | |
| 51 | Sb | сурьма | 121,760 (1) | 121,76 | 121,76 | 1993 г. | |
| 52 | Te | теллур | 127,60 (3) | 127,60 (3) | 127,60 (3) | 1969 г. | |
| 53 | я | йод | 126,904 47 (3) | 126,90 | 126,90 | 1985 г. | |
| 54 | Xe | ксенон | 131,293 (6) | 131,29 | 131,29 | 1999 г. | |
| 55 | CS | цезий | 132,905 451 96 (6) | 132,91 | 132,91 | 2013 | |
| 56 | Ба | барий | 137,327 (7) | 137,33 | 137,33 | 1985 г. | |
| 57 | Ла | лантан | 138,905 47 (7) | 138,91 | 138,91 | 2005 г. | |
| 58 | Ce | церий | 140,116 (1) | 140,12 | 140,12 | 1995 г. | |
| 59 | Pr | празеодим | 140,907 66 (1) | 140,91 | 140,91 | 2017 г. | |
| 60 | Nd | неодим | 144,242 (3) | 144,24 | 144,24 | 2005 г. | |
| 61 | Вечера | прометий | - | - | |||
| 62 | См | самарий | 150,36 (2) | 150,36 (2) | 150,36 (2) | 2005 г. | |
| 63 | Европа | европий | 151,964 (1) | 151,96 | 151,96 | 1995 г. | |
| 64 | Б-г | гадолиний | 157,25 (3) | 157,25 (3) | 157,25 (3) | 1969 г. | |
| 65 | Tb | тербий | 158,925 354 (8) | 158,93 | 158,93 | 2017 г. | |
| 66 | Dy | диспрозий | 162 500 (1) | 162,50 | 162,50 | 2001 г. | |
| 67 | Хо | гольмий | 164,930 328 (7) | 164,93 | 164,93 | 2017 г. | |
| 68 | Э | эрбий | 167,259 (3) | 167,26 | 167,26 | 1999 г. | |
| 69 | Тм | тулий | 168,934 218 (6) | 168,93 | 168,93 | 2017 г. | |
| 70 | Yb | иттербий | 173,045 (10) | 173,05 | 173,05 | 2015 г. | |
| 71 | Лу | лютеций | 174,9668 (1) | 174,97 | 174,97 | 2007 г. | |
| 72 | Hf | гафний | 178,486 (6) | 178,49 | 178,49 (2) | 2019 г. | |
| 73 | Та | тантал | 180.947 88 (2) | 180,95 | 180,95 | 2005 г. | |
| 74 | W | вольфрам | 183,84 (1) | 183,84 | 183,84 | 1991 г. | |
| 75 | Re | рений | 186.207 (1) | 186,21 | 186,21 | 1973 г. | |
| 76 | Операционные системы | осмий | 190,23 (3) | 190,23 (3) | 190,23 (3) | 1991 г. | |
| 77 | Ir | иридий | 192,217 (2) | 192,22 | 192,22 | 2017 г. | |
| 78 | Pt | платина | 195.084 (9) | 195,08 | 195,08 | 2005 г. | |
| 79 | Au | золото | 196.966 570 (4) | 196,97 | 196,97 | 2017 г. | |
| 80 | Hg | Меркурий | 200,592 (3) | 200,59 | 200,59 | 2011 г. | |
| 81 год | Tl | таллий | [204,382 , 204,385 ] | [204,38 , 204,39 ] | 204,38 | 204,38 | 2009 г. |
| 82 | Pb | вести | 207,2 (1) | 207,2 | 207,2 | 1969 г. | |
| 83 | Би | висмут | 208,980 40 (1) | 208,98 | 208,98 | 2005 г. | |
| 84 | По | полоний | - | - | |||
| 85 | В | астатин | - | - | |||
| 86 | Rn | радон | - | - | |||
| 87 | Пт | франций | - | - | |||
| 88 | Ра | радий | - | - | |||
| 89 | Ac | актиний | - | - | |||
| 90 | Чт | торий | 232,0377 (4) | 232,04 | 232,04 | 2013 | |
| 91 | Па | протактиний | 231.035 88 (1) | 231,04 | 231,04 | 2017 г. | |
| 92 | U | уран | 238,028 91 (3) | 238,03 | 238,03 | 1999 г. | |
| 93 | Np | нептуний | - | - | |||
| 94 | Пу | плутоний | - | - | |||
| 95 | Являюсь | америций | - | - | |||
| 96 | См | кюрий | - | - | |||
| 97 | Bk | берклий | - | - | |||
| 98 | Cf | калифорний | - | - | |||
| 99 | Es | эйнштейний | - | - | |||
| 100 | FM | фермий | - | - | |||
| 101 | Мкр | менделевий | - | - | |||
| 102 | Нет | нобелий | - | - | |||
| 103 | Lr | лоуренсий | - | - | |||
| 104 | Rf | резерфорд | - | - | |||
| 105 | Db | дубний | - | - | |||
| 106 | Sg | сиборгий | - | - | |||
| 107 | Bh | бориум | - | - | |||
| 108 | Hs | хасиум | - | - | |||
| 109 | Mt | мейтнерий | - | - | |||
| 110 | Ds | Дармштадтиум | - | - | |||
| 111 | Rg | рентгений | - | - | |||
| 112 | Cn | Copernicium | - | - | |||
| 113 | Nh | нихоний | - | - | |||
| 114 | Fl | флеровий | - | - | |||
| 115 | Mc | москва | - | - | |||
| 116 | Lv | ливерморий | - | - | |||
| 117 | Ц | Tennessine | - | - | |||
| 118 | Og | Оганессон | - | - | |||
- ^ ( Этот список: )CIAAW может публиковать изменения атомных весов (включая их точность и производные значения). Начиная с 1947 года, любое обновление происходит номинально в нечетные годы; фактическая дата публикации может быть позже.
- 2009 (вводим интервальные обозначения; Ge):
- «Атомный вес элементов 2009 (Технический отчет IUPAC)». Pure Appl. Chem . 83 (2): 359–396. 12 декабря 2010 г. doi : 10.1351 / PAC-REP-10-09-14 .
- 2011 г. (интервал для Br, Mg):
- «Атомный вес элементов 2011 (Технический отчет IUPAC)». Pure Appl. Chem . 85 (5): 1047–1078. 29 апреля 2013 г. doi : 10.1351 / PAC-REP-13-03-02 .
- 2013 (все элементы перечислены):
- Мейя, Юрис; и другие. (2016). «Атомный вес элементов 2013 (Технический отчет IUPAC)» . Чистая и прикладная химия . 88 (3): 265–91. DOI : 10,1515 / пак-2015-0305 .
- 2015 г. (иттербий изменен):
- «Стандартный атомный вес иттербия пересмотрен». Chemistry International . 37 (5–6): 26. Октябрь 2015 г. doi : 10.1515 / ci-2015-0512 . eISSN 0193-6484 . ISSN 0193-6484 .
- 2017 (изменено 14 значений):
- «Стандартные атомные веса 14 химических элементов пересмотрены» . CIAAW. 2018-06-05.
- 2019 г. (стоимость гафния изменена): Мейя, Юрис; и другие. (2019-12-09). «Стандартный атомный вес гафния пересмотрен» . CIAAW . Проверено 25 февраля 2020 .
Об обработке неопределенности значений, включая значения диапазона []:
- Поссоло, Антонио; ван дер Вин, Adriaan MH; Мейя, Юрис; и другие. (4 января 2018 г.). «Интерпретация и распространение неопределенности стандартных атомных весов (Технический отчет IUPAC)» . DOI : 10,1515 / пак-2016-0402 . Дата обращения 20 окт 2020 .
В периодической таблице [ править ]
| Группа | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Водород и щелочные металлы | Щелочноземельные металлы | Пниктогены | Халькогены | Галогены | Благородные газы | ||||||||||||||
| Период 1 | Водород1ЧАСВзаимодействие с другими людьми1,008 | Гелий2ОнВзаимодействие с другими людьми4,0026 | |||||||||||||||||
| 2 | Литий3ЛиВзаимодействие с другими людьми6,94 | Бериллий4БытьВзаимодействие с другими людьми9,0122 | Бор5BВзаимодействие с другими людьми10,81 | Углерод6CВзаимодействие с другими людьми12,011 | Азот7NВзаимодействие с другими людьми14.007 | Кислород8ОВзаимодействие с другими людьми15,999 | Фтор9FВзаимодействие с другими людьми18,998 | Неон10NeВзаимодействие с другими людьми20,180 | |||||||||||
| 3 | Натрий11NaВзаимодействие с другими людьми22,990 | Магний12MgВзаимодействие с другими людьми24.305 | Алюминий13AlВзаимодействие с другими людьми26,982 | Кремний14SiВзаимодействие с другими людьми28,085 | Фосфор15пВзаимодействие с другими людьми30 974 | Сера16SВзаимодействие с другими людьми32.06 | Хлор17ClВзаимодействие с другими людьми35,45 | Аргон18ArВзаимодействие с другими людьми39,95 | |||||||||||
| 4 | Калий19KВзаимодействие с другими людьми39,098 | Кальций20CaВзаимодействие с другими людьми40,078 | Скандий21 годScВзаимодействие с другими людьми44,956 | Титан22TiВзаимодействие с другими людьми47,867 | Ванадий23VВзаимодействие с другими людьми50,942 | Хром24CrВзаимодействие с другими людьми51,996 | Марганец25MnВзаимодействие с другими людьми54,938 | Утюг26FeВзаимодействие с другими людьми55,845 | Кобальт27CoВзаимодействие с другими людьми58,933 | Никель28NiВзаимодействие с другими людьми58,693 | Медь29CuВзаимодействие с другими людьми63,546 | Цинк30ZnВзаимодействие с другими людьми65,38 | Галлий31 годGaВзаимодействие с другими людьми69,723 | Германий32GeВзаимодействие с другими людьми72,630 | Мышьяк33В качествеВзаимодействие с другими людьми74,922 | Селен34SeВзаимодействие с другими людьми78,971 | Бром35 годBrВзаимодействие с другими людьми79,904 | Криптон36KrВзаимодействие с другими людьми83,798 | |
| 5 | Рубидий37Руб.Взаимодействие с другими людьми85,468 | Стронций38SrВзаимодействие с другими людьми87,62 | Иттрий39YВзаимодействие с другими людьми88,906 | Цирконий40ZrВзаимодействие с другими людьми91,224 | Ниобий41 годNbВзаимодействие с другими людьми92,906 | Молибден42ПнВзаимодействие с другими людьми95,95 | Технеций43Tc[97] | Рутений44RUВзаимодействие с другими людьми101,07 | Родий45RhВзаимодействие с другими людьми102,91 | Палладий46PdВзаимодействие с другими людьми106,42 | Серебро47AgВзаимодействие с другими людьми107,87 | Кадмий48CDВзаимодействие с другими людьми112,41 | Индий49ВВзаимодействие с другими людьми114,82 | Банка50SnВзаимодействие с другими людьми118,71 | Сурьма51SbВзаимодействие с другими людьми121,76 | Теллур52TeВзаимодействие с другими людьми127,60 | Йод53яВзаимодействие с другими людьми126,90 | Ксенон54XeВзаимодействие с другими людьми131,29 | |
| 6 | Цезий55CSВзаимодействие с другими людьми132,91 | Барий56БаВзаимодействие с другими людьми137,33 | Лютеций71ЛуВзаимодействие с другими людьми174,97 | Гафний72HfВзаимодействие с другими людьми178,49 | Тантал73ТаВзаимодействие с другими людьми180,95 | Вольфрам74WВзаимодействие с другими людьми183,84 | Рений75ReВзаимодействие с другими людьми186,21 | Осмий76Операционные системыВзаимодействие с другими людьми190,23 | Иридий77IrВзаимодействие с другими людьми192,22 | Платина78PtВзаимодействие с другими людьми195,08 | Золото79AuВзаимодействие с другими людьми196,97 | Меркурий80HgВзаимодействие с другими людьми200,59 | Таллий81 годTlВзаимодействие с другими людьми204,38 | Вести82PbВзаимодействие с другими людьми207,2 | Висмут83БиВзаимодействие с другими людьми208,98 | Полоний84По[209] | Астатин85В[210] | Радон86Rn[222] | |
| 7 | Франций87Пт[223] | Радий88Ра[226] | Лоуренсий103Lr[266] | Резерфордий104Rf[267] | Дубний105Db[268] | Сиборгий106Sg[269] | Бориум107Bh[270] | Калий108Hs[269] | Мейтнерий109Mt[278] | Дармштадтиум110Ds[281] | Рентгений111Rg[282] | Копернициум112Cn[285] | Nihonium113Nh[286] | Флеровий114Fl[289] | Московиум115Mc[290] | Ливерморий116Lv[293] | Tennessine117Ц[294] | Оганессон118Og[294] | |
| Лантан57ЛаВзаимодействие с другими людьми138,91 | Церий58CeВзаимодействие с другими людьми140,12 | Празеодим59PrВзаимодействие с другими людьми140,91 | Неодим60NdВзаимодействие с другими людьми144,24 | Прометий61Вечера[145] | Самарий62СмВзаимодействие с другими людьми150,36 | Европий63ЕвропаВзаимодействие с другими людьми151,96 | Гадолиний64Б-гВзаимодействие с другими людьми157,25 | Тербий65TbВзаимодействие с другими людьми158,93 | Диспрозий66DyВзаимодействие с другими людьми162,50 | Гольмий67ХоВзаимодействие с другими людьми164,93 | Эрбий68ЭВзаимодействие с другими людьми167,26 | Тулий69ТмВзаимодействие с другими людьми168,93 | Иттербий70YbВзаимодействие с другими людьми173,05 | ||||||
| Актиний89Ac[227] | Торий90ЧтВзаимодействие с другими людьми232,04 | Протактиний91ПаВзаимодействие с другими людьми231,04 | Уран92UВзаимодействие с другими людьми238,03 | Нептуний93Np[237] | Плутоний94Пу[244] | Америций95Являюсь[243] | Кюрий96См[247] | Берклиум97Bk[247] | Калифорний98Cf[251] | Эйнштейний99Es[252] | Фермий100FM[257] | Менделевий101Мкр[258] | Нобелий102Нет[259] | ||||||
- Ca: 40.078 - Формальное краткое значение, округленное (без неопределенности) [24]
- Po: [209] - массовое число наиболее стабильного изотопа
| s-блок | f-блок | d-блок | p-блок |
См. Также [ править ]
- Международный союз чистой и прикладной химии (IUPAC)
- Комиссия по изотопному содержанию и атомным весам
Ссылки [ править ]
- ^ a b c Мейя, Юрис; и другие. (2016). «Атомный вес элементов 2013 (Технический отчет IUPAC)» . Чистая и прикладная химия . 88 (3): 265–91. DOI : 10,1515 / пак-2015-0305 .
- ^ a b "Золотая книга ИЮПАК" . Сборник химической терминологии . Проверено 12 июля 2019 .
стандартные атомные веса: рекомендуемые значения относительных атомных масс элементов, пересматриваемые раз в два года Комиссией ИЮПАК по атомным весам и изотопному содержанию и применимые к элементам в любом нормальном образце с высоким уровнем достоверности. Нормальный образец представляет собой любой разумно возможный источник элемента или его соединений в торговле для промышленности и науки и не подвергался значительным изменениям изотопного состава в течение короткого с геологической точки зрения периода.
- Перейти ↑ Wieser, M. E (2006). «Атомный вес элементов 2005 (Технический отчет IUPAC)» (PDF) . Чистая и прикладная химия . 78 (11): 2051–2066. DOI : 10,1351 / pac200678112051 . S2CID 94552853 .
- ^ Lodders, К. (2008). «Содержание солнечного аргона». Астрофизический журнал . 674 (1): 607–611. arXiv : 0710.4523 . Bibcode : 2008ApJ ... 674..607L . DOI : 10.1086 / 524725 . S2CID 59150678 .
- ^ Кэмерон, AGW (1973). «Содержание элементарных и изотопных летучих элементов на внешних планетах». Обзоры космической науки . 14 (3–4): 392–400. Bibcode : 1973SSRv ... 14..392C . DOI : 10.1007 / BF00214750 . S2CID 119861943 .
- ^ Это можно определить по приведенным выше цифрам согласно определению атомного веса и WP: CALC
- ^ «Атомные веса и изотопные составы для всех элементов» . Национальный институт стандартов и технологий .
- ^ a b Wapstra, AH; Audi, G .; Тибо, К. (2003), Оценка атомной массы AME2003 (онлайн-редактор), Национальный центр ядерных данных. По материалам:
- Wapstra, AH; Audi, G .; Тибо, К. (2003), "Оценка атомной массы AME2003 (I)", ядерная физика , 729 : 129-336, Bibcode : 2003NuPhA.729..129W , DOI : 10.1016 / j.nuclphysa.2003.11.002
- Audi, G .; Wapstra, AH; Тибо, К. (2003), "Оценка атомной массы AME2003 (II)", ядерная физика , 729 : 337-676, Bibcode : 2003NuPhA.729..337A , DOI : 10.1016 / j.nuclphysa.2003.11.003
- ^ а б Росман, KJR; Тейлор, PDP (1998), "изотопные составы элементов 1997" (PDF) , теоретической и прикладной химии , 70 (1): 217-35, DOI : 10,1351 / pac199870010217
- ^ Коплен, ТБ; и другие. (2002), "изотопная Вариация выбранных элементов" (PDF) , теоретическая и прикладная химия , 74 (10): 1987-2017, DOI : 10,1351 / pac200274101987
- ^ Мейджа, Юрис; Местер, Золтан (2008). «Распространение неопределенности результатов измерения атомной массы» . Метрология . 45 (1): 53–62. Bibcode : 2008Metro..45 ... 53M . DOI : 10.1088 / 0026-1394 / 45/1/008 .
- ^ Холден, Норман Э. (2004). «Атомный вес и Международный комитет - исторический обзор» . Chemistry International . 26 (1): 4–7.
- ^ «ИЮПАК - Международный союз чистой и прикладной химии: атомные веса десяти химических элементов вот-вот изменятся» .
- ^ а б де Бьевр, Поль; Пайзер, Х. Штеффен (1992). " ' Атомный вес' - Имя, его история, определение и Units" (PDF) . Чистая и прикладная химия . 64 (10): 1535–43. DOI : 10,1351 / pac199264101535 .
- ^ Дальтон, Джон (1808). Новая система химической философии . Манчестер.
- ^ a b «Стандартный атомный вес 2015» . Комиссия по изотопному содержанию и атомным весам . 12 октября 2015 . Проверено 18 февраля +2017 .
- ^ a b Meija 2016 , таблица 1.
- ^ "Стандартные атомные веса 14 химических элементов пересмотрены" . CIAAW . 2018-06-05 . Проверено 2 февраля 2019 .
- ^ "Стандартные атомные веса 14 химических элементов пересмотрены" . Chemistry International . 40 (4): 23–24. 2018. DOI : 10,1515 / CI-2018-0409 . ISSN 0193-6484 .
- ^ a b Meija 2016 , таблица 2.
- ^ a b Meija 2016 , таблица 3.
- ^ a b Meija 2016 , таблицы 2 и 3.
- ^ "Периодическая таблица элементов и изотопов ИЮПАК" . Королевский центр визуализации в науке . ИЮПАК, Королевский центр визуализации в науке . Дата обращения 8 октября 2019 .
- ^ Мейджа, Юрис; и другие. (2016). «Атомный вес элементов 2013 (Технический отчет IUPAC)» . Чистая и прикладная химия . 88 (3). Стол 2, 3 вместе; неуверенность устранена. DOI : 10,1515 / пак-2015-0305 .
Внешние ссылки [ править ]
- Комиссия ИЮПАК по изотопному содержанию и атомным весам
- Атомный вес элементов 2011
