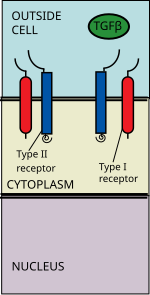
Трансформирующий фактор роста бета (TGFb) сигнальный путь участвует во многих клеточных процессах , как в организме взрослого и развивающегося эмбриона в том числе роста клеток , дифференциации клеток , апоптоза , клеточного гомеостаза и других клеточных функций. Несмотря на широкий спектр клеточных процессов, которые регулирует сигнальный путь TGFβ, этот процесс относительно прост. Лиганды суперсемейства TGFβ связываются с рецептором типа II, который рекрутирует и фосфорилирует рецептор типа I. Рецептор типа I затем фосфорилирует регулируемые рецептором SMAD ( R-SMAD ), которые теперь могут связывать coSMAD SMAD4.. Комплексы R-SMAD / coSMAD накапливаются в ядре, где они действуют как факторы транскрипции и участвуют в регуляции экспрессии целевого гена.
Механизм [ править ]
Связывание лиганда [ править ]
TGF беты - суперсемейство лигандов включает: Костные морфогенетические белки (ВМР) , рост и факторы дифференцировки (GDFS) , антимюллер гормона (АМГ) , активин , Узловое и TGF - beta «ы. [1] Передача сигналов начинается со связывания лиганда суперсемейства TGF beta с рецептором TGF beta типа II. Рецептора типа II представляет собой серин / треонин киназа рецептора, который катализирует на фосфорилирование рецептора типа I. Каждый класс лигандов связывается со специфическим рецептором типа II. [2] У млекопитающих известно семь рецепторов типа I и пять рецепторов типа II. [3]
Существует три активина: активин A , активин B и активин AB . Активины участвуют в эмбриогенезе и остеогенезе. Они также регулируют многие гормоны, включая гормоны гипофиза , гонад и гипоталамуса, а также инсулин . Они также являются факторами выживания нервных клеток .
BMP связываются с рецептором морфогенетического белка кости типа 2 (BMPR2). Они участвуют во множестве клеточных функций, включая остеогенез, дифференцировку клеток , спецификацию передней / задней оси, рост и гомеостаз.
Семейство TGFβ включает: TGFβ1 , TGFβ2 , TGFβ3 . Подобно BMP, бета TGF участвуют в эмбриогенезе и дифференцировке клеток, но они также участвуют в апоптозе, а также в других функциях. Они связываются с рецептором TGF-бета типа 2 (TGFBR2).
Nodal связывается с рецептором активина A типа IIB ACVR2B . Затем он может образовывать рецепторный комплекс с рецептором активина A типа IB ( ACVR1B ) или с рецептором активина A типа IC ( ACVR1C ). [3]
Когда связывание рецептор-лиганд происходит посредством местного действия, это классифицируется как паракринная передача сигналов .
Рекрутирование и фосфорилирование рецепторов [ править ]
Бета-лиганд TGF связывается с димером рецептора типа II, который рекрутирует димер рецептора типа I, образуя гетеротетрамерный комплекс с лигандом. [4] Эти рецепторы представляют собой рецепторы серин / треонинкиназы . Они имеют внеклеточный домен , богатый цистеином , трансмембранный домен и цитоплазматический домен, богатый серином / треонином. Домена Г.С. рецептора типа I состоит из ряда около тридцать серина - глицин повторов. [5]Связывание лиганда семейства бета-TGF вызывает вращение рецепторов, так что их цитоплазматические киназные домены располагаются в каталитически благоприятной ориентации. Рецептор типа II фосфорилирует остатки серина рецептора типа I, который активирует белок.
Фосфорилирование SMAD [ править ]
Существует пять SMAD, регулируемых рецепторами: SMAD1 , SMAD2 , SMAD3 , SMAD5 и SMAD9 (иногда называемые SMAD8). По существу, существует два внутриклеточных пути с участием этих R-SMAD . TGF бета, активины, узлы и некоторые GDF опосредуются SMAD2 и SMAD3, тогда как BMP, AMH и некоторые GDF опосредуются SMAD1 , SMAD5 и SMAD9.. Связывание R-SMAD с рецептором типа I опосредуется белком, содержащим домен FYVE с цинковыми двойными пальцами. Два таких белка, которые опосредуют бета-путь TGF, включают SARA (якорь SMAD для активации рецептора) и HGS (субстрат тирозинкиназы, регулируемый фактором роста гепатоцитов).
SARA присутствует в ранней эндосоме, которая посредством клатрин-опосредованного эндоцитоза интернализует рецепторный комплекс. [6] SARA нанимает R-SMAD . SARA позволяет связывать R-SMAD с областью L45 рецептора типа I. [7] SARA ориентирует R-SMAD таким образом, что остаток серина на его С-конце обращен к каталитической области рецептора типа I. Рецептор I типа фосфорилирует сериновый остаток R-SMAD. Фосфорилирование вызывает конформационные изменения в домене MH2 R-SMAD и его последующую диссоциацию от рецепторного комплекса и SARA. [8]
Привязка CoSMAD [ править ]
Фосфорилированный RSMAD имеет высокое сродство к coSMAD (например, SMAD4 ) и образует с ним комплекс. Фосфатная группа не действует как стыковочный сайт для coSMAD, скорее, фосфорилирование открывает аминокислотный участок, позволяющий взаимодействовать.
Транскрипция [ править ]
Фосфорилированный комплекс RSMAD / coSMAD входит в ядро, где он связывает промоторы / кофакторы транскрипции и вызывает транскрипцию ДНК.
Костные морфогенетические белки вызывают транскрипцию мРНК, участвующих в остеогенезе , нейрогенезе и спецификации вентральной мезодермы .
TGF-бета вызывают транскрипцию мРНК, участвующих в апоптозе , регенерации внеклеточного матрикса и иммуносупрессии . Он также участвует в остановке G1 в клеточном цикле .
Активин вызывает транскрипцию мРНК, участвующих в росте гонад , дифференцировке эмбрионов и формировании плаценты.
Nodal вызывает транскрипцию мРНК, участвующих в спецификации левой и правой оси, индукции мезодермы и энтодермы .
Регуляция пути [ править ]
Путь передачи сигналов TGF beta участвует в широком спектре клеточных процессов и, следовательно, очень сильно регулируется. Существует множество механизмов, при которых этот путь модулируется либо положительно, либо отрицательно: существуют агонисты лигандов и R-SMAD; есть рецепторы-ловушки; и R-SMAD и рецепторы убиквитинируются .
Агонисты / антагонисты лигандов [ править ]
И хордин, и ноггин являются антагонистами BMP. Они связывают BMP, предотвращая связывание лиганда с рецептором. [9] Было продемонстрировано, что Chordin и Noggin обеспечивают дорсализацию мезодермы . Оба они находятся в дорсальной губе Xenopus и превращают ткань, специфичную для эпидермиса, в нервную ткань (см. Нейруляцию ). Noggin играет ключевую роль в формировании хрящевой и костной ткани. Мыши Noggin - / - имеют избыточный хрящ и не имеют суставов. [9]
Члены семейства белков DAN также противодействуют членам семейства бета-TGF. В их число входят Цербер , ДАН и Гремлин . Эти белки содержат девять консервативных цистеинов, которые могут образовывать дисульфидные мостики. Считается, что DAN противодействует GDF5 , GDF6 и GDF7 .
Фоллистатин ингибирует активин , который он связывает. Он напрямую влияет на секрецию фолликулостимулирующего гормона (ФСГ). Фоллистатин также вовлечен в рак простаты, когда мутации в его гене могут препятствовать его действию на активин, который обладает антипролиферативными свойствами. [9]
Lefty является регулятором TGFβ и участвует в формировании осевого паттерна во время эмбриогенеза. Он также является членом суперсемейства белков TGF. Он асимметрично экспрессируется в левой части мышиных эмбрионов и впоследствии играет роль в спецификации слева-справа. Левти действует, предотвращая фосфорилирование R-SMAD. Это происходит через конститутивно активный рецептор TGFβ типа I и через процесс, следующий за его активацией. [10]
Также были идентифицированы антагонисты на основе лекарственных средств, такие как SB431542 [11], который избирательно ингибирует ALK4, ALK5 и ALK7.
Рецепторная регуляция [ править ]
Рецептор фактора роста трансформирующего 3 (TGFBR3) является наиболее распространенным из ТФР-бета рецепторов тем не менее, [12] оно не известно сигнализации домена. [13] Однако это может служить для усиления связывания бета-лигандов TGF с рецепторами TGF бета типа II путем связывания TGFβ и представления его TGFBR2. Одна из нижестоящих мишеней передачи сигналов TGFβ , GIPC , связывается с его доменом PDZ, который предотвращает его протеосомную деградацию, что впоследствии увеличивает активность TGFβ. Он также может служить корецептором ингибина ActivinRII . [9]
BMP и активин, связанный с мембраной ингибитор (BAMBI), имеет такой же внеклеточный домен, что и рецепторы типа I. В нем отсутствует внутриклеточный домен серин / треониновой протеинкиназы и, следовательно, он является псевдорецептором. Он связывается с рецептором типа I, предотвращая его активацию. Он служит негативным регулятором передачи сигналов TGF-бета и может ограничивать экспрессию tgf-бета во время эмбриогенеза. Для его экспрессии требуется передача сигналов BMP.
FKBP12 связывает GS-область рецептора типа I, предотвращая фосфорилирование рецептора рецепторами типа II. Считается, что FKBP12 и его гомологи помогают предотвратить активацию рецептора типа I в отсутствие лигандов, поскольку связывание лиганда вызывает его диссоциацию.
Регламент R-SMAD [ править ]
Роль тормозных SMAD [ править ]
Есть два других SMAD, которые дополняют семейство SMAD, тормозящие SMAD (I-SMADS), SMAD6 и SMAD7 . Они играют ключевую роль в регуляции передачи сигналов TGF beta и участвуют в отрицательной обратной связи. Как и другие SMAD, у них есть домен MH1 и MH2. SMAD7 конкурирует с другими R-SMAD с рецептором типа I и предотвращает их фосфорилирование. [9] [14] Он находится в ядре и после активации бета-рецептора TGF перемещается в цитоплазму, где связывается с рецептором типа I. SMAD6 связывает SMAD4, предотвращая связывание других R-SMAD с coSMAD. Уровни I-SMAD увеличиваются с передачей сигналов TGF-beta, что позволяет предположить, что они являются нижележащими мишенями передачи сигналов TGF-beta.
Убиквитинирование R-SMAD [ править ]
Убиквитин-протеиновые лигазы E3 SMURF1 и SMURF2 регулируют уровни SMAD. Они принимают убиквитин от фермента, конъюгированного с E2, где они переносят убиквитин в RSMAD, что вызывает их убиквитинирование и последующую протеосомную деградацию. SMURF1 связывается с SMAD1 и SMAD5, тогда как SMURF2 связывает SMAD1 , SMAD2 , SMAD3 , SMAD6 и SMAD7 . Он [ необходимо пояснение ] усиливает ингибирующее действие SMAD7 при одновременном снижении транскрипционной активности SMAD2.
Сводная таблица [ править ]
Лиганды TGF-β H.sapiens выделены серым цветом, лиганды D.melanogaster - розовым, C.elegans - желтым.
| Лиганд суперсемейства TGF-β | Ингибиторы лигандов | Рецептор II типа | Рецептор I типа | R-SMAD | coSMAD | I-SMAD |
|---|---|---|---|---|---|---|
| Активин А | Фоллистатин | ACVR2A | ACVR1B (ALK4) | SMAD2 , SMAD3 | SMAD4 | SMAD7 |
| GDF1 | ACVR2A | ACVR1B (ALK4) | SMAD2 , SMAD3 | SMAD4 | SMAD7 | |
| GDF11 | ACVR2B | ACVR1B (ALK4), TGFβRI (ALK5) | SMAD2 , SMAD3 | SMAD4 | SMAD7 | |
| БМП2-8 | Ноггин , Чордин , ДАН | BMPR2 | BMPR1A (ALK3), BMPR1B (ALK6) | SMAD1 SMAD5 , SMAD8 | SMAD4 | SMAD6 , SMAD7 |
| Узловой | Левша | ACVR2B | ACVR1B (ALK4), ACVR1C (ALK7) | SMAD2 , SMAD3 | SMAD4 | SMAD7 |
| TGFβs | LTBP1 , THBS1 , Декорин | TGFβRII | TGFβRI (ALK5) | SMAD2 , SMAD3 | SMAD4 | SMAD7 |
| Dpp | Пунт | ТКВ | Безумный | Медея | ||
| Винт | Пунт | Саксофон | Безумный | Медея | ||
| миоглианин | Остроумие | Бабуин | dSmad2 | Медея | ||
| дАктивин | Остроумие , Пунт | Бабуин | dSmad2 | Медея | ||
| Gbb | Остроумие , Пунт | Tkv , саксофон | Безумный | Медея | ||
| Даф-7 | Даф-4 | Даф-1 | Даф-8 , Даф-14 | Даф-3 | ||
| Дбл-1 | Даф-4 | СМА-6 | СМА-2 , СМА-3 , СМА-4 | СМА-4 |
Внешние ссылки [ править ]
- Киотская энциклопедия генов и геномов - карта сигнальных путей TGF beta
- Netpath - тщательно подобранный ресурс путей передачи сигналов у людей.
Ссылки [ править ]
- ^ "Проспект Документация PDOC00223" . Архивировано из оригинала на 2011-05-25 . Проверено 1 июля 2006 .
- Перейти ↑ Alberts B, Johnson A, Lewis J, Raff M, Roberts K, Walter P (2002). Молекулярная биология клетки . Нью-Йорк, штат Нью-Йорк: Наука о гирляндах. ISBN 978-0-8153-3218-3.
- ^ a b Munir S, Xu G, Wu Y, Yang B, Lala PK, Peng C (июль 2004 г.). «Nodal и ALK7 ингибируют пролиферацию и индуцируют апоптоз в клетках трофобласта человека» . Журнал биологической химии . 279 (30): 31277–86. DOI : 10.1074 / jbc.M400641200 . PMID 15150278 .
- ^ Wrana JL, Attisano L, Cárcamo J, Zentella A, Doody J, Laiho M и др. (Декабрь 1992 г.). «Бета-сигналы TGF через комплекс рецепторов гетеромерной протеинкиназы». Cell . 71 (6): 1003–14. DOI : 10.1016 / 0092-8674 (92) 90395-S . PMID 1333888 .
- ^ "Запись Pfam TGF_beta_GS" . Проверено 1 июля 2006 .
- ^ Раньян CE, Schnaper HW, Понселе AC (март 2005). «Роль интернализации в трансформирующей индуцированной фактором роста бета1 ассоциации Smad2 с якорем Smad для активации рецептора (SARA) и Smad2-зависимой передачи сигналов в мезангиальных клетках человека» . Журнал биологической химии . 280 (9): 8300–8. DOI : 10.1074 / jbc.M407939200 . PMID 15613484 .
- ^ Моустакас A (сентябрь 2002). «Смад сигнальная сеть» . Журнал клеточной науки . 115 (Pt 17): 3355–6. PMID 12154066 .
- ^ Souchelnytskyi S, Rönnstrand л, Heldin СН, десять Дэки P (2001). «Фосфорилирование сигнальных белков Smad рецепторными серин / треонинкиназами». Протоколы протеинкиназ . Методы молекулярной биологии. 124 . С. 107–20. DOI : 10.1385 / 1-59259-059-4: 107 . ISBN 1-59259-059-4. PMID 11100470 .
- ^ Б с д е Массага Дж, Чен YG (март 2000 г.). «Контроль передачи сигналов TGF-бета» . Гены и развитие . 14 (6): 627–44. PMID 10733523 .
- ^ Ulloa L, Tabibzadeh S (июнь 2001). «Левша ингибирует регулируемое рецептором фосфорилирование Smad, индуцированное активированным рецептором трансформирующего фактора роста-бета» . Журнал биологической химии . 276 (24): 21397–404. DOI : 10.1074 / jbc.M010783200 . PMID 11278746 .
- ^ Laping NJ, Grygielko E, Mathur A, Butter S, Bomberger J, Tweed C и др. (Июль 2002 г.). «Ингибирование индуцированного трансформирующим фактором роста (TGF) -бета1 внеклеточного матрикса новым ингибитором киназной активности рецептора TGF-бета типа I: SB-431542». Молекулярная фармакология . 62 (1): 58–64. DOI : 10.1124 / mol.62.1.58 . PMID 12065755 .
- ^ Blobe GC, Лю X, Fang SJ, как T, Лодиш HF (октябрь 2001). «Новый механизм регуляции передачи сигналов трансформирующего фактора роста бета (TGF-бета). Функциональная модуляция экспрессии рецептора TGF-бета типа III посредством взаимодействия с белком домена PDZ, GIPC» . Журнал биологической химии . 276 (43): 39608–17. DOI : 10.1074 / jbc.M106831200 . PMID 11546783 .
- ^ Интернет Менделирующее наследование в человеке (OMIM): ТРАНСФОРМАЦИЯ ФАКТОРА РОСТА-БЕТА-РЕЦЕПТОРА, ТИП III; TGFBR3 - 600742
- ^ Ито Р, Asao Н, Sugamura К, Heldin СН, десять Дэйк P, S Ито (август 2001 г.). «Содействие передаче сигналов костного морфогенетического белка посредством отрицательной регуляции ингибирующих Smads» . Журнал EMBO . 20 (15): 4132–42. DOI : 10.1093 / emboj / 20.15.4132 . PMC 149146 . PMID 11483516 .