Эта статья может быть дополнена текстом, переведенным из соответствующей статьи на немецком языке . (Ноябрь 2012 г.) Щелкните [показать], чтобы просмотреть важные инструкции по переводу.
|
 | |
 | |
 | |
| Имена | |
|---|---|
| Имена ИЮПАК Гексафторид урана Фторид урана (VI) | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ЧЭБИ | |
| ChemSpider | |
| ECHA InfoCard | 100.029.116 |
PubChem CID | |
| Номер RTECS |
|
| UNII | |
| Номер ООН | 2978 (<1% 235 U) 2977 (> 1% 235 U) |
CompTox Dashboard ( EPA ) | |
| |
| |
| Характеристики | |
| UF 6 | |
| Молярная масса | 352,02 г / моль |
| Внешность | Бесцветное твердое вещество |
| Плотность | 5,09 г / см 3 , твердый |
| Температура плавления | 56,5 ° C (133,7 ° F, 329,6 K) (возгоняется, при атмосферном давлении) |
| Гидролизует | |
| Растворимость |
|
| Структура | |
| Ромбическая , oP28 | |
Космическая группа | ПНМА, № 62 |
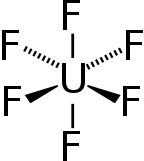
Координационная геометрия | Октаэдрический ( O h ) |
Дипольный момент | 0 |
| Термохимия | |
Стандартная мольная энтропия ( S |
|
Std энтальпия формации (Δ F H ⦵ 298 ) |
|
| Опасности | |
| Паспорт безопасности | ICSC 1250 |
Классификация ЕС (DSD) (устарела) | Т + (Т +) N (N) |
| R-фразы (устаревшие) | R26 / 28 , R33 , R51 / 53 |
| S-фразы (устарели) | (S1 / 2) , S20 / 21 , S45 , S61 |
| NFPA 704 (огненный алмаз) |  0 4 2 W OX |
| точка возгорания | Негорючий |
| Родственные соединения | |
Другие анионы | Гексахлорид урана |
Другие катионы | Гексафторид нептуния Гексафторид плутония |
Родственные фториды урана | Фторид урана (III) Фторид урана (IV) Фторид урана (V) |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Гексафторид урана ( U F 6 ), широко известный в ядерной промышленности как « шестигранник », представляет собой соединение, используемое в процессе обогащения урана , из которого производится топливо для ядерных реакторов и ядерного оружия .
Hex образует твердые серые кристаллы при стандартной температуре и давлении , очень токсичен, реагирует с водой и вызывает коррозию большинства металлов. Соединение мягко реагирует с алюминием , образуя тонкий поверхностный слой AlF 3, который сопротивляется любой дальнейшей реакции соединения.
Подготовка [ править ]
Измельченная урановая руда - U 3 O 8 или « желтый кек » - растворяется в азотной кислоте , давая раствор уранилнитрата UO 2 (NO 3 ) 2 . Чистый уранилнитрат получают экстракцией растворителем , затем обрабатывают аммиаком для получения диураната аммония («ADU», (NH 4 ) 2 U 2 O 7 ). Восстановление водородом дает UO 2 , который превращается с плавиковой кислотой (HF) в тетрафторид урана., UF 4 . Окисление фтором дает UF 6 .
Во время ядерной переработки уран реагирует с трифторидом хлора с образованием UF 6 :
- U + 2 ClF 3 → UF 6 + Cl 2
Свойства [ править ]
Физические свойства [ править ]
При атмосферном давлении он сублимируется при 56,5 ° C. [3]
Структура твердого тела была определена методом нейтронографии при 77 К и 293 К. [4] [5]
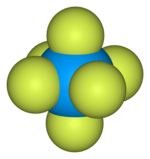
Шаровидная модель элементарной ячейки гексафторида урана [6]
Длины и углы связи газообразного гексафторида урана [7]
Химические свойства [ править ]
Было показано, что гексафторид урана является окислителем [8] и кислотой Льюиса , способной связываться с фторидом ; например, сообщается , что реакция фторида меди (II) с гексафторидом урана в ацетонитриле приводит к образованию гептафторураната (VI) меди (II), Cu (UF 7 ) 2 . [9]
Полимерные фториды урана (VI), содержащие органические катионы, были выделены и охарактеризованы методом рентгеновской дифракции. [10]
Применение в ядерном топливном цикле [ править ]
UF 6 используется в обоих основных методах обогащения урана - газовой диффузии и методе газовой центрифуги - потому что его тройная точка находится при температуре 64,05 ° C (147 ° F, 337 K) и лишь немного выше нормального атмосферного давления. У фтора есть только один встречающийся в природе стабильный изотоп, поэтому изотопологи UF 6 различаются по своей молекулярной массе только в зависимости от присутствующего изотопа урана . [11]
Все остальные фториды урана представляют собой нелетучие твердые вещества, являющиеся координационными полимерами .
Газовая диффузия требует примерно в 60 раз больше энергии, чем процесс газовой центрифуги: ядерное топливо, полученное путем газовой диффузии, производит в 25 раз больше энергии, чем используется в процессе диффузии, в то время как топливо, произведенное на центрифуге, производит в 1500 раз больше энергии, чем используется в центрифуге. процесс.
Помимо использования при обогащении, гексафторид урана использовался в усовершенствованном методе переработки ( летучесть фторида ), который был разработан в Чешской Республике . В этом процессе использованное оксидное ядерное топливо обрабатывают газообразным фтором с образованием смеси фторидов. Затем эту смесь перегоняют для разделения материалов различных классов.
При обогащении урана образуются большие количества обедненного гексафторида урана , или DUF 6 , в качестве отходов. Длительное хранение DUF 6 представляет опасность для окружающей среды, здоровья и безопасности из-за его химической нестабильности. Когда UF 6 подвергается воздействию влажного воздуха, он реагирует с водой в воздухе с образованием UO 2 F 2 ( фторид уранила ) и HF ( фтористый водород ), оба из которых являются очень коррозионными и токсичными. В 2005 году 686 500 тонн DUF 6 было размещено в 57 122 резервуарах для хранения, расположенных недалеко от Портсмута, штат Огайо ; Ок-Ридж, Теннесси ; и Падука, Кентукки. [12] [13] Баллоны для хранения необходимо регулярно проверять на предмет коррозии и утечек. Расчетный срок службы стальных баллонов измеряется десятилетиями. [14]
В США произошло несколько аварий с участием гексафторида урана, в том числе авария с заполнением баллонов и выбросом материала на Sequoyah Fuels Corporation в 1986 году. [15] Правительство США преобразовало DUF 6 в твердые оксиды урана для утилизации. [16] Такое удаление всей DUF 6 инвентаризации может стоить от $ 15 млн до $ 450 миллионов долларов . [17]
Разрыв 14-тонного транспортировочного цилиндра UF 6 . 1 погиб, несколько десятков ранены. Выпущено ~ 29500 фунтов материала. Sequoyah Fuels Corporation 1986.
Склад DUF 6 издалека
Цилиндры DUF 6 : окрашенные (слева) и корродированные (справа)
Ссылки [ править ]
- ^ "Архивная копия" . Архивировано из оригинала на 2013-09-16 . Проверено 8 августа 2013 . CS1 maint: заархивированная копия как заголовок ( ссылка )
- ^ a b c d Джонсон, Джеральд К. (1979). «Энтальпия образования гексафторида урана». Журнал химической термодинамики . 11 (5): 483–490. DOI : 10.1016 / 0021-9614 (79) 90126-5 .
- ^ Brickwedde, Фердинанд G .; Hoge, Гарольд Дж .; Скотт, Рассел Б. (1948). «Низкотемпературная теплоемкость, энтальпии и энтропии UF 4 и UF 6 ». J. Chem. Phys. 16 (5): 429–436. DOI : 10.1063 / 1.1746914 .
- ^ JH Леви; Джон С. Тейлор; Пол Уилсон (1976). "Структура фторидов. Часть XII. Монокристаллическое нейтронографическое исследование гексафторида урана при 293 K". J. Chem. Soc., Dalton Trans. (3): 219–224. DOI : 10.1039 / DT9760000219 .
- ^ JH Леви, JC Тейлор и А.Б. Во (1983). «Структурные исследования нейтронного порошка UF 6 , MoF 6 и WF 6 при 77 K». Журнал химии фтора . 23 : 29–36. DOI : 10.1016 / S0022-1139 (00) 81276-2 .
- ^ JC Taylor, PW Wilson, JW Kelly: «Структуры фторидов. I. Отклонения от идеальной симметрии в структуре кристаллического UF 6 : нейтронографический анализ », Acta Crystallogr. , 1973 , B29 , стр. 7–12; doi : 10.1107 / S0567740873001895 .
- ^ Кимура, Масао; Шомакер, Вернер; Смит, Дарвин В .; Бернар (1968). «Электронно-дифракционное исследование гексафторидов вольфрама, осмия, иридия, урана, нептуния и плутония» . J. Chem. Phys. 48 (8): 4001–4012. DOI : 10.1063 / 1.1669727 .
- ^ GH Olah; Дж. Велч (1978). «Синтетические методы и реакции. 46. Окисление органических соединений гексафторидом урана в растворах галогеналканов». Варенье. Chem. Soc. 100 (17): 5396–5402. DOI : 10.1021 / ja00485a024 .
- ^ JA Берри; RT Poole; А. Прескотт; DWA Sharp; Дж. М. Уинфилд (1976). «Окислительные и акцепторные свойства фторид-иона гексафторида урана в ацетонитриле». J. Chem. Soc., Dalton Trans. (3): 272–274. DOI : 10.1039 / DT9760000272 .
- ^ С. М. Уокер; PS Halasyamani; С. Аллен; Д. О'Хара (1999). «От молекул к каркасам: переменная размерность в системе UO 2 (CH 3 COO) 2 · 2H 2 O / HF (водн.) / Пиперазин. Синтез, структуры и характеристика нуль-мерного (C 4 N 2 H 12 ) UO 2 F 4 · 3H 2 O, одномерный (C 4 N 2 H 12 ) 2 U 2 F 12 · H 2 O, двумерный (C 4 N 2 H 12) 2 (U 2 O 4 F 5 ) 4 · 11H 2 O и трехмерный (C 4 N 2 H 12 ) U 2 O 4 F 6 ". J. Am. Chem. Soc . 121 (45): 10513 -10521. дои : 10.1021 / ja992145f .
- ^ "Обогащение урана и процесс газовой диффузии" . USEC Inc. Архивировано из оригинала на 2007-10-19 . Проверено 24 сентября 2007 .
- ^ "Сколько обедненного гексафторида урана хранится в Соединенных Штатах?" . Часто задаваемые вопросы по обедненному UF 6 . Аргоннская национальная лаборатория .[ постоянная мертвая ссылка ]
- ^ Документы
- ^ "Что такое DUF 6 ? Опасен ли он и что с ним делать?" . Институт энергетики и экологических исследований. 2007-09-24.
- ^ "Были ли аварии с участием гексафторида урана?" . Часто задаваемые вопросы по обедненному UF 6 . Аргоннская национальная лаборатория. Архивировано из оригинала на 2017-06-09.
- ^ "Что произойдет с гексафторидом урана, хранящимся в Соединенных Штатах?" . Часто задаваемые вопросы по обедненному UF 6 . Аргоннская национальная лаборатория.[ постоянная мертвая ссылка ]
- ^ «Существуют ли какие-либо действующие в настоящее время установки для захоронения, которые могут принять весь обедненный оксид урана, который будет образован в результате конверсии запасов обедненного UF 6 Министерства энергетики США ?» . Часто задаваемые вопросы по обедненному UF 6 . Аргоннская национальная лаборатория.[ постоянная мертвая ссылка ]
Дальнейшее чтение [ править ]
- Gmelins Handbuch der anorganischen Chemie , System Nr. 55, Уран, Тейл А, стр. 121–123.
- Gmelins Handbuch der anorganischen Chemie , System Nr. 55, Уран, Тейл С 8, стр. 71–163.
- Р. ДеВитт: Гексафторид урана: Обзор физико-химических свойств , Технический отчет, GAT-280; Goodyear Atomic Corp., Портсмут, Огайо; 12. августа 1960 г .; DOI : 10.2172 / 4025868 .
- Ингмар Гренте, Януш Дроджиннски, Такео Фуджино, Эдгар К. Бак, Томас Э. Альбрехт-Шмитт , Стивен Ф. Вольф: Уран , в: Лестер Р. Морсс, Норман М. Эдельштейн, Жан Фугер (Hrsg.): Химия элементы актинида и трансактинида , Springer, Dordrecht 2006; ISBN 1-4020-3555-1 , стр. 253–698; DOI : 10.1007 / 1-4020-3598-5_5 (стр. 530–531, 557–564).
- Патент США 2535572: Получение UF 6 ; 26 декабря 1950 г.
- Патент США 5723837: Очистка гексафторида урана ; 3. Март 1998 г.
Внешние ссылки [ править ]
| Викискладе есть медиафайлы по теме гексафторида урана . |
- Саймон Коттон (Аппингемская школа, Ратленд, Великобритания): гексафторид урана .
- Гексафторид урана (UF 6 ) - Физические и химические свойства UF 6 и его использование в переработке урана - Гексафторид урана и его свойства
- Импорт западного обедненного гексафторида урана (урановые хвосты) в Россию [неактивная ссылка 30 июня 2017 г.]
- Гексафторид урана на www.webelements.com