 | |
| Имена | |
|---|---|
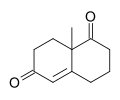
| Название ИЮПАК 8a-Метил-3,4,8,8a-тетрагидронафталин-1,6 (2 H , 7 H ) -дион | |
| Идентификаторы | |
3D модель ( JSmol ) | |
| ChemSpider | |
| ECHA InfoCard | 100.039.497 |
PubChem CID | |
Панель управления CompTox ( EPA ) | |
| |
| |
| Характеристики | |
| С 11 Н 14 О 2 | |
| Молярная масса | 178,23 г / моль |
| Температура плавления | От 47 до 50 ° C (от 117 до 122 ° F; от 320 до 323 K) |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
Wieland-Мишер кетон [2] представляет собой рацемический бициклический дикетон (ендион) и является универсальным синтоном , который до сих пор был использован в общем синтезе более 50 натуральных продуктов, преимущественно сесквитерпеноиды , дитерпены и стероидов , обладающий возможные биологические свойства , в том числе противоракового , антимикробное, противовирусное, антинейродегенеративное и иммуномодулирующее действие. Реагент назван в честь двух химиков из Ciba Geigy , Карла Мишера и Питера Виланда (не путать с Генрихом Отто Виландом.). Примерами синтезов, выполненных с использованием оптически активного энантиомера этого дикетона в качестве исходного материала, являются синтез анцистрофурана [3] и полный синтез таксола по Данишевскому . [4]
Большинство достижений в методах тотального синтеза, начиная с кетона Виланда-Мишера, было вызвано поиском альтернативных методов промышленного синтеза противозачаточных средств и других медицинских стероидов, область исследований, которая процветала в 1960-х и 1970-х годах. [5] Кетон Виланда-Мишера содержит структуру AB-кольца стероидов и по этой причине является привлекательным исходным материалом для стероидного скелета, подход, использованный в одном успешном синтезе адреностерона . [6]
Исходный кетон Виланда-Мишера является рацемическим и получают аннелированием по Робинсону 2-метил-1,3-циклогександиона и метилвинилкетона . Промежуточный спирт не выделяют. [7] Требуемое 2-метил-1,3-циклогександион может быть получен из резорцина [8] путем гидрирования над никелем Ренея в dihydroresorcinol как енолит с последующим алкилированием с йодистым метилом .
В энантиоселективном синтезе L-пролин используется в качестве органокатализатора : [9]
Эта реакция появилась в 1971 г. в патентной литературе ZG Hajos и DR Parrish. В этом патенте также было описано выделение и характеристика изображенного выше оптически активного промежуточного бициклического кетола (в скобках), поскольку они работали при температуре окружающей среды в безводном диметилформамиде (ДМФ) растворителе. Работа в растворителе ДМСО не позволяет выделить промежуточный бициклический кетол, это приводит непосредственно к оптически активному бициклическому диону. [10] Реакция называется реакцией Хаджоса-Пэрриша или реакцией Хаджоса-Пэрриша-Эдера-Зауэра-Вихерта . [11]
Эта реакция также была проведена в одностадийной процедуре, что привело к выходу 49% и 76% энантиомерному избытку (ее) : [12]
Были исследованы и другие катализаторы на основе пролина [13]
Ссылки [ править ]
- ^ (±) -8a-Метил-3,4,8,8a-тетрагидро-1,6 (2H, 7H) -нафталиндион в Sigma-Aldrich
- ^ Wieland, P .; Miescher, K. Über die Herstellung mehrkerniger Ketone. , Helv. Чим. Acta 1950 , 33 , 2215. doi : 10.1002 / hlca.19500330730
- ^ Ciceri, Паола, Demnitz, FW Joachim, Souza, Марсия CFде, Lehmanna, Maik. Общий подход к синтезу моноциклофарнезил-сесквитерпенов . J. Braz. Chem. Soc. 1998 , 9 , 409-414. ISSN 0103-5053 . ( Статья )
- ^ Сэмюэл Дж. Данишефски, Джон Дж. Мастерс, Венди Б. Янг, JT Link, Лоуренс Б. Снайдер, Томас В. Маги, Дэвид К. Юнг, Ричард К. А. Айзекс, Уильям Г. Борнманн, Шерил А. Алаймо, Крейг А. Коберн и Мартин Дж. Ди Гранди (1996). «Полный синтез баккатина III и таксола». Варенье. Chem. Soc. 118 (12): 2843-2859. DOI : 10.1021 / ja952692a
- ^ Вихерт, Р. Роль контроля над рождаемостью в выживании человеческой расы . Энгью. Chem. Int. Эд. 1977 , 16 , 506-513.
- ^ Дзирба, CD; Занди, Канзас; Moellers, T .; Ши, К.Дж. Восходящий синтез адреналькортикостероидов. Полный синтез (+) - адреностерона . Варенье. Chem. Soc. 1996 , 118 , 4711-4712.
- ^ Синтез Виланда-Мишера: а) вода, уксусная кислота , гидрохинон (стабилизирует EVK) б) L-пролин , ДМСО г) водород , никель Ренея , гидроксид натрия д) метилиодид , диоксан . удельное вращение 68 °.
- ^ AB Mekler, S. Ramachandran, S. Swaminathan, и Melvin S. Newman Organic Syntheses , Coll. Vol. 5, стр. 743 (1973); Vol. 41, стр. 56 ( 1961 ). ( Статья )
- ^ 1,6 (2H, 7H) -нафталиндион, 3,4,8,8a-тетрагидро-8a-метил-, (S) - Пауль Бухшахер, А. Фюрст и Дж. Гуцвиллер органический синтез, сб. Vol. 7, стр. 368 (1990); Vol. 63, стр.37 ( 1985 ). ( Статья )
- ^ ZG Hajos, DR Parrish, патент Германии DE 2102623 (29 июля 1971 г.) и USP 3,975,440 (17 августа 1976 г.), пример 21.
- ^ 1 H-Инден-1,5 (6 H) -дион, 2,3,7,7a-тетрагидро-7a-метил-, (S) - Zoltan G. Hajos и David R. Parrish Organic Syntheses , Coll. Vol. 7, стр. 363 ( 1990 ); Vol. 63, p.26 ( 1985 ) Статья Идентичная реакция с 2-метил-1,3-циклопентандионом (5-членное кольцо вместо 6-членного кольца)
- ^ Катализируемая пролином асимметричная реакция Робинсона аннулирования Tetrahedron Letters , Volume 41, Issue 36, September 2000 , Pages 6951-6954 Tommy Bui and Carlos F. Barbas doi : 10.1016 / S0040-4039 (00) 01180-1
- ^ Org. Synth. 2011, 88, 330-341 Ссылка