Криогенная электронная микроскопия ( крио-ЭМ ) - это метод электронной микроскопии (ЭМ), применяемый к образцам, охлажденным до криогенных температур и погруженным в среду стекловидной воды . Водный раствор образца наносят на сетку и погружают в жидкий этан или смесь жидкого этана и пропана. [2] Хотя разработка метода началась в 1970-х годах, недавние достижения в технологии детекторов и программных алгоритмах позволили определять биомолекулярные структуры с разрешением, близким к атомному. [3] Это привлекло широкое внимание к подходу в качестве альтернативы рентгеновской кристаллографии или ЯМР-спектроскопии. для определения структуры макромолекул без необходимости кристаллизации.
В 2017 году Нобелевская премия по химии была присуждена Жаку Дюбоше , Иоахиму Франку и Ричарду Хендерсону «за разработку криоэлектронной микроскопии для определения структуры биомолекул в растворах с высоким разрешением». [4] Nature Methods также назвала крио-ЭМ «методом года» в 2016 году. [5]
Просвечивающая электронная криомикроскопия [ править ]
Криогенная просвечивающая электронная микроскопия (крио-ТЕМ) - это метод просвечивающей электронной микроскопии , который используется в структурной биологии и материаловедении .
- Криогенная электронная томография (Cryo-ET), специализированное приложение, в котором образцы визуализируются при наклоне
- Электронная кристаллография , метод определения расположения атомов в твердых телах с помощью ПЭМ
- MicroED , [6] метод определения структуры белков, пептидов, органических молекул и неорганических соединений с использованием дифракции электронов от трехмерных кристаллов [7] [8] [9]
- Анализ одиночных частиц крио-ЭМ, метод усреднения для определения структуры белка из монодисперсных образцов [10]
История [ править ]
Раннее развитие [ править ]
В 1960-х годах использование просвечивающей электронной микроскопии для методов определения структуры было ограничено из-за радиационных повреждений, вызванных пучками электронов высокой энергии. Ученые предположили, что изучение образцов при низких температурах уменьшит радиационные повреждения, вызванные пучком. [11] И жидкий гелий (-269 ° C, или 4 K, или -452,2 ° F ), и жидкий азот (-195,79 ° C, или 77 K, или -320 ° F ) считались криогенами. В 1980 году Эрвин Кнапек и Жак Дюбоше опубликовал комментарий о повреждении луча при криогенных температурах, поделившись наблюдениями, которые:
Было обнаружено, что тонкие кристаллы, закрепленные на углеродной пленке, в 30-300 раз более устойчивы к пучку при 4 К, чем при комнатной температуре ... Большинство наших результатов можно объяснить, если предположить, что криозащита в области 4 К сильно зависит от температура. [12]
Однако эти результаты не удалось воспроизвести, и всего два года спустя в журнале Nature были опубликованы поправки, в которых сообщалось, что сопротивление пучка оказалось менее значительным, чем предполагалось изначально. Защита, полученная при 4 К, была ближе к «десятикратной для стандартных образцов L-валина» [13], чем было заявлено ранее.
В 1981 году ученые Европейской лаборатории молекулярной биологии Аласдер МакДауэлл и Жак Дюбоше сообщили о первом успешном применении крио-ЭМ. [14] Макдоуол и Dubochet остеклованы чистая вода в тонкой пленке путем распыления его на гидрофильную углеродную пленку , которая быстро погрузилась в криогенный (жидкий пропан или жидкий этан охлажденного до 77 К). Тонкий слой аморфного льда имел толщину менее 1 мкм, и электронограмма подтвердила присутствие аморфного / стекловидного льда. В 1984 году, Dubochet это группа продемонстрировала силу крио-ЭМ в структурной биологии с анализом витрифицированного аденовируса типа 2, бактериофага Т4 , вируса леса Семлики , бактериофага CbK и вируса везикулярного стоматита . [15]
Нобелевская премия по химии 2017 г. [ править ]
В 2017 году трое ученых, Жак Дюбоше , Иоахим Франк и Ричард Хендерсон , были удостоены Нобелевской премии по химии за разработку метода изображения биомолекул. [4]
Потенциальный конкурент рентгеновской кристаллографии [ править ]
По состоянию на 27 октября 2020 года рентгеновская кристаллография использовалась для получения изображений 150 494 биологических образцов и является доминирующим методом в биологической микроскопии , крио-ЭМ далеко позади - всего 6016. [16]
Однако, согласно Nature , достижения в области прямых электронных детекторов (часто называемых устройствами прямого обнаружения или DDD) в Кембриджском университете [17] и автоматизация производства образцов компанией SPT labtech [18] привели к увеличению использования биологические поля [19], что делает Крио-ЭМ потенциальным конкурентом.
Разрешение рентгеновской кристаллографии ограничено чистотой кристаллов [20], и создание таких образцов занимает очень много времени, вплоть до месяцев или даже лет. [19] Кроме того, некоторые белки трудно кристаллизовать. [19] [21] Хотя подготовка образца для Крио-ЭМ по-прежнему трудоемка, [22] у него нет этих проблем, поскольку он наблюдает образец в его «естественном состоянии». [21]
Согласно Proteopedia , среднее разрешение, полученное с помощью рентгеновской кристаллографии (по состоянию на 19 мая 2019 г.) в банке данных о белках, составляет 2,05 Å [20], а максимальное разрешение, достигнутое за всю историю (по состоянию на 27 октября 2020 г.), составляет 0,48. Å. [23] По состоянию на 2020 год большинство белковых структур, определенных Cryo-EM, имеют более низкое разрешение - 3–4 Å. [24] Однако лучшее разрешение Cryo-EM приближается к 1,5 Å [25], что в некоторых случаях делает его достойным конкурентом по разрешению.
Корреляционный свет Крио-ТЕМ и Крио-ЭТ [ править ]
В 2019 году корреляционный свет Cryo-TEM и Cryo-ET использовался для наблюдения туннельных нанотрубок (TNT) в нейрональных клетках. [26]
Сканирующая электронная криомикроскопия [ править ]
Сканирующий электронный cryomicroscopy (cryoSEM), является сканирующей электронной микроскопии технику с холодной стадии с помощью сканирующего электронного микроскопа в криогенной камере.
См. Также [ править ]
- Криофиксация
- Электронная томография (ЭТ)
Ссылки [ править ]
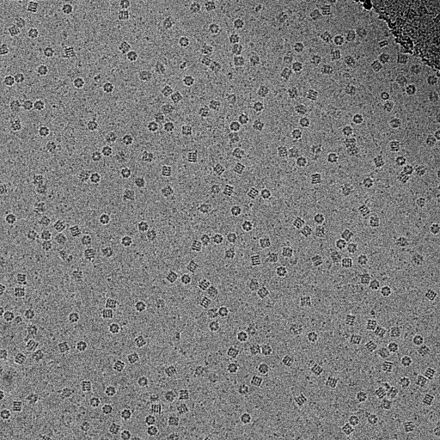
- ^ Xiao, C., Fischer, MG, Bolotaulo, DM, Ulloa-Rondeau, N., Avila, GA, и Suttle, CA (2017) «Крио-ЭМ реконструкция капсида вируса Cafeteria roenbergensis предлагает новый путь сборки гигантских вирусов. ". Научные доклады , 7 : 5484. DOI : 10.1038 / s41598-017-05824-ш .
- ^ Тивол, Уильям Ф .; Бригель, Ариана; Дженсен, Грант Дж. (Октябрь 2008 г.). «Улучшенный криоген для глубинного замораживания» . Микроскопия и микроанализ . 14 (5): 375–379. Bibcode : 2008MiMic..14..375T . DOI : 10.1017 / S1431927608080781 . ISSN 1431-9276 . PMC 3058946 . PMID 18793481 .
- ^ Cheng Y, N Григорьев, Penczek PA, Вальц T (апрель 2015). «Праймер для криоэлектронной микроскопии одиночных частиц» . Cell . 161 (3): 438–449. DOI : 10.1016 / j.cell.2015.03.050 . PMC 4409659 . PMID 25910204 .
- ^ а б Кресси Д., Каллавей Э (октябрь 2017 г.). «Криоэлектронная микроскопия приносит Нобелевскую премию по химии» . Природа . 550 (7675): 167. Bibcode : 2017Natur.550..167C . DOI : 10.1038 / nature.2017.22738 . PMID 29022937 .
- ^ Doerr, Allison (январь 2017). «Криоэлектронная томография». Методы природы . 14 (1): 34. DOI : 10.1038 / nmeth.4115 . ISSN 1548-7091 . S2CID 27162203 .
- ^ Nannenga, Brent L; Ши, Дан; Лесли, Эндрю GW; Гонен, Тамир (2014-08-03). «Определение структуры с высоким разрешением путем сбора данных непрерывного вращения в MicroED» . Методы природы . 11 (9): 927–930. DOI : 10,1038 / Nmeth.3043 . PMC 4149488 . PMID 25086503 .
- ^ Джонс, Кристофер G .; Martynowycz, Michael W .; Хаттне, Йохан; Фултон, Тайлер Дж .; Штольц, Брайан М .; Родригес, Хосе А .; Nelson, Hosea M .; Гонен, Тамир (2018-11-02). «Метод криоЭМ MicroED как мощный инструмент для определения структуры малых молекул» . АСУ Центральная Наука . 4 (11): 1587–1592. DOI : 10.1021 / acscentsci.8b00760 . PMC 6276044 . PMID 30555912 .
- ^ де ла Крус, М. Джейсон; Хаттне, Йохан; Ши, Дан; Зайдлер, Пол; Родригес, Хосе; Рейес, Фрэнсис Э; Савая, Майкл Р.; Cascio, Duilio; Вайс, Саймон С (2017). «Структуры с атомным разрешением из фрагментированных кристаллов белка с помощью метода криоЭМ MicroED» . Методы природы . 14 (4): 399–402. DOI : 10.1038 / nmeth.4178 . PMC 5376236 . PMID 28192420 .
- ^ Gruene Т, Wennmacher JT, Zaubitzer С, Гольштейн JJ, Хайдлера Дж, Фекто-Лефебвр А, Де Карло S, Мюллер Е, Голди К. Н., Regeni я, Ли Т, Сантисо-хиноны G, Штайнфельд G, Handschin S, ван Гендерен E, ван Боховен JA, Clever GH, Pantelic R (октябрь 2018 г.). «Быстрое определение структуры микрокристаллических молекулярных соединений с помощью дифракции электронов» . Angewandte Chemie . 57 (50): 16313–16317. DOI : 10.1002 / anie.201811318 . PMC 6468266 . PMID 30325568 .
- ^ Чэн, Ифань (2018-08-31). «Одночастичная крио-ЭМ - как она попала сюда и куда пойдет» . Наука . 361 (6405): 876–880. Bibcode : 2018Sci ... 361..876C . DOI : 10.1126 / science.aat4346 . ISSN 0036-8075 . PMC 6460916 . PMID 30166484 .
- ^ Dubochet J, Knápek E (апрель 2018). «Взлеты и падения в ранней электронной криомикроскопии» . PLOS Биология . 16 (4): e2005550. DOI : 10.1371 / journal.pbio.2005550 . PMC 5929567 . PMID 29672565 .
- ^ Knápek E, Dubochet J (август 1980). «Повреждение органического материала пучком значительно снижается при криоэлектронной микроскопии». Журнал молекулярной биологии . 141 (2): 147–61. DOI : 10.1016 / 0022-2836 (80) 90382-4 . PMID 7441748 .
- ^ Ньюмарка P (30 сентября 1982). «Крио-трансмиссионная микроскопия Угасающие надежды» . Природа . 299 (5882): 386–387. Bibcode : 1982Natur.299..386N . DOI : 10.1038 / 299386c0 .
- ^ Dubochet, J .; McDowall, AW (декабрь 1981 г.). «Стеклование чистой воды для электронной микроскопии» . Журнал микроскопии . 124 (3): 3–4. DOI : 10.1111 / j.1365-2818.1981.tb02483.x .
- ^ Адриан, Марк; Дюбоше, Жак; Лепо, Жан; Макдауэл, Аласдер У. (март 1984 г.). «Криоэлектронная микроскопия вирусов» . Природа . 308 (5954): 32–36. Bibcode : 1984Natur.308 ... 32A . DOI : 10.1038 / 308032a0 . ISSN 0028-0836 . PMID 6322001 . S2CID 4319199 .
- ^ «RCSB PDB - Отчет о запасах» . www.rcsb.org . Проверено 27 октября 2020 .
- ^ Callaway, Ивен (2015-09-10). «Революция не будет кристаллизоваться: новый метод пронизывает структурную биологию» . Новости природы . 525 (7568): 172–174. Bibcode : 2015Natur.525..172C . DOI : 10.1038 / 525172a . PMID 26354465 .
- ^ Бейкер, Моня (2018-09-25). «Криоэлектронная микроскопия наверху» . Природа . 561 (7724): 565–567. Bibcode : 2018Natur.561..565B . DOI : 10.1038 / d41586-018-06791-6 . PMID 30254359 .
- ^ a b c Каллавей, Юэн (10 февраля 2020 г.). «Революционная крио-ЭМ захватывает структурную биологию» . Природа . 578 (7794): 201. Bibcode : 2020Natur.578..201C . DOI : 10.1038 / d41586-020-00341-9 . PMID 32047310 .
- ^ a b «Разрешение - Протеопедия, жизнь в 3D» . proteopedia.org . Проверено 27 октября 2020 .
- ^ а б «Крио-ЭМ услуги - творческая биоструктура» . www.creative-biostructure.com . Проверено 27 октября 2020 .
- ^ Bhella, Дэвид (2019-08-01). «Криоэлектронная микроскопия: введение в методику и соображения при работе над созданием национального объекта» . Биофизические обзоры . 11 (4): 515–519. DOI : 10.1007 / s12551-019-00571-ш . ISSN 1867-2469 . PMC 6682334 . PMID 31359340 .
- ^ Банк, RCSB Protein Data. «RCSB PDB» . www.rcsb.org . Проверено 27 октября 2020 .
- ^ Йип, Ка Ман; Фишер, Нильс; Пакния, Эльхам; Чари, Ашвин; Старк, Хольгер (2020). «Определение структуры белка с атомным разрешением с помощью крио-ЭМ». Природа . 587 (7832): 157–161. Bibcode : 2020Natur.587..157Y . DOI : 10.1038 / s41586-020-2833-4 . PMID 33087927 .
- ^ Bhella, Дэвид (2019-08-01). «Криоэлектронная микроскопия: введение в методику и соображения при работе над созданием национального объекта» . Биофизические обзоры . 11 (4): 515–519. DOI : 10.1007 / s12551-019-00571-ш . ISSN 1867-2469 . PMC 6682334 . PMID 31359340 .
- ^ Сартори-Рупп, Анна; Кордеро Сервантес, Диего; Пепе, Анна; Гуссе, Карин; Делаж, Элиза; Корройер-Дульмон, Саймон; Шмитт, Кристина; Крижнсе-Локер, Якомина; Зурзоло, Кьяра (декабрь 2019 г.). «Корреляционная криоэлектронная микроскопия выявляет структуру TNT в нейрональных клетках» . Nature Communications . 10 (1): 342. Bibcode : 2019NatCo..10..342S . DOI : 10.1038 / s41467-018-08178-7 . ISSN 2041-1723 . PMC 6341166 . PMID 30664666 .



.jpg/440px-CroV_TEM_(cropped).jpg)