| Нуклеопорин 133/155, N-концевой | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Этот домен имеет структуру бета-винта с 7 лопастями (PDB 1XKS). | |||||||||
| Идентификаторы | |||||||||
| Символ | Nucleoporin_N | ||||||||
| Pfam | PF08801 | ||||||||
| ИнтерПро | IPR014908 | ||||||||
| SCOP2 | 1XKS / SCOPe / SUPFAM | ||||||||
| |||||||||
| Нуклеопорин 133/155, С-концевой (ACE2) | |||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
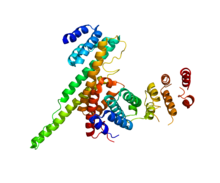 NUP133 (этот домен; справа) взаимодействует с NUP107 (PDB 3CQC). | |||||||||||
| Идентификаторы | |||||||||||
| Символ | Нуклеопорин_С | ||||||||||
| Pfam | PF03177 | ||||||||||
| ИнтерПро | IPR007187 | ||||||||||
| |||||||||||
| FG повтор | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | Nucleoporin_FG | ||||||||
| Pfam | PF13634 | ||||||||
| Клан пфам | CL0647 | ||||||||
| ИнтерПро | IPR025574 | ||||||||
| |||||||||
Нуклеопорины представляют собой семейство белков, которые являются составными строительными блоками комплекса ядерных пор (NPC). [1] Комплекс ядерных пор представляет собой массивную структуру, встроенную в ядерную оболочку в местах слияния внутренней и внешней ядерных мембран, образуя ворота, которые регулируют поток макромолекул между ядром клетки и цитоплазмой . Ядерные поры обеспечивают пассивный и облегченный транспорт молекул через ядерную оболочку . Нуклеопорины, семейство из примерно 30 белков, являются основными компонентами комплекса ядерных пор в эукариотических организмах.клетки. Нуклеопорин 62 - самый распространенный член этого семейства. [2] Нуклеопорины способны переносить молекулы через ядерную оболочку с очень высокой скоростью. Один NPC может каждую минуту переносить 60 000 белковых молекул через ядерную оболочку. [3]
Функция [ править ]
Нуклеопорины опосредуют транспорт макромолекул между ядром клетки и цитоплазмой у эукариот . Некоторые члены семейства нуклеопоринов образуют структурную основу комплекса ядерных пор. Однако нуклеопорины в основном функционируют за счет взаимодействия с транспортными молекулами, известными как кариоферины , также известные как Kaps [4]. Эти кариоферины взаимодействуют с нуклеопоринами, которые содержат повторяющиеся последовательности аминокислотных повторов фенилаланина (F) и глицина (G) FG. [5] При этом кариоферины могут перемещать свой груз через ядерную оболочку. Нуклеопорины необходимы только для транспорта крупных гидрофильных молекул с массой более 40 кДа, поскольку более мелкие молекулы проходят через ядерные поры посредством пассивной диффузии . Нуклеопорины играют важную роль в транспорте мРНК из ядра в цитоплазму после транскрипции . [6] В зависимости от их функции определенные нуклеопорины локализуются либо на цитозольной, либо на нуклеоплазматической стороне комплекса ядерных пор. Другие нуклеопорины могут быть найдены с обеих сторон. Недавно было показано, что нуклеопорины FG обладают специфическими эволюционно консервативными особенностями, закодированными в их последовательностях, которые дают представление о том, как они регулируют транспорт молекул через комплекс ядерных пор (NPC). [7] [8]
Структура [ править ]
Нуклеопорины объединяются, образуя комплекс ядерных пор , восьмиугольное кольцо, пересекающее ядерную оболочку. Кольцо состоит из восьми субкомплексов каркаса с двумя структурными слоями COPII- подобного покрытия, покрывающего некоторые белки, выстилающие поры. От цитоплазмы до нуклеоплазмы три слоя кольцевого комплекса называются кольцами цитоплазмы, внутренней поры и нуклеоплазмы соответственно. Различные наборы белков связываются с каждым кольцом, и некоторые трансмембранные белки закрепляют сборку на липидном бислое. [9]
В субкомплексе каркаса и цитоплазма, и кольца нуклеоплазмы состоят из Y-комплексов, белкового комплекса, построенного, среди прочего, из NUP133 и NUP107. На каждом конце каждого из восьми каркасов есть два Y-комплекса, добавляющих до 32 комплексов на пору. [9] Взаимосвязь кривизны мембраны ядерной поры с Y-комплексами может рассматриваться как аналогия образования почкующихся пузырьков, покрытых COPII. [3] Белки, выстилающие внутреннюю пору, составляют комплекс NUP62. [9]
На стороне нуклеоплазмы дополнительные белки, связанные с кольцом, образуют «ядерную корзину», комплекс, способный связывать нуклеопорин с ядерной пластиной и даже с определенными частями генома. [9] Цитоплазматический конец менее развит, с восемью филаментами, выступающими в цитоплазму. Похоже, они не играют никакой роли в ядерном импорте. [10]
Мембранные нуклеопорины связываются как с каркасом, так и с ядерной мембраной. Некоторые из них, например GP210 , пересекают всю мембрану, другие (например, NUP98 ) действуют как гвозди со структурными частями для облицовки, а также частями, которые врезаются в мембрану. [9] NUP98 ранее считался FG-нуклеопорином, пока не было продемонстрировано, что «FG» в нем имеет складку в виде спиральной спирали. [9]
Некоторые нуклеопорины содержат FG-повторы. Названные в честь фенилаланина и глицина , FG-повторы представляют собой небольшие гидрофобные сегменты, которые расщепляют длинные участки гидрофильных аминокислот. Эти гибкие части образуют развернутые или неупорядоченные сегменты без фиксированной структуры. [11] Они образуют массу цепочек, которые позволяют более мелким молекулам диффундировать, но исключают крупные гидрофильные макромолекулы. Эти большие молекулы способны пересекать ядерную пору только в том случае, если они сопровождаются сигнальной молекулой, которая временно взаимодействует с сегментом FG-повтора нуклеопорина. FG-нуклеопорины также содержат глобулярную часть, которая служит якорем для прикрепления к комплексу ядерной поры.[3]
Было показано, что нуклеопорины образуют различные субкомплексы друг с другом. Наиболее распространенным из этих комплексов является комплекс nup62, который представляет собой сборку, состоящую из NUP62 , NUP58, NUP54 и NUP45. [12] Другим примером такого комплекса является комплекс Y (NUP107-160), состоящий из множества различных нуклеопоринов. Комплекс NUP107-160 локализован в кинетохорах и играет роль в митозе . [13]
Эволюция [ править ]
Многие структурные нуклеопорины содержат домены соленоидных белков, домены , состоящие из повторов, которые могут быть сложены вместе в виде основных строительных блоков. Есть бета-пропеллерный домен, сходный с повторами WD40 , и, что более интересно, уникальные типы повторов альфа-соленоидов (пучки спиралей), которые образуют собственный класс, предковые коатомерные элементы (ACE). На сегодняшний день идентифицировано два класса ACE. ACE1 представляет собой 28-спиральный домен, обнаруженный во многих нуклеопротеинах каркаса, а также в SEC31., компонент COPII. ACE2, показанный в информационном окне, обнаружен в дрожжах Nup157 / Nup170 (человеческий Nup155) и Nup133. В любом случае общие домены, как следует из их названий, указывают на общее происхождение как внутри нуклеопротеидов, так и между нуклеопротеинами и котамерами. [14]
Все живые эукариоты разделяют многие важные компоненты NPC, что указывает на то, что у их общего предка присутствует полный комплекс. [15]
Транспортный механизм [ править ]
Нуклеопорины регулируют транспорт макромолекул через ядерную оболочку посредством взаимодействия с молекулами-переносчиками кариоферинов . Кариоферины связываются со своим грузом и обратимо взаимодействуют с FG-повторами нуклеопоринов. Кариоферины и их груз передаются между FG-повторами, пока они не диффундируют вниз по градиенту их концентрации и через комплекс ядерных пор. Кариоферины могут служить импортином (транспортировать белки в ядро) или экспортином (транспортировать белки из ядра). [3] Высвобождение кариоферинов своего груза управляется Ran , G-белком.. Ran достаточно мал, чтобы диффундировать через ядерные поры вниз по градиенту концентрации, не взаимодействуя с нуклеопоринами. Ран будет связываться либо с GTP, либо с GDP и имеет возможность изменять сродство кариоферина к своему грузу. Внутри ядра RanGTP заставляет импортин кариоферин изменять конформацию, позволяя высвобождать его груз. RanGTP может также связываться с экспортными кариоферинами и проходить через ядерную пору. Как только он достиг цитозоля, RanGTP может быть гидролизован до RanGDP, позволяя высвободить груз экспортина. [16]
Патология [ править ]
Некоторые заболевания связаны с патологиями нуклеопоринов, особенно с диабетом , первичным билиарным циррозом , болезнью Паркинсона и болезнью Альцгеймера . Было показано, что сверхэкспрессия генов, кодирующих различные нуклеопорины, связана с образованием раковых опухолей .
Было показано, что нуклеопорины очень чувствительны к изменениям концентрации глюкозы . Следовательно, люди, страдающие диабетом, часто обнаруживают повышенное гликозилирование нуклеопоринов, особенно нуклеопорина 62 . [2]
Аутоиммунные состояния, такие как антитела против p62 , которые ингибируют комплексы p62, связаны с первичным билиарным циррозом, который разрушает желчные протоки печени. [12]
Снижение продукции комплекса p62 характерно для многих нейродегенеративных заболеваний . Модификация промотора p62 путем окисления коррелирует с болезнью Альцгеймера , болезнь Хантингтона и болезнь Паркинсона среди других нейродегенеративных расстройств. [17]
Повышенная экспрессия гена NUP88 , который кодирует нуклеопорин 88, обычно обнаруживается при предраковых дисплазиях и злокачественных новообразованиях . [18]
Нуклеопориновый белок аладин является компонентом комплекса ядерных пор . Мутации в гене аладина ответственны за синдром тройного А , аутосомно- рецессивное нейроэндокринологическое заболевание. Мутантный аладин вызывает избирательное нарушение импорта ядерного белка и гиперчувствительность к окислительному стрессу . [19] Импорт репарации ДНК белков aprataxin и ДНК - лигазы I селективно снижается, и это может повысить уязвимость клетки ДНК для окислительного стресса , индуцированногоповреждения , вызывающие гибель клеток. [19]
Примеры [ править ]
Каждый отдельный нуклеопорин назван в соответствии с его молекулярной массой (в килодальтонах ). Ниже приведены несколько примеров белков семейства нуклеопоринов:
- NUP35 , NUP37 , NUP43 , NUP50
- NUP54 , NUP62 , NUP85 , NUP88 , NUP93 , NUP98
- NUP107 , NUP133 , NUP153 , NUP155 , NUP160 , NUP188
- NUP205 , NUP210 , NUP214
Ссылки [ править ]
- ^ Doye В, Вред Е (июнь 1997 г.). «От нуклеопоринов до ядерно-поровых комплексов». Текущее мнение в клеточной биологии . 9 (3): 401–11. DOI : 10.1016 / S0955-0674 (97) 80014-2 . PMID 9159086 .
- ^ a b Хан I, Oh ES, Kudlow JE (август 2000 г.). «Чувствительность состояния O-связанной модификации N-ацетилглюкозамина белка ядерных пор p62 на внеклеточную концентрацию глюкозы» . Биохимический журнал . 350, Пет. 1: 109–14. DOI : 10.1042 / 0264-6021: 3500109 . PMC 1221231 . PMID 10926833 .
- ^ а б в г Лодиш Х (2013). Молекулярная клеточная биология (седьмое изд.). Нью-Йорк: Worth Publ. ISBN 978-1-4292-3413-9.
- ^ Аллен Н.П., Патель С.С., Хуанг Л., Чолкли Р.Дж., Бурлингейм А, Лутцманн М., Hurt EC, Рексач М. (декабрь 2002 г.). «Расшифровка сетей белковых взаимодействий в комплексе ядерных пор» . Молекулярная и клеточная протеомика . 1 (12): 930–46. DOI : 10.1074 / mcp.t200012-MCP200 . PMID 12543930 .
- Перейти ↑ Peters R (2006). Введение в ядерно-цитоплазматический транспорт: молекулы и механизмы . Методы молекулярной биологии. 322 . С. 235–58. DOI : 10.1007 / 978-1-59745-000-3_17 . PMID 16739728 .
- ^ Marfori М, Mynott А, Эллис Дж, Мехди AM, Сондерс NF, Curmi PM, Forwood JK, Boden M, Kobe B (сентябрь 2011). «Молекулярные основы специфичности ядерного импорта и предсказания ядерной локализации» . Biochimica et Biophysica Acta (BBA) - Исследование молекулярных клеток . 1813 (9): 1562–77. DOI : 10.1016 / j.bbamcr.2010.10.013 . PMID 20977914 .
- ^ Peyro М, М Soheilypour, Ли Б.Л., Mofrad MR (ноябрь 2015 г.). «Эволюционно сохраненные особенности последовательности регулируют формирование сети FG в центре ядерного порового комплекса» . Научные отчеты . 5 : 15795. Bibcode : 2015NatSR ... 515795P . DOI : 10.1038 / srep15795 . PMC 4635341 . PMID 26541386 .
- ^ Ando Д, Кольвин М, Рексач М, Гопинатан А (2013-09-16). «Кластеризация физических мотивов внутри изначально неупорядоченных последовательностей нуклеопоринов обнаруживает универсальные функциональные особенности» . PLOS ONE . 8 (9): e73831. Bibcode : 2013PLoSO ... 873831A . DOI : 10.1371 / journal.pone.0073831 . PMC 3774778 . PMID 24066078 .
- ^ a b c d e f Бек, Мартин; Hurt, Ed (21 декабря 2016 г.). «Ядерный поровый комплекс: понимание его функции через структурное понимание» . Обзоры природы Молекулярная клеточная биология . 18 (2): 73–89. DOI : 10.1038 / nrm.2016.147 . PMID 27999437 . S2CID 35394962 . Проверено 10 апреля 2019 .
- ^ Вальтер, TC; Пикерсгилл, HS; Кордес, ВК; Гольдберг, МВт; Аллен, Т. Д.; Mattaj, IW; Форнерод, М. (8 июля 2002 г.). «Цитоплазматические нити комплекса ядерной поры незаменимы для селективного импорта ядерного белка» . Журнал клеточной биологии . 158 (1): 63–77. DOI : 10,1083 / jcb.200202088 . PMC 2173022 . PMID 12105182 .
- Перейти ↑ Denning D, Patel S, Uversky V, Fink A, Rexach M (2003). «Нарушение в комплексе ядерных пор: области повторов FG нуклеопоринов изначально развернуты» . Proc Natl Acad Sci USA . 100 (5): 2450–5. Bibcode : 2003PNAS..100.2450D . DOI : 10.1073 / pnas.0437902100 . PMC 151361 . PMID 12604785 .
- ^ a b Миячи К., Хэнкинс Р. У., Мацусима Х, Кикучи Ф, Иномата Т, Хоригоме Т, Сибата М, Онозука Й, Уэно Й, Хашимото Е., Хаяси Н., Сибуя А., Амаки С., Миякава Х (май 2003 г.). «Профиль и клиническое значение антител против ядерной оболочки, обнаруженных у пациентов с первичным билиарным циррозом: многоцентровое исследование». Журнал аутоиммунитета . 20 (3): 247–54. DOI : 10.1016 / S0896-8411 (03) 00033-7 . PMID 12753810 .
- ^ Loïodice я, Алвес А, Rabut G, Ван Overbeek М, Элленберга Дж, Sibarita JB, Doye В (июль 2004 г.). «Весь комплекс Nup107-160, включая три новых члена, нацелен как единое целое на кинетохоры в митозе» . Молекулярная биология клетки . 15 (7): 3333–44. DOI : 10,1091 / mbc.E03-12-0878 . PMC 452587 . PMID 15146057 .
- ^ Уиттл, младший; Schwartz, TU (9 октября 2009 г.). «Архитектурные нуклеопорины Nup157 / 170 и Nup133 структурно связаны и происходят от второго предкового элемента» . Журнал биологической химии . 284 (41): 28442–52. DOI : 10.1074 / jbc.M109.023580 . PMC 2788893 . PMID 19674973 .
- ^ Нойман, N; Лундин, Д; Пул, AM (8 октября 2010 г.). «Сравнительное геномное свидетельство полного комплекса ядерных пор у последнего общего предка эукариот» . PLOS ONE . 5 (10): e13241. Bibcode : 2010PLoSO ... 513241N . DOI : 10.1371 / journal.pone.0013241 . PMC 2951903 . PMID 20949036 .
- ↑ Avis JM, Clarke PR (октябрь 1996 г.). «Ран, ГТФаза, участвующая в ядерных процессах: ее регуляторы и эффекторы». Журнал клеточной науки . 109 (Pt 10): 2423–7. PMID 8923203 .
- Перейти ↑ Du Y, Wooten MC, Wooten MW (август 2009). «Окислительное повреждение промоторной области SQSTM1 / p62 является общим для нейродегенеративного заболевания» . Нейробиология болезней . 35 (2): 302–10. DOI : 10.1016 / j.nbd.2009.05.015 . PMC 2718328 . PMID 19481605 .
- ^ "Энтрез Ген: NUP88 нуклеопорин 88 кДа"
- ^ a b Хирано М., Фурия Й, Асаи Х, Ясуи А, Уэно С. (февраль 2006 г.). «ALADINI482S вызывает селективную недостаточность импорта ядерного белка и гиперчувствительность к окислительному стрессу при синдроме тройного А» . Proc. Natl. Акад. Sci. США . 103 (7): 2298–303. Bibcode : 2006PNAS..103.2298H . DOI : 10.1073 / pnas.0505598103 . PMC 1413683 . PMID 16467144 .
Внешние ссылки [ править ]
- Nucleoporin в Национальной медицинской библиотеке США по предметным заголовкам по медицинским предметам (MeSH)
- Нуклеопорин (поиск InterPro)