| Агонист дофамина | |
|---|---|
| Класс препарата | |
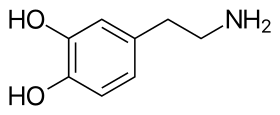 Скелетная структура дофамина | |
| Идентификаторы класса | |
| Использовать | Болезнь Паркинсона , клиническая депрессия , гиперпролактинемия , синдром беспокойных ног , пониженное половое влечение |
| Код УВД | N04BC |
| Биологическая мишень | Дофаминовые рецепторы |
| Внешние ссылки | |
| MeSH | D010300 |
| В Викиданных | |
Агонист дофамина (DA) , представляет собой соединение , которое активирует рецепторы допамина . Есть два семейства дофаминовых рецепторов , D 2 -подобные и D 1- подобные, и все они являются рецепторами, связанными с G-белком . D 1- и D 5 -рецепторы принадлежат к D 1- подобному семейству, а D 2- подобное семейство включает D 2 , D 3 и D 4 рецепторы. [1] Агонисты дофамина используются при болезни Паркинсона и, в меньшей степени, для лечениядепрессия , гиперпролактинемия и синдром беспокойных ног . [2]
Медицинское использование [ править ]
Болезнь Паркинсона [ править ]
Агонисты дофамина в основном используются при лечении болезни Паркинсона . [2] Причина болезни Паркинсона до конца не известна, но с болезнью связаны генетические факторы, например, специфические генетические мутации и триггеры окружающей среды. [3] При болезни Паркинсона дофаминергические нейроны , вырабатывающие в мозге нейромедиатор дофамин, медленно разрушаются и в конечном итоге могут умереть. При снижении уровня дофамина мозг не может нормально функционировать и вызывает аномальную активность мозга, что в конечном итоге приводит к симптомам болезни Паркинсона. [4]
Есть два основных способа лечения болезни Паркинсона: либо путем замены дофамина, либо путем имитации его эффекта. [1]
Агонисты дофамина действуют непосредственно на рецепторы дофамина и имитируют эффект дофамина. [1] Агонисты дофамина делятся на два подкласса: эрголиновые и неэрголиновые агонисты. Оба подкласса нацелены на рецепторы дофаминового D 2 -типа. Типами агонистов эрголина являются каберголин и бромокриптин, а примерами неэрголиновых агонистов являются прамипексол , ропинирол и ротиготин . Агонисты эрголина в настоящее время используются гораздо реже из-за риска образования хрящевой ткани в сердечных клапанах. [5]
Лечение депрессии у пациентов с болезнью Паркинсона [ править ]
Депрессивные симптомы и расстройства часто встречаются у пациентов с болезнью Паркинсона и могут влиять на качество их жизни. [6] Повышенная тревожность может усилить симптомы болезни Паркинсона, поэтому ее необходимо лечить. Вместо обычных антидепрессантов при лечении депрессии было предложено лечение агонистами дофамина. [7] В основном считается, что агонисты дофамина помогают при лечении депрессивных симптомов и расстройств, облегчая двигательные осложнения, которые являются одним из основных симптомов болезни Паркинсона. Хотя предварительные данные клинических испытаний показали интересное [ как? ]Таким образом, дальнейшие исследования имеют решающее значение для установления антидепрессивных эффектов агонистов дофамина при лечении депрессивных симптомов и расстройств у людей с болезнью Паркинсона. [6]
Гиперпролактинемия [ править ]
Дофамин является фактором, ингибирующим пролактин (PIF), поскольку он снижает синтез и секрецию факторов высвобождения пролактина (PRF) через DD 2- подобные рецепторы. [8] Вот почему агонисты дофамина являются препаратами первой линии при гиперпролактинемии . [9] В лечении чаще всего используются препараты на основе эрголина, бромокриптин и каберголин . Исследования показывают, что эти агенты уменьшают размер пролактином за счет подавления гиперсекреции пролактина, что приводит к нормальной функции гонад . [10]
Синдром беспокойных ног [ править ]
Многочисленные клинические испытания были проведены для оценки использования агонистов дофамина для лечения синдрома беспокойных ног (СБН). СБН определяется по сильному побуждению к движению и является дофамин-зависимым расстройством. Симптомы СБН уменьшаются при приеме препаратов, которые стимулируют дофаминовые рецепторы и повышают уровень дофамина, таких как агонисты дофамина. [11]
Побочные эффекты [ править ]
Побочные эффекты [ править ]
Агонисты дофамина в основном используются для лечения болезни Паркинсона, но также используются для лечения гиперпролактинемии и синдрома беспокойных ног . [12] Побочные эффекты в основном регистрируются при лечении болезни Паркинсона, где обычно используются агонисты дофамина, особенно в качестве терапии первой линии с помощью леводопы . [13]
Агонисты дофамина делятся на две подгруппы или классы препаратов: препараты первого поколения и более новые. Агонисты, производные от эрголина, относятся к первому поколению и используются не так часто, как агонисты, не являющиеся производными эрголина нового поколения. Агонисты, производные эрголина, считаются более грязными лекарствами из-за их взаимодействия с другими рецепторами, чем с рецепторами дофамина, поэтому они вызывают больше побочных эффектов. Агонисты, производные эрголина, представляют собой, например, бромокриптин , каберголин , перголид и лизурид . Неэрголиновые агонисты - это прамипексол , ропинирол , ротиготин , пирибедил и апоморфин . [1]
Наиболее частыми побочными эффектами являются запор , тошнота и головные боли . К другим серьезным побочным эффектам относятся галлюцинации , периферические отеки , язвы желудочно-кишечного тракта, фиброз легких и психоз . [1] [13]
Агонисты дофамина связаны с сердечными проблемами. Побочные эффекты, такие как гипотония , инфаркт миокарда , застойная сердечная недостаточность, фиброз сердца, выпот в перикард и тахикардия . [1] Высокий риск клапанной болезни сердца был установлен в связи с приемом агонистов спорыньи, особенно у пожилых пациентов с артериальной гипертензией. [14]
Сообщалось, что сонливость и приступы сна являются побочным эффектом, который случается почти у 30% пациентов, принимающих агонисты дофамина. Сообщалось также о дневной сонливости, бессоннице и других нарушениях сна. [1] [15] [16]
Расстройство контроля над импульсами , которое описывается как азартные игры, гиперсексуальность, компульсивные покупки и переедание, является одним из серьезных побочных эффектов агонистов дофамина. [12]
После длительного применения агониста дофамина может возникнуть синдром отмены при прекращении приема или во время снижения дозы. Возможны следующие побочные эффекты: тревога, панические атаки, дисфория , депрессия, возбуждение, раздражительность, суицидальные мысли, утомляемость, ортостатическая гипотензия , тошнота, рвота, потоотделение , генерализованная боль и тяга к наркотикам. У некоторых людей эти симптомы отмены кратковременны и полностью выздоравливают, у других может развиться длительный синдром отмены, при котором симптомы отмены сохраняются в течение месяцев или лет. [17]
Взаимодействия [ править ]
Агонисты дофамина взаимодействуют с рядом лекарств, но мало доказательств того, что они взаимодействуют с другими лекарствами от болезни Паркинсона . В большинстве случаев нет причин не принимать одновременно лекарства от болезни Паркинсона. Хотя были указания на то, что использование агонистов дофамина с L-DOPA может вызвать психоз, поэтому рекомендуется либо прекратить использование агонистов дофамина, либо снизить дозу L-DOPA . Поскольку агонисты дофамина спорыньи обладают антигипертензивными свойствами, целесообразно контролировать артериальное давление при использовании агонистов дофамина с гипотензивными средствами.препараты для предотвращения гипотонии . Сюда входит препарат силденафил, который обычно используется для лечения эректильной дисфункции, но также применяется при легочной гипертензии . [18]
Существует доказательство того, что позволяет предположить , что , поскольку спорыньи агонисты допамина метаболизируется с помощью CYP3A4 концентрации фермента повышается с использованием ингибиторов CYP3A4. Например, в одном исследовании бромокриптин вводили с ингибитором CYP3A4, и AUC (например, площадь под кривой) увеличилась на 268%. Ропинирол является агонистом дофамина, не являющимся производным спорыньи, и одновременное применение с ингибитором CYP1A2 может привести к повышению концентрации ропинирола. При отмене ингибитора CYP1A2 , если используются оба препарата, требуется корректировка дозы ропинирола. Также есть доказательства того, что агонисты дофамина ингибируют различные ферменты CYP.и поэтому они могут подавлять метаболизм некоторых лекарств. [13]
Фармакология [ править ]
Класс Ergoline [ править ]
Фармакокинетика бромокриптина [ править ]
Поглощения в пероральной дозы составляет приблизительно 28% , однако, только 6% попадает в системный кровоток без изменений, из - за существенного эффекта первого прохода . Бромокриптин достигает средних пиковых уровней в плазме крови примерно через 1–1,5 часа после однократного перорального приема. Препарат имеет высокое связывание с белками , от 90 до 96% связывается с сывороточным альбумином . Бромокриптин метаболизируется с помощью CYP3A4 и выводится из организма преимущественно в кале через желчных секреции. Метаболиты и исходные лекарственные средства в основном выводятся через печень , но также 6% через почки . Оно имеетпериод полураспада 2-8 часов. [1]
Фармакокинетика перголида [ править ]
Перголид имеет длительный период полувыведения, составляющий около 27 часов, и достигает среднего пикового уровня в плазме крови примерно через 2-3 часа после однократного перорального приема. Связывание с белками составляет 90%, и препарат в основном метаболизируется в печени с помощью CYP3A4 и CYP2D6 . Основной путь выведения - через почки. [1] [19]
| Лекарство | Обслуживание | Период полураспада | Связывание с белками | Пиковая плазма | Метаболизм | Экскреция |
| Бромокриптин | Перорально, 2,5–40 мг / день | 2–8 часов | 90–96% | 1-1,5 часа | Печень, через CYP3A4, 93% метаболизма первого прохождения | Желчь, 94-98% Почечный, 2-6% |
| Перголид | Перорально, 0,05 мг / день Обычная реакция до 0,1 мг в день | 27 часов | 90% | 2–3 часа | Обширно печеночный | Почечный, 50% Кал 50% |
Класс, не относящийся к Ergoline [ править ]
Фармакокинетика прамипексола [ править ]
Прамипексол достигает максимальной концентрации в плазме крови через 1-3 часа после приема дозы. Он примерно на 15% связан с белками плазмы, а метаболизм минимален. Прамипексол имеет длительный период полувыведения, около 27 часов. Препарат в основном выводится с мочой, около 90%, но также и с калом. [1]
Фармакокинетика Ропинирола [ править ]
Ропинирол быстро всасывается после однократного перорального приема, достигая концентрации в плазме крови примерно через 1-2 часа. Период полувыведения составляет около 5–6 часов. Ропинирол интенсивно метаболизируется в печени, и исследования in vitro показывают, что фермент, участвующий в метаболизме ропинирола, - это CYP1A2 . [20]
Фармакокинетика ротиготина [ править ]
Поскольку ротиготин представляет собой трансдермальный пластырь, он обеспечивает непрерывную доставку лекарства в течение 24 часов. [21] Его период полураспада составляет 3 часа, а связывание с белками составляет около 92% in vitro и 89,5% in vivo . Ротиготин интенсивно и быстро метаболизируется в печени и ферментами CYP. Выводится в основном с мочой (71%), но также и с калом (23%). [1]
| Лекарство | Обслуживание | Период полураспада | Связывание с белками | Пиковая плазма | Метаболизм | Экскреция |
| Прамипексол | Перорально, 0,125 мг 3 раза в день (IR) Перорально, 0,375 мг / день (ER) | 8–12 часов | 15% | 1–3 часа | Минимум <10% | Моча 90% Кал 2% |
| Ропинирол | Перорально, 0,25 мг 3 раза в день (IR) Перорально, 2 мг / день (ER) | 5–6 часов | 10-40% | 1-2 часа | Печеночный, через P450 CYP1A2 - может увеличивать ↑ INR | Почек> 88% |
| Ротиготин | Трансдермальный, 2-4 мг / день | 3 часа | 92% | 24 часа | Печеночная (опосредованная CYP). | Моча 71% Кал 23% |
Механизм действия [ править ]
Рецепторы дофамина представляют собой 7- трансмембранные домены и являются членами суперсемейства рецепторов, связанных с G-белком (GPCR) . Рецепторы допамина имеют пять подтипов, от D 1 до D 5 , подтипы можно разделить на два подкласса из-за их механизма действия на фермент аденилатциклазы , D 1 -подобные рецепторы (D 1 и D 5 ) и D 2- подобные рецепторы ( D 2 , D 3 и D 4 ). D 1 -подобные рецепторы в первую очередь связаны с Gα s / olfбелков и активирует аденилатциклазу, которая увеличивает внутриклеточные уровни цАМФ , они также активируют комплекс Gβγ и канал Ca 2+ N-типа . D 2 -подобные рецепторы снижают внутриклеточные уровни вторичного мессенджера цАМФ путем ингибирования аденилатциклазы. [22] [23]
Бромокриптин [ править ]
Бромокриптин - производное спорыньи, полусинтетическое. Бромокриптин является агонистом рецептора D 2 и антагонистом рецептора D 1 со сродством связывания с рецепторами D 2 клеток передней доли гипофиза, исключительно на лактотрофах. Бромокриптин стимулирует активность Na + , K + -АТФазы и / или повышение цитозольного Ca 2+ и, следовательно, снижение пролактина, что приводит к отсутствию продукции цАМФ.
Прамипексол [ править ]
Прамипексол является высокоактивным агонистом D 2 -подобных рецепторов спорыньи с более высокой аффинностью связывания с рецепторами D 3 , чем с рецепторами D 2 или D 4 . Механизм действия прамипексола в основном неизвестен, предполагается, что он участвует в активации дофаминовых рецепторов в той области мозга, где расположены полосатое тело и черная субстанция. Эта стимуляция дофаминовых рецепторов в полосатом теле может улучшить двигательную способность. [24]
Взаимосвязь между структурой и деятельностью [ править ]
При работе с агонистами может быть чрезвычайно сложно подтвердить взаимосвязь между структурой и биологической активностью. Агонисты вызывают ответы от живых тканей . Следовательно, их активность зависит как от их способности активировать рецепторы, так и от их способности связываться с рецепторами. [25]
Преодоление гематоэнцефалического барьера [ править ]
Многие молекулы не могут преодолевать гематоэнцефалический барьер (ГЭБ). Молекулы должны быть небольшими, неполярными и липофильными, чтобы они могли пересекаться. Если соединения не обладают этими качествами, они должны иметь специальный транспортер, который может транспортировать их по ГЭБ. [26] Дофамин не может диффундировать через ГЭБ из-за группы катехолов , он слишком полярен и, следовательно, не может проникать в мозг. Группа катехина является дигидрокси бензольное кольцо.
Синтез дофамина состоит из трех стадий. Процесс синтеза начинается с аминокислоты, называемой L-тирозином . На второй стадии леводопа (L-допа) образуется путем добавления фенольной группы к бензольному кольцу L-тирозина. Образование L-допа из L-тирозина катализируется ферментом тирозингидроксилазой. Третья стадия - образование дофамина за счет удаления группы карбоновой кислоты из L-допа, катализируемое ферментом допа-декарбоксилазой. [27]
Леводопа также слишком полярна, чтобы преодолевать гематоэнцефалический барьер, но это аминокислота, поэтому у нее есть специальный переносчик, называемый переносчиком аминокислот L-типа или LAT-1, который помогает ей диффундировать через барьер. [28]
Дофамин [ править ]
Когда дофамин взаимодействует с АТФ, который является компонентом некоторых дофаминовых рецепторов, он имеет значительное предпочтение в пользу транс-конформации молекулы дофамина. Комплекс дофамин-АТФ стабилизируется водородными связями между гидроксилами катехина и пуриновыми атомами азота и электростатическими взаимодействиями между протонированной аммониевой группой дофамина и отрицательной фосфатной группой. Два конформера дофамина были идентифицированы как альфа- и бета-конформеры, в которых кольцо катехина копланарно плоскости боковой цепи этиламина . Они играют важную роль во взаимодействиях агонист-рецептор. [29]
Производные эрголина [ править ]
Центральные свойства дофаминергических агонистов полусинтетических эрголина производных lergotrile, перголид , бромокриптин и лизурид были установлены. Некоторые исследования предполагают, что алкалоиды спорыньи обладают свойствами смешанного агониста-антагониста в отношении определенных пресинаптических и постсинаптических рецепторов. NN- пропильную группы (химическая формула: -СН 2 СН 2 СН 3 ) часто повышения агонист дофамина эффектов в производных эрголина.
(+) - энантиомер проявляет заметно пониженную активность, тогда как (-) - энантиомер обладает сильными агонистическими свойствами дофамина. [29]
Бромокриптин [ править ]
Бромокриптин имеет структуру алкалоида спорыньи. Алкалоиды спорыньи делятся на 2 группы; аминокислотные алкалоиды спорыньи и аминовые алкалоиды спорыньи, бромокриптин является частью первой группы. [30] Он содержит галоген брома в структуре спорыньи, который увеличивает сродство к D 2 -рецептору, но часто снижает эффективность. Сходство между структурой дофамина и эрголиновым кольцом в бромокриптине, вероятно, является причиной его действия на рецепторы дофамина. [31] Было показано, что он имеет одинаковое сродство к D 2- и D 3 -рецепторам и гораздо более низкое сродство к D 1 -рецепторам. [32]
Неэрголиновые производные [ править ]
Неэрголиновые агонисты дофаминовых рецепторов обладают более высоким сродством связывания с дофаминовыми D 3 -рецепторами, чем дофаминовые D 2 -рецепторы. Эта аффинность связывания связана с гомологией рецепторов D 2 и D 3 , гомология между ними имеет высокую степень последовательности и наиболее близка в их трансмембранных доменах, где они разделяют около 75% аминокислот. [33]
Апоморфин [ править ]
Апоморфин содержит катехол и относится к классу β-фенилэтиламинов, а его основные компоненты аналогичны структуре дофамина. Эффект, который апоморфин оказывает на дофаминовые рецепторы, также может быть связан со сходством его структуры с дофамином. [34] Это хиральная молекула и, таким образом, может быть приобретена как в R-, так и в S-форме. R-форма используется в терапии. Когда апоморфин взаимодействует с дофаминовым рецептором или АТФна рецепторе катехол и азот важны для стабилизации структуры за счет водородных связей. Положение гидроксильных групп также важно, и было обнаружено, что моногидроксипроизводные менее эффективны, чем дигидроксигруппы. Апоморфин вызывает ряд проблем со стабильностью, таких как окисление и рацемизация. [35]
Ротиготин [ править ]
Ротиготин является фенольным амином и поэтому имеет низкую биодоступность при пероральном приеме и быстрое выведение из организма. Поэтому он был разработан как трансдермальный пластырь , в первую очередь, для предотвращения метаболизма первого прохождения в печени. [36]
Члены [ править ]
Примеры агонистов дофамина включают:
Частичный агонист [ править ]
- Арипипразол (частичный агонист рецепторов семейства D 2 - торговое название «Abilify» в США; атипичный антипсихотик )
- Фенциклидин (также известный как PCP; частичный агонист. Психоактивность в основном обусловлена антагонизмом NMDA )
- Квинпирол (частичный агонист рецепторов семейства D 2 и D 3 )
- Сальвинорин A (главный активный компонент психоделического растения salvia divinorum , психоактивность которого в основном обусловлена агонизмом каппа-опиоидных рецепторов ; частичный агонист в D 2 с внутренней активностью 40-60%, аффинность связывания K i = 5 -10нМ и EC 50 = 50-90нМ) [37]
Агонисты полной / неизвестной эффективности [ править ]
- Апоморфин (Апокин - используется для лечения болезни Паркинсона и синдрома беспокойных ног ) - смещен на рецептор D1. [38]
- Бромокриптин (Парлодел - используется для лечения БП / СБН )
- Каберголин (Достинекс - используется для лечения PD / RLS)
- Циладопа (используется для лечения PD / RLS)
- Дигидрексидин (используется для лечения PD / RLS)
- Динапсолин (используется для лечения БП / СБН)
- Доксантрин (используется для лечения БП / СБН)
- Эпикриптин (используется для лечения БП / СБН)
- Лизурид (используется для лечения БП / СБН)
- Перголид (используемый для лечения PD / RLS) - ранее доступный как Permax, но снятый с рынка в США 29 марта 2007 г. [39]
- Пирибедил (Проноран и Тривастал - используется для лечения БП / СБН)
- Прамипексол ( Мирапекс и Сифрол - используется для лечения БП / СБН)
- Пропилнорапоморфин (используется для лечения БП / СБН)
- Хинаголид (Норпролак - используется для лечения БП / СБН)
- Ропинирол (Requip [40] - используется для лечения PD / RLS)
- Ротиготин (Neupro - используется для лечения PD / RLS)
- Роксиндол (используется для лечения БП / СБН)
- Суманирол (используется для лечения БП / СБН)
Некоторые из них, например фенолдопам , селективны в отношении дофаминового рецептора D1 . [41]
Косвенные агонисты [ править ]
Существует два класса лекарств, которые действуют как непрямые агонисты дофаминовых рецепторов: ингибиторы обратного захвата дофамина и агенты, высвобождающие дофамин .
К наиболее часто назначаемым непрямым агонистам дофаминовых рецепторов относятся:
- Амфетамин и / или декстроамфетамин (используются для лечения СДВГ , нарколепсии и ожирения )
- Бупропион (используется для облегчения отказа от курения и лечения никотиновой зависимости и клинической депрессии )
- Лисдексамфетамин (используется для лечения СДВГ и компульсивного переедания )
- Метилфенидат или дексметилфенидат (используется для лечения СДВГ и нарколепсии )
Другие примеры включают:
- Катинон
- Кокаин ( анестетик, не имеющий медицинского применения в качестве стимулятора центральной нервной системы )
- Метамфетамин (используется в редких случаях для лечения СДВГ и ожирения )
- Фенэтиламин (эндогенный следовой амин )
- п- тирамин (эндогенный следовой амин )
История [ править ]
С конца 1960 года леводопа (L-ДОПА) использовалась для лечения болезни Паркинсона, но всегда велись споры о том, стоит ли лечение побочных эффектов . [42] Примерно в 1970 году врачи начали использовать апоморфин, агонист дофамина, вместе с L-DOPA, чтобы минимизировать побочные эффекты, вызванные L-DOPA, агонисты дофамина связываются с рецептором дофамина в отсутствие дофамина. Апоморфин имел ограниченное применение, поскольку он имел значительные побочные эффекты и трудности с введением. В 1974 году бромокриптин получил широкое распространение после того, как врачи обнаружили его преимущества при лечении болезни Паркинсона . [43] При использовании двухВместе с классами лекарств существует возможность снизить количество L-DOPA на 20-30% и, таким образом, свести к минимуму колеблющиеся двигательные реакции. [5] Агонисты дофамина часто используются у молодых людей в качестве монотерапии и в качестве начальной терапии вместо L-DOPA. [5] Хотя важно знать, что между двумя препаратами существует корреляция, если l-ДОФА не действует, агонисты дофамина также неэффективны. [1]
Ранние агонисты дофамина, такие как бромокриптин, были производными спорыньи и активировали D 2 -рецептор. [5] Они вызывали серьезные побочные эффекты, такие как фиброз сердечных клапанов. Считается, что причиной таких побочных эффектов является то, что они активируют многие типы рецепторов. [1]
Из-за серьезных побочных эффектов агонистов дофамина, полученных из спорыньи, они, как правило, больше не используются и от них отказались в пользу агонистов, не являющихся агонистами спорыньи, таких как прамипексол , ропинирол и ротиготин . Они не вызывают серьезных побочных эффектов, хотя наиболее частыми побочными эффектами являются тошнота , отек и гипотензия . Пациенты также показали нарушение контроля над импульсами, такими как чрезмерные траты , гиперсексуальность и азартные игры . [44]
См. Также [ править ]
- Антагонист дофамина
- Ингибитор обратного захвата дофамина
- рецептор агонистом
- Агонист рецептора ГАМК
- Дофаминергический
- Агонист серотонина
- Адренергический агонист ( симпатомиметик )
- Парасимпатомиметический препарат (агонист ацетилхолина)
- Агонист гистамина
Ссылки [ править ]
- ^ Б с д е е г ч я J к л м Borovac JA (март 2016). «Побочные эффекты терапии агонистами дофамина при болезни Паркинсона: мини-обзор клинической фармакологии» . Йельский журнал биологии и медицины . 89 (1): 37–47. PMC 4797835 . PMID 27505015 .
- ^ a b Сильва М.А., Маттерн С., Хеккер Р., Томаз С., Хьюстон Дж. П., Швартинг Р. К. (декабрь 1997 г.). «Повышенная неостриатальная активность дофамина после внутрибрюшинного или интраназального введения L-DOPA: о роли предварительной обработки бенсеразидом». Синапс . 27 (4): 294–302. DOI : 10.1002 / (sici) 1098-2396 (199712) 27: 4 <294 :: aid-syn3> 3.3.co; 2-z . PMID 9372552 .
- ^ Хауэс ОД, Маккатчеон R, Оуэн МДж, Мюррей Р. (январь 2017 г.). «Роль генов, стресса и дофамина в развитии шизофрении» . Биологическая психиатрия . 81 (1): 9–20. DOI : 10.1016 / j.biopsych.2016.07.014 . PMC 5675052 . PMID 27720198 .
- ^ DeMaagd G, Philip A (август 2015). «Болезнь Паркинсона и ее лечение: Часть 1: сущность заболевания, факторы риска, патофизиология, клинические проявления и диагностика» . P&T . 40 (8): 504–32. PMC 4517533 . PMID 26236139 .
- ^ a b c d Брукс DJ (июнь 2000 г.). «Агонисты дофамина: их роль в лечении болезни Паркинсона» . Журнал неврологии, нейрохирургии и психиатрии . 68 (6): 685–9. DOI : 10.1136 / jnnp.68.6.685 . PMC 1736955 . PMID 10811688 .
- ^ a b Barone P (март 2011 г.). «Лечение депрессивных симптомов при болезни Паркинсона». Европейский журнал неврологии . 18 Дополнение 1: 11–5. DOI : 10.1111 / j.1468-1331.2010.03325.x . PMID 21255198 .
- ^ Leentjens AF (февраль 2011). «Роль агонистов дофамина в лечении депрессии у пациентов с болезнью Паркинсона: систематический обзор». Наркотики . 71 (3): 273–86. DOI : 10.2165 / 11585380-000000000-00000 . PMID 21319866 . S2CID 38988462 .
- ^ Манчини, Татьяна; Casanueva, Felipe F .; Джустина, Андреа (2008-03-01). «Гиперпролактинемия и пролактиномы». Клиники эндокринологии и обмена веществ Северной Америки . Заболевания гипофиза. 37 (1): 67–99. DOI : 10.1016 / j.ecl.2007.10.013 . ISSN 0889-8529 . PMID 18226731 .
- ^ Verhelst, Йохан; Абс, Роджер; Мейтер, Доминик; ван ден Брюэль, Анник; Вандевеге, Марк; Велкенирс, Бриджит; Мокель, Жан; Ламберигтс, Жерар; Петросян, Патрик; Корманс, Питер; Малер, Чарльз (1999-07-01). «Каберголин в лечении гиперпролактинемии: исследование на 455 пациентах» . Журнал клинической эндокринологии и метаболизма . 84 (7): 2518–2522. DOI : 10,1210 / jcem.84.7.5810 . ISSN 0021-972X . PMID 10404830 .
- ^ Вебстер, Джонатан; Пискителли, Габриэлла; Полли, Анна; Феррари, Карло I .; Исмаил, Икрам; Скэнлон, Морис Ф. (1994-10-06). «Сравнение каберголина и бромокриптина в лечении гиперпролактинемической аменореи». Медицинский журнал Новой Англии . 331 (14): 904–909. DOI : 10.1056 / NEJM199410063311403 . ISSN 0028-4793 . PMID 7915824 .
- ^ Zintzaras E, Kitsios GD, Papathanasiou А.А., Konitsiotis S, M Miligkos, Rodopoulou P, Хаджигеоргиу GM (февраль 2010). «Рандомизированные испытания агонистов дофамина при синдроме беспокойных ног: систематический обзор, оценка качества и метаанализ». Клиническая терапия . 32 (2): 221–37. DOI : 10.1016 / j.clinthera.2010.01.028 . PMID 20206780 .
- ^ a b Мур Т.Дж., Гленмуллен Дж., Мэттисон Д.Р. (декабрь 2014 г.). «Сообщения о патологической азартной игре, гиперсексуальности и навязчивых покупках, связанных с препаратами-агонистами дофаминовых рецепторов» . JAMA Internal Medicine . 174 (12): 1930–3. DOI : 10,1001 / jamainternmed.2014.5262 . PMID 25329919 .
- ^ a b c Kvernmo T, Härtter S, Burger E (август 2006 г.). «Обзор рецептор-связывающих и фармакокинетических свойств агонистов дофамина». Клиническая терапия . 28 (8): 1065–1078. DOI : 10.1016 / j.clinthera.2006.08.004 . PMID 16982285 .
- ↑ Peralta C, Wolf E, Alber H, Seppi K, Müller S, Bösch S и др. (Август 2006 г.). «Пороки сердца при болезни Паркинсона по сравнению с контролем: эхокардиографическое исследование». Расстройства движения . 21 (8): 1109–13. DOI : 10.1002 / mds.20887 . PMID 16622856 .
- Перейти ↑ Wood LD (апрель 2010 г.). «Клинический обзор и лечение избранных побочных эффектов агонистов дофаминовых рецепторов при болезни Паркинсона». Наркотики и старение . 27 (4): 295–310. DOI : 10.2165 / 11318330-000000000-00000 . PMID 20359261 . S2CID 21096318 .
- ^ Tholfsen ЛК, Ларсен ДП, Шульц - J, Tysnes О.Б., Gjerstad MD (июль 2015). «Развитие чрезмерной дневной сонливости при ранней стадии болезни Паркинсона». Неврология . 85 (2): 162–8. DOI : 10,1212 / WNL.0000000000001737 . PMID 26085603 . S2CID 17598980 .
- ^ Ниренбергу MJ (август 2013). «Синдром отмены агонистов дофамина: значение для ухода за пациентами». Наркотики и старение . 30 (8): 587–92. DOI : 10.1007 / s40266-013-0090-Z . PMID 23686524 . S2CID 207489653 .
- ↑ Jost WH, Brück C (октябрь 2002 г.). «Лекарственные взаимодействия при лечении болезни Паркинсона». Журнал неврологии . 249 Suppl 3: III / 24–9. DOI : 10.1007 / s00415-002-1305-0 . PMID 12522568 . S2CID 39469174 .
- ^ Blin O (декабрь 2003). «Фармакокинетика перголида при болезни Паркинсона». Текущее мнение в неврологии . 16 Дополнение 1: S9-12. DOI : 10.1097 / 00019052-200312001-00003 . PMID 15180132 . S2CID 1734931 .
- ^ Kaye CM, Николс B (октябрь 2000). «Клиническая фармакокинетика ропинирола». Клиническая фармакокинетика . 39 (4): 243–54. DOI : 10.2165 / 00003088-200039040-00001 . PMID 11069211 . S2CID 9977681 .
- ^ Elshoff ДП, Cawello Вт, Андреас JO, Mathy FX, Браун М (апрель 2015 г.). «Обновленная информация о фармакологических, фармакокинетических свойствах и лекарственном взаимодействии трансдермальной системы ротиготина при болезни Паркинсона и синдроме беспокойных ног» . Наркотики . 75 (5): 487–501. DOI : 10.1007 / s40265-015-0377-у . PMC 4382528 . PMID 25795100 .
- ^ Петерсон С.М., Урс Н., Карон М.Г. (01.01.2012), Робертсон Д., Бьяджони И., Бернсток Г., Низкий ПА (ред.), «Глава 13 - Дофаминовые рецепторы», Учебник по вегетативной нервной системе (третье издание ) , Academic Press, стр. 67–70, DOI : 10.1016 / B978-0-12-386525-0.00013-5 , ISBN 9780123865250
- ^ «Дофамин D 1 -Подобные сигнальные пути семейства рецепторов» . www.rndsystems.com . Проверено 8 октября 2019 .
- ^ Weng JJ, Wang LH, Zhu H, Xu WR, Wei YM, Wang ZY, et al. (2019). «3 частичных агониста прамипексола в отношении вызванных нейролептиками экстрапирамидных симптомов и симптомов шизофрении: открытое пилотное исследование стадии 1» . Психоневрологические заболевания и лечение . 15 : 2195–2203. DOI : 10,2147 / NDT.S205933 . PMC 6689661 . PMID 31496702 .
- ^ Ravikumar K, Шридхар B (май 2006). «Ропинирола гидрохлорид, агонист дофамина». Acta Crystallographica Раздел C . 62 (Pt 5): o265-7. DOI : 10.1107 / S0108270106010535 . PMID 16679599 .
- ^ Банки WA (июнь 2009 г.). «Характеристики соединений, проникающих через гематоэнцефалический барьер» . BMC Neurology . 9 Дополнение 1 (Дополнение 1): S3. DOI : 10.1186 / 1471-2377-9-S1-S3 . PMC 2697631 . PMID 19534732 .
- ^ Лучший JA, Nijhout HF, Reed MC (сентябрь 2009). «Гомеостатические механизмы в синтезе и высвобождении дофамина: математическая модель» . Теоретическая биология и медицинское моделирование . 6 (1): 21. DOI : 10,1186 / 1742-4682-6-21 . PMC 2755466 . PMID 19740446 .
- ^ Кагеяма Т., Накамура М., Мацуо А., Ямасаки Ю., Такакура Ю., Хашида М. и др. (Октябрь 2000 г.). «Комплекс 4F2hc / LAT1 транспортирует L-DOPA через гематоэнцефалический барьер». Исследование мозга . 879 (1–2): 115–21. DOI : 10.1016 / s0006-8993 (00) 02758-X . PMID 11011012 . S2CID 33605179 .
- ^ a b Cannon JG (1983). «Взаимосвязь между структурой и активностью агонистов дофамина». Ежегодный обзор фармакологии и токсикологии . 23 : 103–29. DOI : 10.1146 / annurev.pa.23.040183.000535 . PMID 6347047 .
- ^ ОДА Т, Т Кумэ, Izumi Y, Такада-Такатори Y, Niidome Т, Акаик А (ноябрь 2008 г.). «Бромокриптин, агонист дофаминового рецептора D (2) со структурой аминокислотных алкалоидов спорыньи, вызывает рост нейритов в клетках PC12». Европейский журнал фармакологии . 598 (1–3): 27–31. DOI : 10.1016 / j.ejphar.2008.09.015 . PMID 18835264 .
- ^ Маркштейна R, Seiler MP, Jaton A, Брайнер U (март 1992). «Взаимосвязь структуры активности и терапевтического использования дофаминергических эрготов». Neurochemistry International . Сателлитная встреча XI Международного фармакологического конгресса. 20 (Прил.): 211С – 214С. DOI : 10.1016 / 0197-0186 (92) 90241-I . PMID 1365428 . S2CID 27230073 .
- ^ Perachon S, Schwartz JC, Sokoloff P (февраль 1999). «Функциональные возможности новых противопаркинсонических препаратов в отношении рекомбинантных человеческих дофаминовых рецепторов D1, D2 и D3». Европейский журнал фармакологии . 366 (2–3): 293–300. DOI : 10.1016 / S0014-2999 (98) 00896-6 . PMID 10082211 .
- ↑ Platania CB, Salomone S, Leggio GM, Drago F, Bucolo C (06.09.2012). «Гомологическое моделирование дофаминовых рецепторов D2 и D3: уточнение молекулярной динамики и оценка стыковки» . PLOS ONE . 7 (9): e44316. Bibcode : 2012PLoSO ... 744316P . DOI : 10.1371 / journal.pone.0044316 . PMC 3435408 . PMID 22970199 .
- ^ Borkar N, Му Н, Холм R (2018-11-01). «Проблемы и тенденции в системах доставки апоморфина для лечения болезни Паркинсона» . Азиатский журнал фармацевтических наук . Стратегии составления и производственные технологии для улучшения неинвазивной доставки лекарств. 13 (6): 507–517. DOI : 10.1016 / j.ajps.2017.11.004 . ISSN 1818-0876 . PMC 7032113 . PMID 32104425 .
- ^ Subramony JA (2006). «Апоморфин в дофаминергической терапии». Молекулярная фармацевтика . 3 (4): 380–5. DOI : 10.1021 / mp060012c . PMID 16889431 .
- ^ Risgaard R, Jensen M, Jørgensen M, Bang-Andersen B, Christoffersen CT, Jensen KG и др. (Январь 2014). «Синтез и исследование SAR новой серии агонистов дофаминовых рецепторов». Биоорганическая и медицинская химия . 22 (1): 381–92. DOI : 10.1016 / j.bmc.2013.11.012 . PMID 24296012 .
- ^ Симэн P, Гуань HC, Hirbec H (2009). «Рецепторы допамина D2High, стимулируемые фенциклидинами, диэтиламидом лизергиновой кислоты, сальвинорином А и модафинилом». Синапс . 63 (8): 698–704. DOI : 10.1002 / syn.20647 . PMID 19391150 .
- ↑ Conroy JL, Free RB, Sibley DR (апрель 2015 г.). «Идентификация агонистов с предвзятым отношением к G-белку, которые не могут рекрутировать β-аррестин или способствовать интернализации рецептора допамина D1» . ACS Chemical Neuroscience . 6 (4): 681–92. DOI : 10.1021 / acschemneuro.5b00020 . PMC 5234767 . PMID 25660762 .
- ^ FDA объявляет о добровольном прекращении использования перголидов
- ^ Матера C, M Quadri, Pelucchi S, De Amici M, Dallanoce C (17 апреля 2014). «Удобный синтез 4- (2-гидроксиэтил) индолин-2-она, полезного промежуточного соединения для получения как агонистов рецептора допамина, так и ингибиторов протеинкиназы». Monatshefte für Chemie . 145 (7): 1139–1144. DOI : 10.1007 / s00706-014-1211-Z . S2CID 84265684 .
- ↑ Ng SS, Pang CC (март 2000). «In vivo венодилатирующее действие фенолдопама, агониста дофаминовых D (1) -рецепторов» . Британский журнал фармакологии . 129 (5): 853–8. DOI : 10.1038 / sj.bjp.0703119 . PMC 1571905 . PMID 10696081 .
- ^ Чжан Дж, Тан LC (2016-04-08). «Пересмотр медицинского лечения болезни Паркинсона: леводопа против агониста дофамина» . Современная нейрофармакология . 14 (4): 356–63. DOI : 10.2174 / 1570159X14666151208114634 . PMC 4876591 . PMID 26644151 .
- ^ Толоза E, Martí MJ, Valldeoriola F, Молинуэво JL (июнь 1998). «История леводопы и агонистов дофамина в лечении болезни Паркинсона». Неврология . 50 (6 Suppl 6): S2–10, обсуждение S44–8. DOI : 10,1212 / wnl.50.6_suppl_6.s2 . PMID 9633679 . S2CID 25603106 .
- Перейти ↑ Golan DE, Armstrong EJ, Armstrong AW (2017). Принципы фармакологии - патофизиологическая основа лекарственной терапии . Филадельфия: Вольтерс Клувер. С. 214–215. ISBN 9781451191004.
Дальнейшее чтение [ править ]
- Avanzi M, Uber E, Bonfà F (июнь 2004 г.). «Патологическая склонность к азартным играм у двух пациентов, получающих дофаминовую заместительную терапию болезни Паркинсона». Неврологические науки . 25 (2): 98–101. DOI : 10.1007 / s10072-004-0238-Z . PMID 15221629 . S2CID 21255326 .
Внешние ссылки [ править ]
- Дофамин + агонисты в медицинских предметных рубриках Национальной медицинской библиотеки США (MeSH)