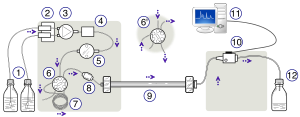
 ВЭЖХ. Слева направо: насосное устройство, создающее градиент двух разных растворителей - армированная сталью колонка и детектор для измерения оптической плотности. | |
| Акроним | ВЭЖХ |
|---|---|
| Классификация | Хроматография |
| Аналиты | органические молекулы биомолекулы ионы полимеры |
| Другие техники | |
| Связанный | Хроматография Водная нормально-фазовая хроматография Гидрофильное взаимодействие Хроматография Ионообменная хроматография Эксклюзионная хроматография Мицеллярная жидкостная хроматография |
| С переносом | Жидкостная хроматография-масс-спектрометрия |
Высокоэффективная жидкостная хроматография ( ВЭЖХ ), ранее называвшаяся жидкостной хроматографией высокого давления , представляет собой метод аналитической химии, используемый для разделения, идентификации и количественного определения каждого компонента в смеси. Он основан на насосах для пропускания жидкого растворителя под давлением, содержащего смесь образцов, через колонку, заполненную твердым адсорбирующим материалом . Каждый компонент в образце немного по-разному взаимодействует с адсорбирующим материалом, вызывая разную скорость потока для разных компонентов и приводя к разделению компонентов при их выходе из колонки.
ВЭЖХ использовалась для производства ( например , в процессе производства фармацевтических и биологических продуктов), в юридических целях ( например , для обнаружения лекарств, повышающих эффективность в моче), в исследованиях ( например , для разделения компонентов сложного биологического образца или аналогичных синтетических химикатов. друг от друга), так и в медицинских ( например , определение уровня витамина D в сыворотке крови) в целях. [1]
Хроматографию можно описать как процесс массопереноса, включающий адсорбцию . В ВЭЖХ используются насосы для пропускания жидкости под давлением и смеси пробы через колонку, заполненную адсорбентом, что приводит к разделению компонентов пробы. Активный компонент колонки, адсорбент, обычно представляет собой гранулированный материал, состоящий из твердых частиц ( например , кремнезема , полимеров и т. Д.), Размером 2–50 мкм. Компоненты смеси образцов отделены друг от друга из-за разной степени взаимодействия с частицами адсорбента. Жидкость под давлением обычно представляет собой смесь растворителей ( например,, вода, ацетонитрил и / или метанол) и называется «подвижной фазой». Его состав и температура играют важную роль в процессе разделения, влияя на взаимодействия, происходящие между компонентами образца и адсорбентом. Эти взаимодействия имеют физическую природу, такие как гидрофобные (дисперсионные), диполь-дипольные и ионные, чаще всего их сочетание.
ВЭЖХ отличается от традиционной жидкостной хроматографии («низкого давления») тем, что рабочее давление значительно выше (50–350 бар), в то время как обычная жидкостная хроматография обычно полагается на силу тяжести для прохождения подвижной фазы через колонку. Из-за небольшого количества образца, отделяемого при аналитической ВЭЖХ, типичные размеры колонки составляют 2,1–4,6 мм в диаметре и 30–250 мм в длину. Также колонки для ВЭЖХ изготавливаются с более мелкими частицами адсорбента (средний размер частиц 2–50 мкм). Это дает ВЭЖХ превосходную разрешающую способность (способность различать соединения) при разделении смесей, что делает его популярным хроматографическим методом.
Схема прибора для ВЭЖХ обычно включает дегазатор, пробоотборник, насосы и детектор. Пробоотборник подает смесь пробы в поток подвижной фазы, который переносит ее в колонку. Насосы подают через колонку требуемый поток и состав подвижной фазы. Детектор генерирует сигнал, пропорциональный количеству компонента пробы, выходящего из колонки, что позволяет проводить количественный анализ компонентов пробы. Цифровой микропроцессор и программное обеспечение пользователя управляют прибором ВЭЖХ и обеспечивают анализ данных. Некоторые модели механических насосов в приборе для ВЭЖХ могут смешивать несколько растворителей вместе в соотношениях, изменяющихся во времени, создавая градиент состава.в мобильной фазе. Широко используются различные детекторы, такие как УФ / видимые детекторы , фотодиодные матрицы (КПК) или основанные на масс-спектрометрии . Большинство приборов для ВЭЖХ также имеют термостат колонок, который позволяет регулировать температуру, при которой выполняется разделение.
Операция [ править ]
Смесь проб, которую нужно разделить и проанализировать, вводят в дискретном небольшом объеме (обычно в микролитрах) в поток подвижной фазы, просачивающейся через колонку. Компоненты образца движутся через колонку с разными скоростями, которые зависят от конкретных физических взаимодействий с адсорбентом (также называемого стационарной фазой). Скорость каждого компонента зависит от его химической природы, от природы неподвижной фазы (колонки) и от состава подвижной фазы. Время, в которое конкретный аналит элюируется (выходит из колонки), называется временем его удерживания. Время удерживания, измеренное при определенных условиях, является отличительной характеристикой данного аналита.
Доступно множество различных типов колонок, заполненных адсорбентами, различающимися по размеру частиц и характеру их поверхности («химия поверхности»). Использование материалов набивки с частицами меньшего размера требует использования более высокого рабочего давления («противодавление») и обычно улучшает хроматографическое разрешение (степень разделения пиков между последовательными аналитами, выходящими из колонки). Частицы сорбента могут быть гидрофобными или полярными по природе.
Обычно используемые подвижные фазы включают любую смешивающуюся комбинацию воды с различными органическими растворителями (наиболее распространенными являются ацетонитрил и метанол ). В некоторых методах ВЭЖХ используются безводные подвижные фазы (см. Нормально-фазовую хроматографию ниже). Водный компонент подвижной фазы может содержать кислоты (такие как муравьиная, фосфорная или трифторуксусная кислота.) или соли, чтобы помочь в разделении компонентов пробы. Состав подвижной фазы может поддерживаться постоянным («режим изократического элюирования») или изменяться («режим градиентного элюирования») во время хроматографического анализа. Изократическое элюирование обычно эффективно для разделения компонентов пробы, которые сильно различаются по сродству к неподвижной фазе. При градиентном элюировании состав подвижной фазы обычно варьируется от низкой до высокой элюирующей силы. Сила элюирования подвижной фазы отражается временем удерживания анализируемого вещества с высокой силой элюирования, обеспечивающей быстрое элюирование (= короткое время удерживания). Типичный профиль градиента в обращенно-фазовой хроматографии может начинаться с 5% ацетонитрила (в воде или водном буфере) и линейно прогрессировать до 95% ацетонитрила в течение 5–25 минут.Периоды постоянного состава подвижной фазы могут быть частью любого профиля градиента. Например, состав подвижной фазы может поддерживаться постоянным при 5% ацетонитриле в течение 1–3 мин с последующим линейным изменением до 95% ацетонитрила.
Выбранный состав подвижной фазы (также называемой элюентом) зависит от интенсивности взаимодействий между различными компонентами образца («аналиты») и неподвижной фазой ( например , гидрофобные взаимодействия в обращенно-фазовой ВЭЖХ). В зависимости от их сродства к неподвижной и подвижной фазам аналиты распределяются между ними во время процесса разделения, происходящего в колонке. Этот процесс разделения аналогичен тому, который происходит при экстракции жидкость-жидкость, но является непрерывным, а не ступенчатым. В этом примере, используя градиент вода / ацетонитрил, больше гидрофобных компонентов будет элюироваться (выходить из колонки) поздно, когда подвижная фаза станет более концентрированной в ацетонитриле ( т. Е., в подвижной фазе с более высокой элюирующей способностью).
Выбор компонентов подвижной фазы, добавок (таких как соли или кислоты) и условий градиента зависит от природы компонентов колонки и пробы. Часто с образцом проводится серия пробных прогонов, чтобы найти метод ВЭЖХ, который дает адекватное разделение.
История и развитие [ править ]
До ВЭЖХ ученые использовали стандартные методы жидкостной хроматографии. Системы жидкостной хроматографии были в значительной степени неэффективными из-за того, что расход растворителей зависел от силы тяжести. Разделение занимало много часов, а иногда и дней. Газовая хроматография (ГХ) в то время была более мощной, чем жидкостная хроматография (ЖХ), однако считалось, что газофазное разделение и анализ очень полярных высокомолекулярных биополимеров были невозможны. [3] ГХ был неэффективен для многих биохимиков из-за термической нестабильности растворенных веществ. [4] В результате были выдвинуты гипотезы об альтернативных методах, которые вскоре приведут к развитию ВЭЖХ.
Следуя основополагающей работе Мартина и Синджа в 1941 году, в 1960-х годах Кэлом Гиддингсом, Йозефом Хубером и другими было предсказано, что ЖК может работать в высокоэффективном режиме за счет уменьшения диаметра частиц упаковки, существенно ниже типичного ЖК. (и GC) на уровне 150 мкм и с использованием давления для увеличения скорости подвижной фазы. [3] Эти прогнозы подверглись обширным экспериментам и уточнениям на протяжении 60–70-х годов. На ранних этапах разработки были начаты исследования по улучшению ЖК-частиц, и изобретение Zipax, поверхностно пористой частицы, было многообещающим для технологии ВЭЖХ. [5]
1970-е годы принесли много разработок в области аппаратного и измерительного оборудования. Исследователи начали использовать насосы и инжекторы для создания элементарной конструкции системы ВЭЖХ. [6] Насосы-усилители газа были идеальными, потому что они работали при постоянном давлении и не требовали герметичных уплотнений или обратных клапанов для стабильного потока и хорошего количественного определения. [4] В Dupont IPD (подразделение промышленных полимеров) были достигнуты вехи в области аппаратного обеспечения, такие как использование градиентного устройства с низким внутренним объемом, а также замена инжектора перегородки на клапан впрыска петли. [4]
Хотя инструментальные разработки были важны, история ВЭЖХ в первую очередь связана с историей и эволюцией технологии частиц . [4] После введения частиц пористого слоя наблюдается устойчивая тенденция к уменьшению размера частиц для повышения эффективности. [4] Однако из-за уменьшения размера частиц возникли новые проблемы. Практические недостатки проистекают из чрезмерного перепада давления, необходимого для проталкивания подвижной жидкости через колонну, и сложности изготовления однородной насадки из чрезвычайно мелких материалов. [7] Каждый раз, когда размер частиц значительно уменьшается, обычно приходится проводить еще один этап разработки прибора, чтобы справиться с давлением. [4]
Типы [ править ]
Разделительная хроматография [ править ]
Распределительная хроматография была одним из первых видов хроматографии, разработанных химиками. [8] Принцип коэффициента распределения применяется в бумажной хроматографии , тонкослойной хроматографии , газовой фазе и разделении жидкость-жидкость . Нобелевскую премию по химии 1952 года получили Арчер Джон Портер Мартин и Ричард Лоуренс Миллингтон Синдж за разработку метода, который использовался для разделения аминокислот . [9]В разделительной хроматографии используется остаточный растворитель на поверхности или внутри зерен или волокон «инертной» твердой поддерживающей матрицы, как в бумажной хроматографии ; или использует некоторое кулоновское взаимодействие и / или взаимодействие донора водорода с неподвижной фазой. Молекулы аналита разделяются между жидкой неподвижной фазой и элюентом. Так же, как и в хроматографии с гидрофильным взаимодействием (HILIC; подтехника в рамках ВЭЖХ), этот метод разделяет аналиты на основе различий в их полярности. HILIC чаще всего использует связанную полярную неподвижную фазу и подвижную фазу, состоящую в основном из ацетонитрила.с водой в качестве сильного компонента. Разделительная ВЭЖХ исторически использовалась на несвязанных подложках из диоксида кремния или оксида алюминия. Каждый эффективен для разделения аналитов по относительной полярности. Фазы, связанные HILIC, имеют преимущество разделения кислотных , основных и нейтральных растворенных веществ за один хроматографический цикл. [10]
Полярные аналиты диффундируют в неподвижный водный слой, связанный с полярной неподвижной фазой, и таким образом удерживаются. Чем сильнее взаимодействие между полярным аналитом и полярной стационарной фазой (по сравнению с подвижной фазой), тем больше время элюирования. Сила взаимодействия зависит от функциональных групп, составляющих молекулярную структуру анализируемого вещества, с более поляризованными группами ( например , гидроксильными) и группами, способными образовывать водородные связи, вызывая большее удерживание. Кулоновские (электростатические) взаимодействия также могут увеличивать удержание. Использование более полярных растворителей в подвижной фазе уменьшит время удерживания аналитов, тогда как более гидрофобные растворители имеют тенденцию к увеличению времени удерживания.
Нормально-фазовая хроматография [ править ]
Нормально-фазовая хроматография была одним из первых видов ВЭЖХ, разработанных химиками. Также известный как ВЭЖХ с нормальной фазой (NP-HPLC), этот метод разделяет аналиты на основе их сродства к полярной неподвижной поверхности, такой как диоксид кремния, следовательно, он основан на способности аналита участвовать в полярных взаимодействиях (таких как водородные связи или дипольно-дипольные взаимодействия). дипольный тип взаимодействия) с поверхностью сорбента. NP-HPLC использует неполярную, неводную подвижную фазу ( например , хлороформ), и эффективно работает для разделения аналитов, легко растворимых в неполярных растворителях. Аналит связывается с полярной стационарной фазой и удерживается в ней. Адсорбционная сила увеличивается с увеличением полярности аналита. Сила взаимодействия зависит не только от функциональных групп, присутствующих в структуре молекулы аналита, но и от стерических факторов . Влияние стерических затруднений на силу взаимодействия позволяет этому методу разделить (разделить) структурные изомеры .
Использование более полярных растворителей в подвижной фазе уменьшит время удерживания аналитов, тогда как более гидрофобные растворители, как правило, вызывают более медленное элюирование (увеличенное время удерживания). Очень полярные растворители, такие как следы воды в подвижной фазе, имеют тенденцию адсорбироваться на твердой поверхности неподвижной фазы, образуя стационарный связанный (водный) слой, который, как считается, играет активную роль в удерживании. Такое поведение в некоторой степени характерно для нормально-фазовой хроматографии, потому что оно регулируется почти исключительно адсорбционным механизмом ( т. Е.аналиты взаимодействуют с твердой поверхностью, а не с сольватированным слоем лиганда, прикрепленным к поверхности сорбента; см. также обращенно-фазовую ВЭЖХ ниже). Адсорбционная хроматография по-прежнему широко используется для разделения структурных изомеров как в колоночной, так и в тонкослойной хроматографии на активированных (высушенных) носителях из диоксида кремния или оксида алюминия.
Разделительная и NP-HPLC перестали пользоваться популярностью в 1970-х годах с развитием обращенно-фазовой HPLC из-за плохой воспроизводимости времен удерживания из-за присутствия слоя воды или протонного органического растворителя на поверхности хроматографической среды диоксида кремния или оксида алюминия. . Этот слой изменяется при любых изменениях состава подвижной фазы ( например , уровня влажности), вызывая дрейф времени удерживания.
В последнее время распределительная хроматография снова стала популярной благодаря разработке связанных фаз Hilic, которые демонстрируют улучшенную воспроизводимость, а также благодаря лучшему пониманию диапазона применимости метода.
Замещающая хроматография [ править ]
Основной принцип вытесняющей хроматографии : молекула с высоким сродством к хроматографической матрице (вытеснитель) будет эффективно конкурировать за сайты связывания и, таким образом, вытесняет все молекулы с меньшим сродством. [11]Между вытеснительной и элюционной хроматографией есть явные различия. В режиме элюирования вещества обычно выходят из колонки в виде узких гауссовых пиков. Для достижения максимальной очистки желательно широкое разделение пиков, предпочтительно до базовой линии. Скорость, с которой любой компонент смеси перемещается по колонке в режиме элюирования, зависит от многих факторов. Но для того, чтобы два вещества перемещались с разными скоростями и, таким образом, растворялись, должны быть существенные различия во взаимодействии между биомолекулами и хроматографической матрицей. Рабочие параметры регулируются для максимального эффекта от этой разницы. Во многих случаях разделение пиков по базовой линии может быть достигнуто только при градиентном элюировании и низкой загрузке колонки. Таким образом, два недостатка хроматографии в режиме элюирования, особенно в препаративном масштабе,- сложность эксплуатации из-за градиентной откачки растворителя и низкая пропускная способность из-за низкой загрузки колонны. Вытеснительная хроматография имеет преимущества перед элюционной хроматографией в том, что компоненты разделяются на последовательные зоны чистых веществ, а не на «пики». Поскольку в процессе используется нелинейность изотерм, более крупное сырье для колонки может быть разделено на данной колонке с очищенными компонентами, извлеченными при значительно более высокой концентрации.сырье большего размера может быть разделено на данной колонке с выделением очищенных компонентов при значительно более высокой концентрации.сырье большего размера может быть разделено на данной колонке с выделением очищенных компонентов при значительно более высокой концентрации.
Обращенно-фазовая хроматография (RPC) [ править ]
ВЭЖХ с обращенной фазой (ОФ-ВЭЖХ) имеет неполярную стационарную фазу и водную умеренно полярную подвижную фазу. Одной из распространенных неподвижных фаз является диоксид кремния, поверхность которого модифицирована RMe 2 SiCl, где R представляет собой алкильную группу с прямой цепью, такую как C 18 H 37 или C 8 H 17.. С такими стационарными фазами время удерживания для менее полярных молекул больше, в то время как полярные молекулы элюируются легче (в начале анализа). Исследователь может увеличить время удерживания, добавив больше воды в подвижную фазу; тем самым повышая сродство гидрофобного аналита к гидрофобной неподвижной фазе по сравнению с теперь более гидрофильной подвижной фазой. Точно так же исследователь может уменьшить время удерживания, добавив к элюенту больше органического растворителя. ОФ-ВЭЖХ настолько широко используется, что ее часто неправильно называют «ВЭЖХ» без дополнительных указаний. Фармацевтическая промышленность регулярно использует RP-HPLC для аттестации лекарств перед их выпуском.
ОФ-ВЭЖХ работает по принципу гидрофобных взаимодействий, который проистекает из высокой симметрии диполярной структуры воды и играет важнейшую роль во всех процессах в науке о жизни. RP-HPLC позволяет измерять эти взаимодействующие силы. Связывание аналита с неподвижной фазой пропорционально площади контактной поверхности вокруг неполярного сегмента молекулы аналита при ассоциации с лигандом на неподвижной фазе. В этом сольвофобном эффекте преобладает сила воды для «сокращения полостей» вокруг анализируемого вещества и цепи C 18 по сравнению с их комплексом. Энергия, выделяемая в этом процессе, пропорциональна поверхностному натяжению элюента (вода: 7,3 × 10 -6 Дж / см², метанол: 2,2 × 10 -6 Дж / см²) и к гидрофобной поверхности анализируемого вещества и лиганда соответственно. Удерживание можно уменьшить, добавив в подвижную фазу менее полярный растворитель (метанол, ацетонитрил ) для уменьшения поверхностного натяжения воды. Градиентное элюирование использует этот эффект, автоматически снижая полярность и поверхностное натяжение водной подвижной фазы в ходе анализа.
Структурные свойства молекулы аналита играют важную роль в ее удерживающих характеристиках. Как правило, аналит с большей площадью гидрофобной поверхности (C – H, C – C и, как правило, неполярными атомными связями, такими как SS и другие) сохраняется дольше, поскольку не взаимодействует со структурой воды. С другой стороны, аналиты с более высокой полярной площадью поверхности (обусловленной наличием полярных групп, таких как -OH, -NH 2 , COO - или -NH 3 +в своей структуре) сохраняются в меньшей степени, поскольку лучше интегрируются в воду. Такие взаимодействия подвержены стерическим эффектам, поскольку очень большие молекулы могут иметь только ограниченный доступ к порам неподвижной фазы, где происходят взаимодействия с поверхностными лигандами (алкильными цепями). Такое поверхностное препятствие обычно приводит к меньшему удерживанию.
Время удерживания увеличивается с увеличением гидрофобной (неполярной) площади поверхности. Соединения с разветвленной цепью элюируются быстрее, чем их соответствующие линейные изомеры, поскольку общая площадь поверхности уменьшается. Точно так же органические соединения с одинарными связями C – C элюируются позже, чем соединения с тройной связью C = C или C – C, поскольку двойная или тройная связь короче одинарной связи C – C.
Помимо поверхностного натяжения подвижной фазы (организационная сила в структуре элюента), другие модификаторы подвижной фазы могут влиять на удерживание аналита. Например, добавление неорганических солей вызывает умеренное линейное увеличение поверхностного натяжения водных растворов (примерно 1,5 × 10 -7 Дж / см² на моль для NaCl, 2,5 × 10 -7 Дж / см² на моль для (NH 4 ) 2 SO 4 ), и поскольку энтропияграницы раздела анализируемое вещество-растворитель контролируется поверхностным натяжением, добавление солей приводит к увеличению времени удерживания. Этот метод используется для мягкого разделения и восстановления белков и защиты их биологической активности при анализе белков (хроматография гидрофобного взаимодействия, HIC).
Еще одним важным фактором является pH подвижной фазы, поскольку он может изменить гидрофобный характер анализируемого вещества. По этой причине в большинстве методов для регулирования pH используется буферный агент , такой как фосфат натрия . Буферы служат нескольким целям: контролируют pH, нейтрализуют заряд на поверхности диоксида кремния неподвижной фазы и действуют как парные ионные агенты для нейтрализации заряда аналита. Формиат аммония обычно добавляют в масс-спектрометрию для улучшения обнаружения определенных аналитов за счет образования аддуктов аналит-аммоний . Летучая органическая кислота, такая как уксусная кислота или чаще всего муравьиная кислота., часто добавляется к подвижной фазе, если масс-спектрометрия используется для анализа элюента колонки. Трифторуксусная кислота нечасто используется в масс-спектрометрии из-за ее стойкости в детекторе и системе доставки растворителя, но может быть эффективной для улучшения удерживания аналитов, таких как карбоновые кислоты, в приложениях, использующих другие детекторы, поскольку это довольно сильная органическая кислота. Воздействие кислот и буферов зависит от области применения, но обычно улучшает хроматографическое разрешение.
Колонки с обращенной фазой довольно сложно повредить по сравнению с колонками с обычным кремнеземом; однако многие обращенно-фазовые колонки состоят из частиц диоксида кремния, дериватизированного алкилом, и никогда не должны использоваться с водными основаниями, поскольку они разрушают лежащие в основе частицы диоксида кремния. Их можно использовать с водной кислотой, но колонка не должна подвергаться воздействию кислоты слишком долго, так как это может вызвать коррозию металлических частей оборудования для ВЭЖХ. После использования колонки ОФ-ВЭЖХ следует промыть чистым растворителем для удаления остаточных кислот или буферов и хранить в соответствующем составе растворителя. Содержание металла в колонках для ВЭЖХ должно быть низким, чтобы сохранить наилучшую возможную способность разделять вещества. Хорошим тестом на содержание металлов в колонке является введение пробы, котораясмесь 2,2'- и 4,4'- бипиридина . Поскольку 2,2'-bipy может хелатировать металл, форма пика для 2,2'-bipy будет искажена (хвостовой), когда ионы металла присутствуют на поверхности диоксида кремния . [ необходима цитата ] ..
Эксклюзионная хроматография [ править ]
Эксклюзионная хроматография (SEC), также известная как гель-проникающая хроматография или гель-фильтрационная хроматография , разделяет частицы на основе молекулярного размера (фактически, по радиусу Стокса частицы ). Как правило, это хроматография низкого разрешения, и поэтому ее часто оставляют для заключительной, «полирующей» стадии очистки. Это также полезно для определения третичной структуры и четвертичной структуры.очищенных белков. SEC используется в основном для анализа больших молекул, таких как белки или полимеры. SEC работает, улавливая эти более мелкие молекулы в порах частицы. Более крупные молекулы просто проходят через поры, поскольку они слишком велики, чтобы попасть в поры. Следовательно, молекулы большего размера проходят через колонку быстрее, чем молекулы меньшего размера, то есть чем меньше молекула, тем больше время удерживания.
Этот метод широко используется для определения молекулярной массы полисахаридов. SEC - это официальный метод (предложенный Европейской фармакопеей) для сравнения молекулярной массы различных коммерчески доступных низкомолекулярных гепаринов .
Ионообменная хроматография [ править ]
В ионообменной хроматографии (IC) удерживание основано на притяжении растворенных ионов и заряженных участков, связанных с неподвижной фазой. Ионы растворенного вещества с тем же зарядом, что и заряженные центры на колонке, исключаются из связывания, в то время как растворенные ионы с противоположным зарядом заряженных участков колонки остаются на колонке. Ионы растворенного вещества, которые задерживаются в колонке, могут быть элюированы из колонки путем изменения условий растворителя ( например , увеличения ионного эффекта системы растворителей путем увеличения концентрации соли в растворе, увеличения температуры колонки, изменения pH растворителя. , так далее.).
Типы ионообменников включают полистирольные смолы, целлюлозные и декстрановые ионообменники (гели), а также стекло с контролируемыми порами или пористый диоксид кремния. Полистирольные смолы допускают сшивание, что увеличивает стабильность цепи. Более высокое поперечное сшивание снижает отклонение, что увеличивает время уравновешивания и, в конечном итоге, улучшает селективность. Ионообменники целлюлозы и декстрана обладают большими размерами пор и низкой плотностью заряда, что делает их пригодными для разделения белков.
Как правило, ионообменники способствуют связыванию ионов с более высоким зарядом и меньшим радиусом.
Увеличение концентрации противоиона (по отношению к функциональным группам в смолах) снижает время удерживания. Уменьшение pH уменьшает время удерживания при катионообмене, а увеличение pH уменьшает время удерживания при анионном обмене. Путем понижения pH растворителя в катионообменной колонке, например, больше ионов водорода становится доступным для конкуренции за позиции на анионной неподвижной фазе, тем самым элюируя слабосвязанные катионы.
Этот вид хроматографии широко используется в следующих областях: очистка воды, концентрирование микрокомпонентов, лигандообменная хроматография, ионообменная хроматография белков, анионообменная хроматография с высоким pH углеводов и олигосахаридов и другие.
Биоаффинная хроматография [ править ]
Этот хроматографический процесс основан на свойстве биологически активных веществ образовывать стабильные, специфические и обратимые комплексы. В образовании этих комплексов участвуют общие молекулярные силы, такие как взаимодействие Ван-дер-Ваальса , электростатическое взаимодействие, диполь-дипольное взаимодействие, гидрофобное взаимодействие и водородная связь. Эффективная биоспецифическая связь образуется за счет одновременного и согласованного действия нескольких из этих сил в дополнительных сайтах связывания.
Водная нормально-фазовая хроматография [ править ]
Водная нормально-фазовая хроматография (ANP) представляет собой хроматографический метод, который охватывает область подвижной фазы между обращенно-фазовой хроматографией (RP) и органической нормально-фазовой хроматографией (ONP). Этот метод используется для достижения уникальной селективности по гидрофильным соединениям, демонстрируя элюирование с нормальной фазой с использованием обращенно-фазовых растворителей. [ необходима цитата ]
Изократическое и градиентное элюирование [ править ]
Разделение, при котором состав подвижной фазы остается постоянным на протяжении всей процедуры, называется изократическим (что означает постоянный состав ). (Например, процентное содержание метанола на протяжении всей процедуры останется постоянным, т.е. 10%). Это слово придумал Чаба Хорват, который был одним из пионеров ВЭЖХ. [ необходима цитата ] ,
Состав подвижной фазы не обязательно должен оставаться постоянным. Разделение, при котором состав подвижной фазы изменяется в процессе разделения, описывается как градиентное элюирование . [12] Одним из примеров является градиент, начинающийся с 10% метанола и заканчивающийся 90% метанолом через 20 минут. Два компонента подвижной фазы обычно называют «А» и «В»; А - «слабый» растворитель, который позволяет растворенным веществам элюировать только медленно, а В - «сильный» растворитель, который быстро элюирует растворенные вещества из колонки. В обращенно-фазовой хроматографии растворитель A часто представляет собой воду или водный буфер, в то время как Bпредставляет собой смешивающийся с водой органический растворитель, такой как ацетонитрил , метанол, ТГФ или изопропанол .
При изократическом элюировании ширина пика увеличивается со временем удерживания линейно в соответствии с уравнением для N, числа теоретических тарелок. Это приводит к тому недостатку, что пики с поздним элюированием становятся очень плоскими и широкими. Их форма и ширина могут помешать их распознаванию как вершины.
Градиентное элюирование снижает удерживание элюируемых позже компонентов, так что они элюируются быстрее, давая более узкие (и более высокие) пики для большинства компонентов. Это также улучшает форму хвостовых пиков, поскольку возрастающая концентрация органического элюента смещает хвостовую часть пика вперед. Это также увеличивает высоту пика (пик выглядит «острее»), что важно при анализе следа. Программа градиента может включать внезапное «ступенчатое» увеличение процентного содержания органического компонента или различные наклоны в разное время - все в соответствии с желанием оптимального разделения за минимальное время.
При изократическом элюировании селективность не меняется, если размеры колонки (длина и внутренний диаметр) изменяются, то есть пики элюируются в том же порядке. При градиентном элюировании порядок элюирования может изменяться при изменении размеров или скорости потока. [ необходима цитата ]
Движущая сила в обращенно-фазовой хроматографии возникает в высшем порядке структуры воды. Роль органического компонента подвижной фазы заключается в снижении этого высокого порядка и, таким образом, снижении замедляющей силы водного компонента.
Параметры [ править ]
Теоретический [ править ]
Разделение ВЭЖХ имеет теоретические параметры и уравнения для описания разделения компонентов на пики сигналов при обнаружении с помощью таких приборов, как УФ-детектор или масс-спектрометр. Параметры в значительной степени получены из двух наборов хроматографической теории: теории пластин (как часть разделенной хроматографии ) и скоростной теории хроматографии / уравнения Ван Деемтера . Конечно, они могут быть реализованы на практике путем анализа хроматограмм ВЭЖХ, хотя более точной теорией считается теория скорости.
Они аналогичны расчету коэффициента удерживания для разделения на бумажной хроматографии , но описывают, насколько хорошо ВЭЖХ разделяет смесь на два или более компонентов, которые обнаруживаются в виде пиков (полос) на хроматограмме. Параметрами ВЭЖХ являются: коэффициент эффективности ( N ), коэффициент удерживания (простое каппа) и коэффициент разделения (альфа). Вместе факторы являются переменными в уравнении разрешения, которое описывает, насколько хорошо пики двух компонентов разделены или перекрывают друг друга. Эти параметры в основном используются только для описания ВЭЖХ обращенно-фазового разделения и ВЭЖХ нормально-фазового разделения, поскольку эти разделения имеют тенденцию быть более тонкими, чем другие режимы ВЭЖХ ( например , ионный обмен и исключение по размеру).
Пустой объем - это объем пространства в колонке, который занят растворителем. Это пространство внутри колонки, которое находится за пределами внутреннего набивочного материала колонки. Объем пустот измеряется на хроматограмме по детектированному пику первого компонента, которым обычно является растворитель, присутствующий в смеси образцов; в идеале растворитель пробы протекает через колонку, не взаимодействуя с колонкой, но все же обнаруживается в отличие от растворителя ВЭЖХ. Объем пустот используется как поправочный коэффициент.
Фактор эффективности ( N ) практически измеряет, насколько резкими являются пики компонентов на хроматограмме, как отношение площади пиков компонента («время удерживания») к ширине пиков в их самой широкой точке (на базовой линии). Высокие, острые и относительно узкие пики указывают на то, что метод разделения эффективно удалил компонент из смеси; высокая эффективность. Эффективность очень зависит от колонки ВЭЖХ и используемого метода ВЭЖХ. Фактор эффективности является синонимом номера тарелки и «количества теоретических тарелок».
Коэффициент удерживания ( каппа-прайм ) измеряет, как долго компонент смеси остается в колонке, измеряется площадью под кривой его пика на хроматограмме (поскольку хроматограммы ВЭЖХ являются функцией времени). Каждый пик хроматограммы будет иметь свой собственный коэффициент удерживания ( например , каппа 1 для коэффициента удерживания первого пика). Этот фактор может быть скорректирован за счет пустого объема колонки.
Коэффициент разделения ( альфа ) представляет собой относительное сравнение того, насколько хорошо были разделены два соседних компонента смеси ( т.е. две соседние полосы на хроматограмме). Этот коэффициент определяется как отношение коэффициентов удерживания пары соседних пиков хроматограммы, и его также можно скорректировать с помощью пустого объема колонки. Чем больше значение коэффициента разделения выше 1,0, тем лучше разделение, примерно до 2,0, при превышении которых метод ВЭЖХ, вероятно, не потребуется для разделения. Уравнения разрешения связывают три фактора, так что высокая эффективность и коэффициенты разделения улучшают разрешение пиков компонентов при разделении ВЭЖХ.
Внутренний диаметр [ править ]
Внутренний диаметр (ID) колонки для ВЭЖХ является важным параметром, влияющим на чувствительность обнаружения и селективность разделения при градиентном элюировании. Он также определяет количество аналита, которое может быть загружено в колонку. Колонки большего размера обычно используются в промышленных приложениях, таких как очистка лекарственного препарата для последующего использования. Колонки с низким ID обладают повышенной чувствительностью и меньшим расходом растворителя за счет загрузки.
Колонки с большим внутренним диаметром (более 10 мм) используются для очистки пригодных для использования количеств материала из-за их большой вместимости.
Колонки с аналитическим масштабом (4,6 мм) были наиболее распространенным типом колонок, хотя колонки меньшего размера быстро набирают популярность. Они используются в традиционном количественном анализе образцов и часто используют детектор поглощения УФ-видимого излучения .
Колонки с узким проходом (1-2 мм) используются в тех случаях, когда требуется большая чувствительность либо со специальными детекторами УФ-видимого излучения, флуоресцентным детектированием, либо с другими методами детектирования, такими как жидкостная хроматография-масс-спектрометрия.
Капиллярные колонки (менее 0,3 мм) используются почти исключительно с альтернативными средствами обнаружения, такими как масс-спектрометрия . Обычно они изготавливаются из капилляров из плавленого кварца , а не из трубок из нержавеющей стали, которые используются в более крупных колонках.
Размер частиц [ править ]
Наиболее традиционная ВЭЖХ выполняется с неподвижной фазой, прикрепленной к небольшим сферическим частицам кремнезема (очень маленькие шарики). Эти частицы бывают разных размеров, из которых наиболее распространены шарики размером 5 мкм. Более мелкие частицы обычно обеспечивают большую площадь поверхности и лучшее разделение, но давление, необходимое для оптимальной линейной скорости, увеличивается обратно пропорционально квадрату диаметра частиц. [13] [14] [15]
Это означает, что переход на частицы, которые вдвое меньше, при сохранении размера колонки, удвоит производительность, но повысит необходимое давление в четыре раза. Более крупные частицы используются в препаративной ВЭЖХ (диаметры колонок от 5 см до> 30 см) и для применений, не связанных с ВЭЖХ, таких как твердофазная экстракция .
Размер пор [ править ]
Многие неподвижные фазы являются пористыми, чтобы обеспечить большую площадь поверхности. Маленькие поры обеспечивают большую площадь поверхности, в то время как поры большего размера имеют лучшую кинетику, особенно для более крупных аналитов. Например, белок, размер которого лишь немного меньше размера поры, может попасть в пору, но не может легко выйти из нее.
Давление насоса [ править ]
Насосы различаются по допустимому давлению, но их производительность измеряется по их способности обеспечивать постоянный и воспроизводимый объемный расход . Давление может достигать 60 МПа (6000 фунт-сила / дюйм 2 ) или около 600 атмосфер. Современные системы ВЭЖХ были усовершенствованы для работы при гораздо более высоких давлениях и, следовательно, могут использовать частицы гораздо меньшего размера в колонках (<2 мкм). Эти системы «сверхвысокой жидкостной хроматографии» или УВЭЖХ могут работать при давлении до 120 МПа (17 405 фунт-сила / дюйм 2 ) или около 1200 атмосфер. [16] Термин «UPLC» [17] является товарным знаком Waters Corporation., но иногда используется для обозначения более общей техники УВЭЖХ.
Детекторы [ править ]
Детекторы ВЭЖХ делятся на две основные категории: универсальные и селективные. Универсальные детекторы обычно измеряют объемные свойства ( например , показатель преломления ) путем измерения разницы физических свойств между подвижной фазой и подвижной фазой с растворенным веществом, в то время как селективные детекторы измеряют свойство растворенного вещества ( например , поглощение в УФ-видимом диапазоне ), просто реагируя на физическое или химическое свойство растворенного вещества. [18] В ВЭЖХ чаще всего используется детектор поглощения в УФ-видимой области , однако можно использовать широкий спектр других хроматографических детекторов . Универсальный детектор, который дополняет определение поглощения в УФ-видимом диапазоне, - этоДетектор заряженных аэрозолей (САПР). Тип обычно используемых детекторов включает в себя детекторы показателя преломления, которые выдают показания путем измерения изменений показателя преломления элюента при его движении через проточную ячейку. В некоторых случаях можно использовать несколько детекторов, например, ЖХМС обычно комбинирует УФ-видимый свет с масс-спектрометром.
Автосэмплеры [ править ]
Большое количество образцов может быть автоматически введено в систему ВЭЖХ с помощью автосэмплеров ВЭЖХ. Кроме того, автосэмплеры для ВЭЖХ имеют одинаковый объем и метод впрыска для каждого впрыска, следовательно, они обеспечивают высокую степень точности впрыска. Можно включить перемешивание образца в камере для отбора проб, тем самым способствуя гомогенности. [19]
Приложения [ править ]
Производство [ править ]
ВЭЖХ имеет множество приложений как в лабораторных, так и в клинических исследованиях. Это распространенный метод, используемый в фармацевтических разработках, так как это надежный способ получения и обеспечения чистоты продукта. [20] Хотя с помощью ВЭЖХ можно получать продукты чрезвычайно высокого качества (чистые), это не всегда основной метод, используемый при производстве нерасфасованных лекарственных материалов. [21] Согласно Европейской фармакопее, ВЭЖХ используется только в 15,5% синтезов. [22] Однако он играет роль в 44% синтезов в фармакопее США. [23]Это могло быть связано с различиями в денежных и временных ограничениях, поскольку ВЭЖХ в больших масштабах может быть дорогостоящим методом. Повышение специфичности, точности и точности, которое происходит с ВЭЖХ, к сожалению, соответствует увеличению стоимости.
Правовой [ править ]
Этот метод также используется для обнаружения запрещенных наркотиков в моче. Самый распространенный метод обнаружения наркотиков - иммуноферментный анализ. [24] Этот метод намного удобнее. Однако удобство достигается за счет специфики и охвата широкого спектра лекарств. Поскольку ВЭЖХ является методом определения (и, возможно, повышения) чистоты, использование одной ВЭЖХ для оценки концентраций лекарственных средств несколько недостаточно. При этом ВЭЖХ в этом контексте часто проводят вместе с масс-спектрометрией . [25] Использование жидкостной хроматографии вместо газовой в сочетании с МС позволяет избежать необходимости получения производных ацетилирующими или алкилирующими агентами, что может быть обременительным дополнительным этапом. [26]Этот метод использовался для обнаружения множества агентов, таких как допинговые агенты, метаболиты лекарств, конъюгаты глюкуронида, амфетамины, опиоиды, кокаин, BZD, кетамин, LSD, каннабис и пестициды. [27] [28] Выполнение ВЭЖХ в сочетании с масс-спектрометрией снижает абсолютную потребность в стандартизации экспериментальных запусков ВЭЖХ.
Исследование [ править ]
Подобные анализы можно проводить в исследовательских целях, обнаруживая концентрации потенциальных клинических кандидатов, таких как противогрибковые препараты и лекарства от астмы. [29] Очевидно, что этот метод полезен при наблюдении за несколькими видами в собранных образцах, но требует использования стандартных решений при поиске информации об идентичности видов. Он используется как метод подтверждения результатов реакций синтеза, так как чистота имеет важное значение в исследованиях этого типа. Однако масс-спектрометрия по-прежнему является более надежным способом идентификации видов.
Медицинский [ править ]
Медицинское использование ВЭЖХ может включать анализ лекарств, но больше подпадает под категорию анализа питательных веществ. В то время как моча является наиболее распространенной средой для анализа концентраций лекарств, сыворотка крови - это образец, собираемый для большинства медицинских анализов с помощью ВЭЖХ. [30] Другие методы обнаружения молекул, которые можно использовать в клинических исследованиях, были протестированы с помощью ВЭЖХ, а именно иммуноанализы. В одном из примеров этого тесты конкурентного связывания белков (CPBA) и ВЭЖХ сравнивали на чувствительность при обнаружении витамина D. Было обнаружено, что чувствительность и специфичность этого CPBA, полезного для диагностики дефицита витамина D у детей, достигли только 40% и 60%. % соответственно от емкости ВЭЖХ. [31] Хотя ВЭЖХ является дорогим инструментом, точность его практически не имеет себе равных.
См. Также [ править ]
- История хроматографии
- Капиллярная электрохроматография
- Колоночная хроматография
- Чаба Хорват
- Ионная хроматография
- Мицеллярная жидкостная хроматография
Ссылки [ править ]
- ^ Гербер, Ф .; Круммен, М .; Potgeter, H .; Roth, A .; Siffrin, C .; Спендлин, К. (2004). «Практические аспекты быстрой обращенно-фазовой высокоэффективной жидкостной хроматографии с использованием колонок с насадкой 3 мкм и монолитных колонок в фармацевтических разработках и производстве в соответствии с действующей надлежащей производственной практикой». Журнал хроматографии A . 1036 (2): 127–133. DOI : 10.1016 / j.chroma.2004.02.056 . PMID 15146913 .
- ^ Морган, Дэвид Дж. (2003-11-19). «Сборщик фракций (публикация на Flickr)» . Flickr . Проверено 28 октября 2015 года .
- ^ a b Каргер, Барри Л. (1997). «ВЭЖХ: ранние и современные перспективы». Журнал химического образования . 74 (1): 45. Bibcode : 1997JChEd..74 ... 45K . DOI : 10.1021 / ed074p45 .
- ^ Б с д е е Генри, Ричард А. (1 февраля 2009) «Первые дни HPLC на Dupont» . Хроматография онлайн. Avanstar Communications Inc.
- ^ Илер, РК (1979) Химия кремнезема . Джон Вили и сыновья. Нью-Йорк.
- ^ Каргер, BL; Берри, LV (1971). «Быстрое жидкостно-хроматографическое разделение стероидов на колонках, сильно загруженных неподвижной фазой». Clin. Chem . 17 (8): 757–64. PMID 4254537 .
- ^ Гиддингс, Дж. Кальвин (1965) Динамика хроматографии, Часть I. Принципы и теория . Марсель Деккер, Инк., Нью-Йорк. п. 281.
- ^ Ettre, C. (2001). "Вехи в хроматографии: рождение разделенной хроматографии" (PDF) . LCGC . 19 (5): 506–512 . Проверено 26 февраля 2016 .
- ^ Мартин, AJP; Synge, RLM (1941). «Разделение высших моноаминокислот путем противоточной жидкостно-жидкостной экстракции: аминокислотный состав шерсти» . Биохимический журнал . 35 (1–2): 91–121. DOI : 10.1042 / bj0350091 . PMC 1265473 . PMID 16747393 .
- ^ Линдси, S .; Кили, Д. (1987). Высокоэффективная жидкостная хроматография . Вайли. ОСТИ 7013902 . из обзора Hung, LB; Парчер, JF; Шорс, JC; Уорд, EH (1988). «Теоретические и экспериментальные основы программирования покрытия поверхности в газо-твердотельной хроматографии с адсорбируемым газом-носителем». Варенье. Chem. Soc . 110 (11): 1090–1096. DOI : 10.1021 / ac00162a003 .
- ^ Хроматография вытеснения . Sacheminc.com. Проверено 7 июня 2011. Архивировано 15 сентября 2008 года в Wayback Machine.
- ^ Снайдер, Ллойд R .; Долан, Джон В. (2006). Высокоэффективное градиентное элюирование: практическое применение модели линейной прочности растворителя . Wiley Interscience. ISBN 978-0470055519.
- ^ Майорс, Рональд Э .. (2010-09-07) Быстрая и сверхбыстрая ВЭЖХ на пористых частицах размером менее 2 мкм - что нам делать дальше? - LC-GC Европа . Lcgceurope.com. Проверено 7 июня 2011.
- ^ Xiang, Y .; Liu Y .; Ли ML (2006). «Жидкостная хроматография сверхвысокого давления с использованием повышенной температуры». Журнал хроматографии A . 1104 (1–2): 198–202. DOI : 10.1016 / j.chroma.2005.11.118 . PMID 16376355 .
- ^ Horváth, Cs .; Preiss BA; Липский С.Р. (1967). «Быстрая жидкостная хроматография. Исследование рабочих параметров и разделение нуклеотидов на пленочных ионообменниках». Аналитическая химия . 39 (12): 1422–1428. DOI : 10.1021 / ac60256a003 . PMID 6073805 .
- ^ 1290 Бесконечный четвертичный насос . Agilent
- ^ воды. «Торговые марки: Воды» . www.waters.com .
- ^ К., Робардс (1994). Принципы и практика современных хроматографических методов . Хаддад, PR, Джексон, ЧП Амстердам: Elsevier / Academic Press. ISBN 9780080571782. OCLC 815471219 .
- ^ «Автоматизированное устройство для непрерывного перемешивания при отборе проб в системах жидкостной хроматографии» . Химия связи . 3 : 180. 2020. DOI : 10.1038 / s42004-020-00427-5 .
- ^ Гербер, Фредерик (май 2004 г.). «Практические аспекты быстрой обращенно-фазовой высокоэффективной жидкостной хроматографии с использованием колонок с насадкой 3 мкм и монолитных колонок в фармацевтических разработках и производстве, работающих в соответствии с действующей надлежащей производственной практикой». Журнал хроматографии . 1036 (2): 127–33. DOI : 10.1016 / j.chroma.2004.02.056 . PMID 15146913 .
- ^ Сиддики, Masoom Раз; AlOthman, Zeid A .; Рахман, Нафисур (2013). «Аналитические методы в фармацевтическом анализе: обзор» . Арабский химический журнал . 10 : S1409 – S1421. DOI : 10.1016 / j.arabjc.2013.04.016 .
- ^ Европейская фармакопея , 2002. четвертое издание, Совет Европы, Страсбург.
- ^ Фармакопея США , 2004. 27-е изд. USP Convention Inc., Роквилл, Мэриленд.
- ^ Пеше, Амадео; Розенталь, Мюррей; Уэст, Роберт; Уэст, Кэмерон; Crews, Бриджит; Микель, Чарльз; Алмазан, Перла; Латышев, Сергей (01.06.2010). «Оценка диагностической точности жидкостной хроматографии-тандемной масс-спектрометрии по сравнению с иммуноанализом у пациентов с болью» . Врач боли . 13 (3): 273–281. PMID 20495592 .
- ^ Цай, И.-Линь; Weng, Te-I .; Tseng, Yufeng J .; Тан, Хэппи Куй-Лок; Сунь, Сяо-Цзюй; Куо, Цзин-Хуа (01.12.2013). «Скрининг и подтверждение 62 наркотиков и метаболитов в моче с помощью ультра-высокоэффективной жидкостной хроматографии-квадрупольной времяпролетной масс-спектрометрии» . Журнал аналитической токсикологии . 37 (9): 642–651. DOI : 10.1093 / JAT / bkt083 . PMID 24084874 .
- ^ Weinmann, W .; Renz, M .; Vogt, S .; Поллак, С. (01.01.2000). «Автоматическая твердофазная экстракция и двухэтапная дериватизация для одновременного анализа основных запрещенных наркотиков в сыворотке с помощью ГХ / МС». Международный журнал судебной медицины . 113 (4): 229–235. DOI : 10.1007 / s004149900098 . PMID 10929239 .
- ^ Колмонен, Марджо; Лейнонен, Антти; Пеландер, Анна; Оянперя, Илкка (28 февраля 2007 г.). «Общий метод скрининга допинговых агентов в моче человека с помощью твердофазной экстракции и жидкостной хроматографии / времяпролетной масс-спектрометрии». Analytica Chimica Acta . 585 (1): 94–102. DOI : 10.1016 / j.aca.2006.12.028 . PMID 17386652 .
- ^ Пеландер, Анна; Оянперя, Илкка; Лакс, Суви; Расанен, Илпо; Вуори, Эркки (01.11.2003). «Токсикологический скрининг с идентификацией метаболитов на основе формулы с помощью жидкостной хроматографии / времяпролетной масс-спектрометрии». Аналитическая химия . 75 (21): 5710–5718. DOI : 10.1021 / ac030162o . PMID 14588010 .
- ^ Нобилис, Милан; Наливай, Милан; Сенель, Петр; Павлик, Ян; Кунес, Иржи; Voprsalová, Marie; Коларова, Ленка; Холкапек, Михал (15.06.2007). «Метаболическое профилирование потенциального противогрибкового препарата, 3- (4-бромфенил) -5-ацетоксиметил-2,5-дигидрофуран-2-она, в моче мышей с использованием высокоэффективной жидкостной хроматографии с УФ-фотодиодной матрицей и масс-спектрометрическим детектированием» . Журнал хроматографии B . 853 (1–2): 10–19. DOI : 10.1016 / j.jchromb.2007.02.045 . PMID 17400036 .
- ^ Сундстрём, Мира; Пеландер, Анна; Ангерер, Верена; Хаттер, Мелани; Кнейзель, Стефан; Оянперя, Илкка (01.10.2013). «Метод высокочувствительной сверхвысокой жидкостной хроматографии / времяпролетной масс-спектрометрии высокого разрешения (UHPLC-HR-TOFMS) для выявления синтетических каннабиноидов и других наркотиков в моче». Аналитическая и биоаналитическая химия . 405 (26): 8463–8474. DOI : 10.1007 / s00216-013-7272-8 . PMID 23954996 .
- ^ Захеди Рад, Малихе; Неестани, Тиранг Реза; Никуйе, Бахаре; Шариатзаде, Настаран; Калаи, Али; Халаджи, Нилуфар; Гарави, Азам (01.01.2015). «Метод иммуноферментного анализа, основанный на конкурентном анализе связывания белков, по сравнению с жидкостной хроматографией под высоким давлением, имеет очень низкую диагностическую ценность для выявления дефицита витамина D у детей 9–12 лет» . Международный журнал профилактической медицины . 6 : 67. DOI : 10,4103 / 2008-7802.161069 . PMC 4542329 . PMID 26330983 .
Дальнейшее чтение [ править ]
- Л. Р. Снайдер, Дж. Дж. Киркланд и Дж. У. Долан, Введение в современную жидкостную хроматографию, John Wiley & Sons, Нью-Йорк, 2009.
- MW Dong, Современная ВЭЖХ для практикующих ученых. Wiley, 2006.
- Л. Р. Снайдер, Дж. Дж. Киркланд и Дж. Л. Глайч, Разработка практических методов ВЭЖХ, John Wiley & Sons, Нью-Йорк, 1997.
- С. Ахуджа и Х.Т. Расмуссен (редактор), Разработка метода ВЭЖХ для фармацевтических препаратов, Academic Press, 2007.
- С. Ахуджа и М.В. Донг (редактор), Справочник по фармацевтическому анализу с помощью ВЭЖХ, Elsevier / Academic Press, 2005.
- Ю. В. Казакевич и Р. Лобрутто (ред.), ВЭЖХ для ученых-фармацевтов, Wiley, 2007.
- UD Neue, Колонки для ВЭЖХ: теория, технология и практика, Wiley-VCH, Нью-Йорк, 1997.
- MC McMaster, ВЭЖХ, практическое руководство пользователя, Wiley, 2007.
Внешние ссылки [ править ]
| Викискладе есть медиафайлы, связанные с высокоэффективной жидкостной хроматографией . |
- Принцип хроматографии ВЭЖХ , применение [Основное примечание] - 2020. на Rxlalit.com
- Жидкостная хроматография в Curlie
