 | |
| Клинические данные | |
|---|---|
| AHFS / Drugs.com | Международные названия лекарств |
| Код УВД | |
| Фармакокинетические данные | |
| Биодоступность | 1 |
| Идентификаторы | |
| |
| Количество CAS | |
| PubChem CID | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭМБЛ | |
| Панель управления CompTox ( EPA ) | |
| ECHA InfoCard | 100.000.199 |
| Химические и физические данные | |
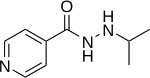
| Формула | C 9 H 13 N 3 O |
| Молярная масса | 179,223 г · моль -1 |
| 3D модель ( JSmol ) | |
| Плотность | 1,084 г / см 3 |
| Точка кипения | 265,9 ° C (510,6 ° F) |
| |
| |
| (проверять) | |
Ипрониазид ( Марсилид , Рививол , Эуфозид , Ипразид , Ипронид , Ипронин ) - это неселективный необратимый ингибитор моноаминоксидазы (ИМАО) из класса гидразинов . [1] [2] Это ксенобиотик, который изначально был разработан для лечения туберкулеза , но позже наиболее широко использовался в качестве антидепрессанта . Однако он был снят с продажи из-за его гепатотоксичности . [3] [4]Медицинское использование ипрониазида было прекращено в большинстве стран мира в 1960-х годах, но продолжало применяться во Франции .
История [ править ]
Ипрониазид был первоначально разработан для лечения туберкулеза , [1] , но в 1952 году, его антидепрессант свойство было обнаружено , когда исследователи отметили , что пациенты стали ненадо счастливы , когда данный изониазид , а структурный аналог из Ипрониазида. [1] [5] Впоследствии N-изопропил добавление приводило к развитию в качестве антидепрессанта , и был одобрен для использования в 1958 году [1] Он был снят в большинстве стран мира через несколько лет в 1961 году из - за высокой заболеваемости гепатитом , и был заменен менее гепатотоксичными препаратами, такими как фенелзин и изокарбоксазид. [1] Канада неожиданно отозвала ипрониазид в июле 1964 года из-за взаимодействия с пищевыми продуктами, содержащими тирамин. [6] [7] Тем не менее, ипрониазид имеет историческую ценность, поскольку он помог установить связь между психическими расстройствами и метаболизмом нейромедиаторов. [4]
Хотя ипрониазид был одним из первых антидепрессантов, когда-либо появившихся на рынке, амфетамин (продаваемый как бензедрин с 1935 г. для «легкой депрессии» среди других показаний) [8] предшествует ему; а ладан традиционно продавался на протяжении тысячелетий, помимо прочего, для изменения настроения, хотя только в 2012 году было обнаружено, что один из компонентов его дыма оказывает антидепрессивное действие на мышей. [9] [10] [11]
Структура и реакционная способность [ править ]
Структура ипрониазида химически, как по структуре, так и по реакционной способности, аналогична изониазиду. Ипрониазид представляет собой замещенный гидразин, изопропилгидразиновая составляющая которого важна для ингибирования активности моноаминоксидазы. [12]
Синтез [ править ]
Есть несколько способов синтеза ипрониазида. Наиболее распространенным предшественником является метилизоникотинат, который при взаимодействии с гидразином образует изоникотиногидразид . [13] Изоникотиногидразид может превращаться в ипрониазид разными путями.
Один путь синтеза включает AcMe, который приводит к образованию N '- (пропан-2-илиден) изоникотиногидразида. Затем связь C = N селективно гидрируется в присутствии платинового катализатора и с водой, спиртом или уксусной кислотой в качестве растворителя. [14] [15]
По другому пути изоникотиногидразид реагирует либо с 2-бромпропаном, либо с 2-хлорпропаном в реакции присоединения N-изопропила к гидразиновой части. Это напрямую приводит к образованию ипрониазида. [16] [17]
Реакции и механизм действия [ править ]
Ипрониазид - известный ингибитор моноаминоксидазы , он подавляет активность моноаминоксидаз (МАО) как сам по себе, так и через активный метаболит, изопропилгидразин . Образование изопропилгидразина из ипрониазида наблюдалось без присутствия МАО. [12] И ипрониазид, и изопропилгидразин реагируют вблизи активного центра МАО. Реакция является прогрессирующей реакцией первого порядка с высокой энергией активации . В присутствии кислорода это необратимая реакция , так как дегидрированиеипрониазида в активном центре фермента. Это дегидрирование напоминает первую стадию окисления амина . После дегидрирования ипрониазид далее вступает в реакцию с ферментом. [18]
Ингибирование МАО ипрониазидом является конкурентным и чувствительным к изменениям pH и температуры, подобно окислению моноаминового субстрата. Ингибирование не может быть отменено добавлением субстрата. [18] Ипрониазид способен вытеснять негидразиновые ингибиторы, но не другие ингибиторы гидразина, из активного центра фермента. [12]
Для усиления ингибирования моноаминоксидазы можно использовать цианид . Однако реакция остается кислородно-зависимой. [18] Ингибирование МАО может быть уменьшено путем добавления глутатиона , что свидетельствует о неферментативной конъюгации ипрониазида или изопропилгидразина с глутатионом. [18]
Метаболизм и токсичность [ править ]
Ипрониазид метаболизируется в организме. Ипрониазид превращается в изопропилгидразин и изоникотиновую кислоту в начальной реакции гидролиза . Изопропилгидразин может либо выделяться в кровь, либо метаболически активироваться микросомальными ферментами CYP450 . [19] Это окисление изопропилгидразина является реакцией отравления, которая в конечном итоге может привести к образованию алкилирующего агента: изопропилового радикала. [3] Некроз печени был обнаружен у крыс при дозах до 10 мг / кг. [19]
Изопропиловый радикал [ править ]
На присутствие изопропильного радикала указывает другой наблюдаемый продукт метаболизма ипрониазида: газ пропан. [3]
Алкилирующие агенты обладают способностью связываться с химическими группами, такими как амино , фосфатгидроксильная , имидазольная и сульфгидрильная группы. Образующийся изопропиловый радикал способен образовывать конъюгаты S-изопропил in vitro . Это снижает ковалентное связывание с другими белками, однако это наблюдалось только in vitro . In vivo гепатотоксические дозы изопропилгидразина, предшественника изопропильного радикала, не истощают соединения, содержащие сульфгидрильную группу. [3]
Некроз печени [ править ]
Изопропиловый радикал, образующийся в результате метаболизма ипрониазида, способен ковалентно связываться с белками и другими макромолекулами в печени. Эти взаимодействия являются причиной гепатотоксичности ипрониазида. Ковалентное связывание приводит к некрозу печени , предположительно изменяя функцию белка, что приводит к стрессу органелл и острой токсичности. [20] [21] Однако точный механизм того, как связывание производных ипрониазида с белками печени может вызывать некроз печени, остается неясным. [3]
Ферменты цитохрома P450 присутствуют в самых высоких концентрациях в печени, вызывая выработку в печени большинства алкилирующих агентов. Это объясняет, почему печень в основном повреждается ковалентным связыванием алкилирующих агентов, таких как изопропиловый радикал. [19] Модели на крысах и другие модели на животных показали, что ферменты цитохрома P450 превращают изопропилгидразин в алкилирующие соединения, которые вызывают некроз печени. Фенобарбитал , индуктор класса микросомальных ферментов цитохрома P450 в печени , значительно увеличивает вероятность некроза. Напротив, соединения хлорид кобальта , пиперонилбутоксид и альфа-нафтилизотиоцианатингибируют микросомальные ферменты, что снижает вероятность некроза из-за изопропилгидразина. [19]
Метаболизм в другие формы [ править ]
Ипрониазид также может метаболизироваться путем O- деалкилирования от ипрониазида до ацетона и изониазида . Изониазид может подвергаться дальнейшему метаболизму через несколько метаболических путей, один из которых в конечном итоге также приводит к алкилирующим агентам. Этот токсический метаболический путь включает N- ацетилирование . На реакции, связанные с ацетилированием, влияет генетическая изменчивость : фенотип ацетилирования . Таким образом, токсикологический ответ на изониазид (и, следовательно, ипрониазид) может различаться у разных людей.
Ацетон также может производиться альтернативным путем в виде метаболита изопропилгидразина. В конечном итоге он превращается в CO 2 и выдыхается. [3]
Изоникотиновая кислота [ править ]
Изоникотиновая кислота , образующаяся при гидролизе ипрониазида, описывается как умеренно токсичное соединение и аллерген с кумулятивным действием. [22] Изоникотиновая кислота далее метаболизируется путем конъюгации с глицином или с глюкуроновой кислотой. [19] [23]
Другие токсические эффекты [ править ]
Ипрониазид также может взаимодействовать с пищевыми продуктами, содержащими тирозин, что может оказывать токсическое действие. [6] [7]
Экскреция [ править ]
Выведение может происходить разными путями: через легкие , мочу , желчь, а иногда и через кожу или грудное молоко . Ипрониазид имеет молекулярную массу 179,219 г / моль, что намного ниже 500 г / моль, и он гидрофильный (из-за, например, групп NH в молекуле). Эти два свойства вместе указывают на то, что ипрониазид, вероятно, выводится с мочой через почки. [24]
Ипрониазид также может метаболизироваться и выводиться из организма в виде одного из его метаболитов, который можно найти на рисунке выше. Изониазид гидрофилен [24] и имеет молекулярную массу 137,139 г / моль. Таким образом, предполагается, что изониазид выводится с мочой, если он не подвергается дальнейшему метаболизму в организме. То же самое касается изоникотиновой кислоты и изоникотиноилглицина . Двуокись углерода и пропан представляют собой газообразные вещества, которые предположительно выводятся из организма путем выдоха через легкие.
Индикация [ править ]
Изначально ипрониазид производился как противотуберкулезное средство, но оказалось, что он более эффективен как антидепрессант . Когда было обнаружено, что ипрониазид гепатотоксичен , его заменили лекарственными ксенобиотиками , которые менее вредны для печени . Примерами антидепрессантов, которые в настоящее время используются вместо ипрониазида, являются изокарбоксазид , фенелзин и транилципромин . [3]
Более эффективными препаратами для лечения туберкулеза являются изониазид , пиразинамид , этамбутол и рифампицин . [25]
Эффективность и побочные эффекты [ править ]
Эффективность [ править ]
Ипрониазид был разработан для лечения туберкулеза , но его наиболее значительный положительный эффект заключается в том, что он обладает свойством стимулировать настроение. Поэтому его использовали как антидепрессант . [7]
Побочные эффекты [ править ]
Наиболее значительным побочным эффектом использования ипрониазида является гепатотоксичность, вызванная его метаболитами . Кроме того, использование ипрониазида приводит к ряду побочных эффектов, таких как головокружение (в положении лежа), сонливость , головные боли , атаксия , онемение стоп и рук и мышечные подергивания . Однако эти побочные эффекты исчезают примерно через 10 недель. [26] [27]
Воздействие на животных [ править ]
Модели на животных крысах использовались для исследования гепатотоксического (био) химического механизма действия ипрониазида. Метаболит из ипрониазида, изопропилового гидразина , был установлен, что мощный гепатотоксин у крыс. [3] [19] Некроз печени был обнаружен у крыс при дозах всего 10 мг / кг. [19] С помощью admetSAR [28] было предсказано, что LD50 ипрониазида у крыс составляет 2,6600 моль / кг. [7]
Летальность [ править ]
В таблице приведены экспериментально определенные значения LD50, TDLo и LDLo для различных организмов. [29]
| Организм | Тип теста | Маршрут | Заявленная доза (мг / кг) | Справка |
|---|---|---|---|---|
| Собака | LD50 | устный | 95 | Летопись Нью-Йоркской академии наук. Vol. 80, стр. 626, 1959. |
| Человек | TDLo | устный | 2.143 / D | Acta Neurologia et Psychiatrica Belgica. Vol. 59, стр. 977, 1959. |
| Человек | LDLo | устный | 14 / 2W-I | Журнал Канадской медицинской ассоциации. Vol. 78, стр. 131, 1958. |
| Обезьяна | LD50 | устный | 640 | Летопись Нью-Йоркской академии наук. Vol. 80, стр. 626, 1959. |
| Мышь | LD50 | Внутримышечный | 615 | Американский обзор туберкулеза. Vol. 65, стр. 376, 1952 г. |
| Мышь | LD50 | внутрибрюшинный | 475 | Японский журнал фармакологии. Vol. 13, стр. 186, 1963. |
| Мышь | LD50 | внутривенный | 719 | Американский обзор туберкулеза. Vol. 65, стр. 376, 1952 г. |
| Мышь | LD50 | устный | 440 | Pharmaceutical Chemistry Journal Vol. 30, стр. 750, 1996. |
| Мышь | LD50 | подкожный | 730 | Американский обзор туберкулеза. Vol. 65, стр. 376, 1952 г. |
| Кролик | LD50 | внутривенный | 117 | Американский обзор туберкулеза. Vol. 65, стр. 376, 1952 г. |
| Кролик | LD50 | устный | 125 | Американский обзор туберкулеза. Vol. 65, стр. 376, 1952 г. |
| Кролик | LDLo | кожа | 2000 г. | Отчеты исследовательского центра Хантингдона. Vol. -, Стр. -, 1972. |
| Крыса | LD50 | подкожный | 538 | Японский журнал фармакологии. Vol. 13, стр. 186, 1963. |
| Крыса | LD50 | незарегистрированный | 350 | Природа. Vol. 185, стр. 532, 1960. |
| Крыса | LD50 | устный | 365 | Журнал фармакологии и экспериментальной терапии. Vol. 119, стр. 444, 1957. |
| Крыса | LD50 | внутрибрюшинный | 375 | Arzneimittel-Forschung. Исследования наркотиков. Vol. 20, стр. 363, 1970. |
См. Также [ править ]
- Гидразин (антидепрессант)
- Изониазид
Ссылки [ править ]
- ^ a b c d e Роберт А. Максвелл; Шоре Б. Экхардт (1990). Открытие лекарств . Humana Press. С. 143–154 . ISBN 9780896031807.
- ^ Fagervall I, Росс С. Б. (апрель 1986). «Ингибирование моноаминоксидазы в моноаминергических нейронах головного мозга крысы необратимыми ингибиторами». Биохимическая фармакология . 35 (8): 1381–7. DOI : 10.1016 / 0006-2952 (86) 90285-6 . PMID 2870717 .
- ^ a b c d e f g h i Тимбрелл, Джон (2008). Группа Тейлор и Фрэнсис . С. 324–326. DOI : 10.3109 / 9781420007084 . ISBN 978-0-8493-7302-2.
- ^ а б Хенн, Фриц; Сарториус, Норманн; Хельмхен, Ханфрид; Лаутер, Ганс (11 ноября 2013 г.). Современная психиатрия . Springer Science & Business Media. п. 109. ISBN 9783642595196.
- ^ Ramachandraih, Chaitra T .; Субраманьям, Нараяна; Бар, Краль Юрген; Бейкер, Глен; Ерагани, Викрам К. (2011). «Антидепрессанты: от ИМАО до СИОЗС и др.» . Индийский журнал психиатрии . 53 (2): 180–182. DOI : 10.4103 / 0019-5545.82567 . ISSN 0019-5545 . PMC 3136031 . PMID 21772661 .
- ^ a b Алексей, Александр; Харрис, К. Джон; Смит, Деннис А. (26 октября 2015 г.). Убыток в фармацевтической промышленности: причины, последствия и пути продвижения вперед . Джон Вили и сыновья. ISBN 9781118819449.
- ^ а б в г «Ипрониазид» . www.drugbank.ca . Проверено 27 марта 2018 .
- ↑ Heal DJ, Smith SL, Gosden J, Nutt DJ (июнь 2013 г.). «Амфетамин, прошлое и настоящее - фармакологическая и клиническая перспектива» . J. Psychopharmacol . 27 (6): 479–96. DOI : 10.1177 / 0269881113482532 . PMC 3666194 . PMID 23539642 .
- ^ Moussaieff, Арье; Риммерман, Нета; Брегман, Татьяна; Страйкер, Алекс; Felder, Christian C .; Шохам, Шай; Кашман, Йоэль; Хуанг, Сьюзан М .; Ли, Хёсанг; Шохами, Эстер; Маки, Кен; Катерина, Майкл Дж .; Уокер, Дж. Майкл; Фридэ, Эстер; Мехулам, Рафаэль (август 2008 г.). «Инсенсол ацетат, компонент ладана, вызывает психоактивность, активируя каналы TRPV3 в мозгу» . Журнал FASEB . 22 (8): 3024–3034. DOI : 10.1096 / fj.07-101865 . PMC 2493463 . PMID 18492727 .
- ^ Moussaieff, A; Брутто, М; Нешер, Э; Тихонов, Т; Ядид, G; Пинхасов, А (2012). «Ацетат инсенсола снижает депрессивное поведение и модулирует экспрессию BDNF и CRF в гиппокампе у покорных животных». J. Psychopharmacol . 26 (12): 1584–93. DOI : 10.1177 / 0269881112458729 . PMID 23015543 . S2CID 1675621 .
- ^ Drahl, Кармен (22 декабря 2008). «Ладан и мирра» . Новости химии и машиностроения . 86 (51): 38. DOI : 10.1021 / Сеп-v086n051.p038 . ISSN 0009-2347 .
- ^ a b c Смит, Томас Э .; Вайсбах, Герберт; Уденфренд, Сидней (1963). «Исследования моноаминоксидазы: механизм ингибирования моноаминоксидазы ипрониазидом». Биохимия . 2 (4): 746–751. DOI : 10.1021 / bi00904a021 . PMID 14075108 .
- ^ Позгай, Винс; Дженнингс, Гарольд Дж. (1987). «Синтез азидов со стабильными нитрозильными солями». Буквы тетраэдра . 28 (43): 5091–5092. DOI : 10.1016 / s0040-4039 (00) 95598-9 .
- ^ Йель, Гарри L .; Лоси, Кэтрин; Мартинс, Джозеф; Холсинг, Мэри; Перри, Фрэнсис М .; Бернштейн, Джек (1953). «Химиотерапия экспериментального туберкулеза. VIII. Синтез кислых гидразидов, их производных и родственных соединений1,2». Журнал Американского химического общества . 75 (8): 1933–1942. DOI : 10.1021 / ja01104a046 .
- ^ Вигорита; Оттана; Маккари; Монфорте; Бисиньяно; Pizzimenti Bollettino Chimico Farmaceutico, 1998, т. 137, №7 с. 267 - 276
- ^ Журнал Американской фармацевтической ассоциации (1912-1977), 42: 457,463
- ^ Società chimica italiana ([1871?] - 1997). "Gazzetta chimica Italiana" . Европейский журнал органической химии . 88 : v.393, 398. ISSN 0016-5603 . Проверить значения даты в:
|date=( помощь ) - ^ a b c d Дэвинсон, АН (21 ноября 1956 г.). «Механизм необратимого ингибирования моноаминоксидазы печени крысы ипрониазидом (марсилидом)» . Биохим. Дж . 67 (2): 316–322. DOI : 10.1042 / bj0670316 . PMC 1200154 . PMID 13471553 .
- ^ a b c d e f g h Нельсон, SD; Митчелл-младший; Снодграсс, WR; Тимбрелл, Дж. А. (1978-09-01). «Гепатотоксичность и метаболизм ипрониазида и изопропилгидразина» . Журнал фармакологии и экспериментальной терапии . 206 (3): 574–585. ISSN 0022-3565 . PMID 702322 .
- ^ Йорг, Андреа; Дара, Лили; Капловиц, Нил (2017-05-09). «Травма печени, вызванная лекарственными средствами: каскад событий, ведущих к гибели клеток, апоптозу или некрозу» . Международный журнал молекулярных наук . 18 (5): 1018. DOI : 10,3390 / ijms18051018 . PMC 5454931 . PMID 28486401 .
- ^ Митчелл, младший; Джоллоу, диджей; Поттер, WZ; Дэвис, округ Колумбия; Gillette, JR; Броди, BB (октябрь 1973 г.). «Ацетаминофен-индуцированный некроз печени. I. Роль метаболизма лекарств». Журнал фармакологии и экспериментальной терапии . 187 (1): 185–194. ISSN 0022-3565 . PMID 4746326 .
- ^ Tsarichenko, GV; Бобров В.И.; Смарков, М.В. (1977-04-01). «Токсичность изоникотиновой кислоты». Журнал фармацевтической химии . 11 (4): 481–483. DOI : 10.1007 / BF01156485 . ISSN 0091-150X . S2CID 9309017 .
- ^ Махапатра, Себабрата; Вулхайзер, Лиза; Дж. Ленертс, Энн; Л. Джонсон, Джон; Эйзенах, Кэтлин; Иолоба, Моисей; Стрела, Вт; Т. Белисл, Джон (01.01.2012). «Новый метаболит противотуберкулезной терапии демонстрирует активацию изониазида хозяином и образование аддукта изониазид-НАД +» . Противомикробные препараты и химиотерапия . 56 (1): 28–35. DOI : 10,1128 / AAC.05486-11 . PMC 3256082 . PMID 22037847 .
- ^ а б Де Сагер, РМ; Leenheer, AP De; Клэйс, AE (1976-06-01). «Идентификация и количественное определение ипрониазида в моче человека методом ГЖХ» . Журнал фармацевтических наук . 65 (6): 878–882. DOI : 10.1002 / jps.2600650619 . ISSN 0022-3549 . PMID 932974 .
- ^ Тормоз, Линдси Х.М. te; Knegt, Gerjo J. de; Steenwinkel, Jurriaan E. de; Dam, Teunis JP van; Бургер, Дэвид М .; Рассел, Франс GM; Кревель, фургон Рейноута; Кендеринк, Ян Б .; Аарнуус, Роб Э. (2018). «Роль оттокных насосов в лечении туберкулеза и их перспективы в качестве цели в разработке лекарств: распутывая черный ящик». Ежегодный обзор фармакологии и токсикологии . 58 (1): 271–291. DOI : 10,1146 / annurev-pharmtox-010617-052438 . PMID 28715978 .
- ^ Лихтенштейн, MR; Мизенберг, Эдвард (1954-05-01). «Контролируемое исследование изониазида и ипрониазида». Заболевания груди . 25 (5): 573–579. DOI : 10,1378 / chest.25.5.573 . ISSN 0096-0217 . PMID 13151011 .
- ^ edu.drugs. «Побочные эффекты Ипрониазида» . edudrugs.com . Проверено 27 марта 2018 .
- ^ Cheng, Feixiong; Ли, Вэйхуа; Чжоу, Яди; Шен, Цзе; Ву, Цзэнжуй; Лю, Гуйся; Ли, Филип В .; Тан, Юнь (26 ноября 2012 г.). «admetSAR: исчерпывающий источник и бесплатный инструмент для оценки химических свойств ADMET». Журнал химической информации и моделирования . 52 (11): 3099–3105. DOI : 10.1021 / ci300367a . ISSN 1549-960X . PMID 23092397 .
- ^ lookchem.com/Iproniazid