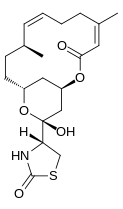
В latrunculins представляет собой семейство природных продуктов и токсинов , продуцируемых некоторыми губки , в том числе рода Latrunculia и Negombata , откуда является производными имя. Он связывает мономеры актина вблизи нуклеотид-связывающей щели со стехиометрией 1: 1 и предотвращает их полимеризацию . При введении in vivo этот эффект приводит к разрушению актиновых волокон цитоскелета и позволяет визуализировать соответствующие изменения, внесенные в клеточные процессы. Это свойство похоже на свойство цитохалазина., но имеет узкий диапазон эффективных концентраций. [1] Латрункулин был использован с большим эффектом в открытии регуляции распределения кадгерина и имеет потенциальное медицинское применение. [2] Латрункулин А, тип токсина, способен вызывать обратимые морфологические изменения в клетках млекопитающих, разрушая актиновую сеть. [3]
Латрункулин А:
| Молекулярная формула: | C 22 H 31 NO 5 S [4] |
|---|---|
| Молекулярный вес: | 421,552 г / моль [4] |
Цель и функции
Гельсолин - Латрункулин А вызывает блокировку концов; этот белок связывается с зазубренными сторонами актиновых нитей, что ускоряет зародышеобразование. Этот белок, регулируемый кальцием, также играет роль в сборке и разборке ресничек [4], что играет решающую роль в маневренности.
Латрункулин B:
| Молекулярная формула: | C 20 H 29 NO 5 S [4] |
| Молекулярный вес: | 395,514 г / моль |
Цель и функция
Актин-латрункулин B составляет структуру актиновых волокон.
Гомолог белковой спирали 2 - необходим для деления клеток, транспорта везикул внутри актинового филамента и необходим для образования расщепляющегося материала во время деления клеток [4] .
История [ править ]
Латрункулин - это токсин, который вырабатывается губками. Красная Latrunculia Magnifica Keller - многочисленная губка в Эйлатском и Суэцком заливах [5] в Красном море, где обитает на глубине 6–30 метров. [6]Токсин был обнаружен примерно в 1970 году. Исследователи заметили, что красные губки, Latrunculia Magnifica Keller, никогда не были повреждены и съедены рыбами, в то время как другие были повреждены. Кроме того, когда исследователи сжали губки в море, они заметили, что из них вышла красная жидкость. Рыбы поблизости сразу же покинули окрестности, когда губка выделила жидкость. Это были первые признаки того, что эти губки вырабатывают токсин. Позже гипотезу подтвердили, выдавив губку в аквариум с рыбками. Рыба показала потерю равновесия и сильное кровотечение и погибла всего через 4–6 минут. [6] Подобные эффекты наблюдались при введении токсина мышам.
Латрункулин составляет до 0,35% от сухой массы губки. [5] Существует две основные формы токсина: A и B. Латрункулин A присутствует только в губках, обитающих в Суэцком заливе, тогда как латрункулин B присутствует только в губках в Эйлатском заливе. Почему это так, расследование продолжается. [5]
Структура [ править ]
Существует несколько изомеров латрункулина: A, B, C, D, G, H, M, S и T. Наиболее распространенными структурами являются латрункулин A и B. Их формулы - соответственно C 22 H 31 NO 5 S и C 20 H. 29 NO 5 S. Верхнее макролактоновое кольцо , содержащее двойные связи, является структурной особенностью молекул латрункулина. Боковая цепь содержит заменитель ацилтиазолидинона . Помимо этих природных форм, ученые создали синтетические формы с разной токсичностью. На рис. 2 показаны некоторые из этих форм с их относительной способностью нарушать активность микрофиламентов . Полусинтетическийформы, содержащие N-алкилированные производные, неактивны. [7]
Механизм действия [ править ]
Латрункулин А и латрункулин В влияют на полимеризацию актина . Латрункулин связывает мономеры актина вблизи нуклеотид-связывающей щели со стехиометрией 1: 1 и предотвращает их полимеризацию . [1] Предотвращается диссоциация нуклеотидных мономеров из нуклеотид-связывающей щели, что предотвращает полимеризацию. [8]
Экспериментальные данные показывают, что латрукулин-A является биологически активным в растворителе ДМСО , но не в водных растворах, как показано в культуре клеток и в ткани мозга [9], вероятно, из-за клеточной проницаемости.
Когда актин нарушается из-за латрункулина, токсины шига имеют больше шансов проникнуть в монослой кишечного эпителия в кишечной палочке , что может вызвать более высокую вероятность возникновения желудочно-кишечных заболеваний. [10]
Похоже, что мономеры актина более чувствительны к связыванию латрункулина A, чем к связыванию латрункулина B. [11] Другими словами, латрункулин A является более сильным токсином. Латрункулин B инактивируется быстрее, чем латрункулин A. [12]
Предотвращение полимеризации актиновых филаментов вызывает обратимые изменения морфологии клеток млекопитающих. [13] Лантранкулин нарушает структуру цитоскелета у крыс. [14]
После воздействия латрункулина B фибробласты мыши вырастают в размерах, и клетки почек PtK2 из стебля ротора производят длинные разветвленные удлинения. [15] Расширения, по-видимому, представляют собой скопление мономеров актина.
Метаболизм [ править ]
Клетки дрожжей в отсутствие белков osh3 или osh5 демонстрируют гиперчувствительность к латрункулину B. [16] Белки osh гомологичны ферментам, генерируемым OSBP, которые появляются у млекопитающих, что указывает на то, что они могут играть роль в токсикокинетике латрункулина.
Мутанты дрожжей, устойчивые к латрункулину, обнаруживают мутацию D157E, которая инициирует водородную связь с латрункулином. [8] Другие мутанты дрожжей регулируют сайт связывания, делая его устойчивым к латрункулину.
Не проводилось никаких исследований, чтобы выяснить, как биотрансформация латрункулина работает в эукариотических клетках. Однако исследования показывают, что это неизмененная форма латрункулина, вызывающая токсические эффекты. [3]
Токсичность [ править ]
Поскольку латрункулин ингибирует полимеризацию актина и сократительную способность актомиозина , воздействие латрункулина может привести к клеточной релаксации, расширению дренажных тканей и снижению сопротивления оттоку, например, в трабекулярной сети .
Завод [ править ]
Латрункулин B вызывает заметное и дозозависимое снижение частоты прорастания пыльцы и скорости роста пыльцевых трубок . [17]
Добавление латрункулина B к растворам F-актина пыльцы приводило к быстрому уменьшению общего количества полимера, причем степень деполимеризации возрастала с увеличением концентрации токсичного вещества. Концентрация латрункулина B, необходимая для полумаксимального ингибирования прорастания пыльцы, составляет от 40 до 50 нМ, тогда как расширение пыльцевой трубки гораздо более чувствительно, требуя только 5-7 нМ LATB для полумаксимального ингибирования. Нарушение прорастания и роста пыльцевых трубок латрункулином B частично обратимо при низких концентрациях. (<30 нМ). [17]
Животное [ править ]
Выдавливание Latrunculia magnifica в аквариум с рыбками вызывает их почти немедленное возбуждение, за которым следует кровотечение , потеря равновесия и смерть через 4–6 минут. [18]
Латрункулин А использовался в качестве ингибитора акросомной реакции у морских свинок в лабораторных условиях. [19]
Человек [ править ]
Lat-A-вызывает снижение сократимости актомиозина. Это связано с расширением пористой структуры трабекулярной сети без доказательств снижения экспрессии структурных белков внеклеточного матрикса или жизнеспособности клеток. [20] В высоких дозах латрункулин может вызывать острое повреждение клеток и запрограммированную гибель клеток за счет активации пути каспазы-3/7. [18]
Смертельные дозы [ править ]
TDLO - Самая низкая опубликованная токсическая доза
LD50 - средняя летальная доза [21]
| Показатель | Разновидность | Доза |
| Оральный ТДЛО | мужчина | 1,14 мл / кг, 650 мг / кг |
| Оральный LD50 | Крыса | 7,06 мг / кг |
| Оральный LD50 | Мышь | 3,45 г / кг, 10,5 мл / кг |
| Оральный LD50 | Кролик | 6,30 мг / кг |
| Вдыхание LC50 | Крыса | 6 ч: 5,900 мг / м3 10 ч: 20 000 частей на миллион |
| Вдыхание LCLO | Мышь | 7 часов: 29 300 частей на миллион |
| Вдыхание TCLO | Человек | 20 м: 2,500 мг / м3 30 м: 1800 частей на миллион |
| Раздражение глаз | Кролик | 24 часа: 500 мг |
| Раздражение кожи | Кролик | 24 часа: 20 мг |
Приложения [ править ]
В природе латрункулины используются самими губками в качестве защитного механизма и с той же целью также изолируются некоторыми голожаберниками . [22]
Латрункулины производятся для фундаментальных исследований и имеют потенциальное медицинское применение, поскольку латрункулины и их производные проявляют антиангионическую, антипролиферативную, антимикробную и антиметастатическую активность. [2]
Механизм защиты [ править ]
Как и многие другие сидячие организмы, губки богаты вторичными метаболитами с токсическими свойствами, и большинство из них, включая латрункулин, играют защитную роль от хищников , конкурентов и эпибионтов . [23]
Сами губки латрункулином не повреждаются. В качестве меры против самотоксинации они удерживают латрункулин в мембраносвязанных вакуолях , которые также функционируют как секреторные и запасающие везикулы. Эти вакуоли свободны от актина и предотвращают попадание латрункулина в цитозоль, где он может повредить актин. [23] После производства в хоаноцитах латрункулин переносится через археоциты в уязвимые области губок, где необходима защита, например, в поврежденные или регенерирующие участки. [23]
Секвестр голожаберниками [ править ]
Морские слизни из рода Chromodoris выделяют различные токсические вещества из губок, которые они едят в качестве защитных метаболитов, включая латрункулин. Они выборочно переносят и хранят латрункулин в тех участках мантии, которые наиболее уязвимы для потенциальных хищников. [22] Считается, что пищеварительная система голожаберников играет важную роль в детоксикации. [22]
В 2015 году открытие, что пять близкородственных морских слизней из рода Chromodoris используют латрункулин в качестве защиты, указывает на то, что яд может быть использован с помощью мюллеровской мимикрии . [22]
Исследование [ править ]
Латрункулины используются для фундаментальных исследований, таких как исследования цитоскелета. Многие функции актина были определены с помощью латрункулинов для блокирования полимеризации актина с последующим изучением их воздействия на клетку. С помощью этого метода была показана важность актина для поляризованной локализации белков, поляризованного экзоцитоза и поддержания полярности клеток. [24]
В области нейробиологии латрункулин использовался для демонстрации роли актина в регуляции потенциалзависимых ионных каналов в различных нервных клетках [25], показывая, что лечение латрункулином может изменять электрическую активность нервных клеток. [25] [26] Латрункулин демонстрирует дозозависимое ингибирование K + -токов, а его острое применение может вызвать возбуждение множественных потенциалов действия , которые могут лежать в основе механизма защиты через ноцицепторы . [26] Кроме того, латрункулин-A был использован для демонстрации роли дентритного сжатия шейки позвоночника для индукции синаптической пластичности [9] .
Медицинские приложения [ править ]
Латрункулин А и В и его производные могут стать новыми химиотерапевтическими агентами. [2] [27] Возможное использование латрункулина в качестве ингибиторов роста опухолевых клеток уже были исследованы для некоторых форм рака желудка , [18] метастатический рак молочной железы [27] и опухоль простаты . [28] В более низких дозах латрункулин можно использовать для уменьшения дезагрегации и миграции клеток, тем самым предотвращая инвазивную активность опухолевых клеток. [28] В более высоких дозах латрункулин может вызывать острое повреждение клеток и запрограммированную гибель клеток за счет активации пути каспазы-3/7 и, таким образом, использоваться для уничтожения опухолевых клеток.[18]
Латрункулин также является потенциальным терапевтическим средством при глазной гипертензии и глаукоме . Латрункулин А и В разрушает актиновый цитоскелет трабекулярной сети, который важен для регулирования сопротивления оттоку жидкости и, следовательно, внутриглазного давления. [29] [30] Посредством клеточной релаксации и ослабления межклеточных соединений латрункулин может усилить отток юмора. Первое испытание на людях лантрукулина B для лечения глазной гипертензии и глаукомы показало значительно более низкое внутриглазное давление у пациентов. [30]
Ссылки [ править ]
- ^ a b Braet F, De Zanger R, Jans D, Spector I, Wisse E (сентябрь 1996 г.). «Агент, разрушающий микрофиламенты, латрункулин A индуцирует и увеличивает количество окон в синусоидальных эндотелиальных клетках печени крысы: сравнение с цитохалазином B». Гепатология . 24 (3): 627–35. DOI : 10.1002 / hep.510240327 . PMID 8781335 .
- ^ a b c Эль-Сайед К.А., Юсеф Д.Т., Маркетти Д. (февраль 2006 г.). «Биоактивные природные и полусинтетические латрункулины». Журнал натуральных продуктов . 69 (2): 219–23. DOI : 10.1021 / np050372r . PMID 16499319 .
- ^ a b Coué M, Brenner SL, Spector I, Korn ED (март 1987). «Ингибирование полимеризации актина латрункулином А» . Письма FEBS . 213 (2): 316–8. DOI : 10.1016 / 0014-5793 (87) 81513-2 . PMID 3556584 .
- ^ а б в Pubchem. «Латрункулин А» . pubchem.ncbi.nlm.nih.gov . Проверено 26 апреля 2018 .
- ^ a b c Groweiss A, Shmueli U, Kashman Y (1983-10-01). «Морские токсины Latrunculia magnifica». Журнал органической химии . 48 (20): 3512–3516. DOI : 10.1021 / jo00168a028 .
- ^ a b Kashman V, Groweiss A, Shmueli U (январь 1980 г.). «Латрункулин, новый макролид 2-тиазолидинона из морской губки». Буквы тетраэдра . 21 (37): 3629–3632. DOI : 10.1016 / 0040-4039 (80) 80255-3 .
- Перейти ↑ Maier ME (май 2015 г.). «Дизайн и синтез аналогов натуральных продуктов» . Органическая и биомолекулярная химия . 13 (19): 5302–43. DOI : 10.1039 / C5OB00169B . PMID 25829247 .
- ^ a b Morton WM, Ayscough KR, McLaughlin PJ (июнь 2000 г.). «Латрункулин изменяет поверхность раздела актин-мономерная субъединица, чтобы предотвратить полимеризацию». Природа клеточной биологии . 2 (6): 376–8. DOI : 10.1038 / 35014075 . hdl : 1842/757 . PMID 10854330 .
- ^ a b Tazerart S, Mitchell DE, Miranda-Rottmann S, Araya R (август 2020 г.). «Правило пластичности дендритных шипов, зависящее от времени спайков» . Nature Communications . 11 (1): 4276. DOI : 10.1038 / s41467-020-17861-7 . PMC 7449969 . PMID 32848151 .
- ^ Maluykova I, O Гуцал, Laiko M, Kane A, Donowitz M, Kovbasnjuk O (июнь 2008). «Латрункулин В способствует трансцеллюлярному трансцитозу токсина Шига 1 через эпителиальные клетки кишечника Т84» . Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни . 1782 (6): 370–7. DOI : 10.1016 / j.bbadis.2008.01.010 . PMC 2509583 . PMID 18342638 .
- ^ Wakatsuki T, Schwab B, Thompson NC, Elson EL (март 2001). «Влияние цитохалазина D и латрункулина B на механические свойства клеток». Журнал клеточной науки . 114 (Pt 5): 1025–36. PMID 11181185 .
- ^ Spector I, шойхет NR, Blasberger D, Kashman Y (1989). «Латрункулины - новые морские макролиды, которые нарушают организацию микрофиламентов и влияют на рост клеток: I. Сравнение с цитохалазином D». Подвижность клеток и цитоскелет . 13 (3): 127–44. DOI : 10,1002 / см. 970130302 . PMID 2776221 .
- ^ Пендлтон A, Koffer A (январь 2001). «Действие латрункулина раскрывает потребности актинового цитоскелета во время секреции тучными клетками». Подвижность клеток и цитоскелет . 48 (1): 37–51. DOI : 10.1002 / 1097-0169 (200101) 48: 1 <37 :: помощь-см4> 3.0.co; 2-0 . PMID 11124709 .
- ^ Ярмола EG, Сомасундарам T, расточные Т.А., Spector I, Bubb MR (сентябрь 2000 г.). «Актин-латрункулин А структура и функция. Дифференциальная модуляция функции актин-связывающего белка латрункулином А» . Журнал биологической химии . 275 (36): 28120–7. DOI : 10,1074 / jbc.m004253200 . PMID 10859320 .
- ^ Gronewold TM, асс F, H Lünsdorf Рейхенбах H (январь 1999). «Влияние ризоподина и латрункулина B на морфологию и на актиновый цитоскелет клеток млекопитающих». Клеточные и тканевые исследования . 295 (1): 121–9. DOI : 10.1007 / s004410051218 . PMID 9931358 .
- ^ Fairn GD, МакМастер CR (январь 2008). «Новые роли семейства оксистерин-связывающих белков в метаболизме, транспорте и передаче сигналов». Клеточные и молекулярные науки о жизни . 65 (2): 228–36. DOI : 10.1007 / s00018-007-7325-2 . PMID 17938859 .
- ^ a b Гиббон BC, Ковар Д.Р., Штайгер С.Дж. (декабрь 1999 г.). «Латрункулин B по-разному влияет на прорастание пыльцы и рост трубок» . Растительная клетка . 11 (12): 2349–63. DOI : 10.1105 / tpc.11.12.2349 . PMC 144132 . PMID 10590163 .
- ^ a b c d Кониси Х, Кикучи С., Очиай Т, Икома Х, Кубота Т, Итикава Д., Фудзивара Х, Окамото К., Сакакура С, Сонояма Т, Кокуба Й, Сасаки Х, Мацуи Т, Оцудзи Э (июнь 2009 г.) . «Латрункулин А обладает сильным противоопухолевым действием в модели перитонеального распространения рака желудка у человека у мышей». Противораковые исследования . 29 (6): 2091–7. PMID 19528469 .
- ^ Роа-Espitia А.Л., Ернандес-Рендон ЭР, Baltiérrez-Ойос R, Муньос-Gotera RJ, Кот-Велес А, Хименес я, Гонсалес-Маркеса Н, Ернандес-Гонсалес ЭО (сентябрь 2016). «Киназа фокальной адгезии необходима для полимеризации актина и ремоделирования цитоскелета во время емкости сперматозоидов» . Биология открытая . 5 (9): 1189–99. DOI : 10.1242 / bio.017558 . PMC 5051654 . PMID 27402964 .
- ^ Spector I, шойхет NR, Kashman Y, Groweiss A (февраль 1983). «Латрункулины: новые морские токсины, которые нарушают организацию микрофиламентов в культивируемых клетках». Наука . 219 (4584): 493–5. DOI : 10.1126 / science.6681676 . PMID 6681676 .
- ^ Cayman chemical (2017). «ПАСПОРТ БЕЗОПАСНОСТИ Латрункулина А» (PDF) .
- ^ a b c d Чейни К.Л., Уайт А., Мудианта И.В., Винтерс А.Э., Кесада М., Капон Р.Дж., Молло Е., Гарсон М.Дж. (20.01.2016). «Выберите свое оружие: выборочное хранение одного токсичного соединения, латрункулина А, близкородственными голожаберными моллюсками» . PLOS ONE . 11 (1): e0145134. DOI : 10.1371 / journal.pone.0145134 . PMC 4720420 . PMID 26788920 .
- ^ a b c Gillor O, Carmeli S, Rahamim Y, Fishelson Z, Ilan M (май 2000 г.). «Иммунолокализация токсина латрункулина B в губке Красного моря Negombata magnifica (Demospongiae, Latrunculiidae)». Морская биотехнология . 2 (3): 213–23. DOI : 10.1007 / s101260000026 . PMID 10852799 .
- ^ Ayscough КР, Страйкер Дж, Pokala Н, Сандерс М, Р Экипажи, Drubin DG (апрель 1997 г.). «Высокие скорости оборота актиновых филаментов у почкующихся дрожжей и роль актина в установлении и поддержании клеточной полярности были выявлены с использованием ингибитора актина латрункулина-A» . Журнал клеточной биологии . 137 (2): 399–416. DOI : 10,1083 / jcb.137.2.399 . PMC 2139767 . PMID 9128251 .
- ^ а б Шуберт Т, Акопян А (2004). «Актиновые филаменты регулируют потенциал-зависимые ионные каналы в ганглиозных клетках сетчатки саламандры». Неврология . 125 (3): 583–90. DOI : 10.1016 / j.neuroscience.2004.02.009 . PMID 15099672 .
- ^ a b Houssen WE, Jaspars M, Wease KN, Scott RH (январь 2006 г.). «Острое действие морского токсина латрункулина А на электрофизиологические свойства культивированных нейронов ганглиев задних корешков». Сравнительная биохимия и физиология. Токсикология и фармакология . 142 (1–2): 19–29. DOI : 10.1016 / j.cbpc.2005.09.006 . PMID 16280258 .
- ^ a b Ханфар М.А., Юсеф Д.Т., Эль-Сайед К.А. (февраль 2010 г.). «Полусинтетические производные латрункулина как ингибиторы метастатического рака молочной железы: биологические оценки, предварительные исследования взаимосвязи структура-активность и молекулярное моделирование» . ChemMedChem . 5 (2): 274–85. DOI : 10.1002 / cmdc.200900430 . PMC 3529144 . PMID 20043312 .
- ^ a b Сайед К.А., Ханфар М.А., Шаллал Х.М., Муралидхаран А., Авате Б., Юсеф Д. Т., Лю Й., Чжоу Ю. Д., Нэгл Д. Г., Шах Г. (март 2008 г.). «Латрункулин А и его C-17-O-карбаматы ингибируют инвазию опухолевых клеток простаты и активацию HIF-1 в опухолевых клетках груди» . Журнал натуральных продуктов . 71 (3): 396–402. DOI : 10.1021 / np070587w . PMC 2930178 . PMID 18298079 .
- ^ Гонсалес JM, Ко М.К., Pouw А, Тан JC (февраль 2016). «Тканевый многофотонный анализ актомиозина и структурных реакций в трабекулярной сети человека» . Научные отчеты . 6 (1): 21315. DOI : 10.1038 / srep21315 . PMC 4756353 . PMID 26883567 .
- ^ a b Расмуссен CA, Кауфман П.Л., Ритч Р., Хак Р., Браззелл Р.К., Виттитов Д.Л. (сентябрь 2014 г.). «Латрункулин B снижает внутриглазное давление при глазной гипертензии и первичной открытоугольной глаукоме» . Трансляционное видение науки и технологий . 3 (5): 1. doi : 10.1167 / tvst.3.5.1 . PMC 4164113 . PMID 25237590 .