Вольтамперометрия - это категория электроаналитических методов, используемых в аналитической химии и различных промышленных процессах. В вольтамперометрии информацию об аналите получают путем измерения тока при изменении потенциала. [1] [2] Аналитические данные для вольтамперометрического эксперимента поступают в виде вольтамперограммы, которая отображает ток, производимый аналитом, в зависимости от потенциала рабочего электрода. [3]
Трехэлектродная система [ править ]

Вольтамперометрии эксперименты исследовать Полуэлемент реактивность аналита . Вольтамперометрия - это исследование зависимости тока от приложенного потенциала. Эти кривые I = f (E) называются вольтамперограммами. Потенциал изменяется произвольно, шаг за шагом или непрерывно, а фактическое значение тока измеряется как зависимая переменная. Обратное, то есть амперометрия , также возможно, но не часто. Форма кривых зависит от скорости изменения потенциала (характера движущей силы) и от того, перемешивается раствор или находится в состоянии покоя (массоперенос). В большинстве экспериментов контролируется потенциал ( вольт ) электрода, контактирующего с аналитом, при измерении результирующего тока.( амперы ). [4]
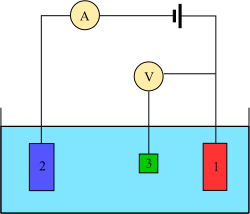
Для проведения такого эксперимента требуется как минимум два электрода. Рабочий электрод , который вступает в контакт с анализируемым веществом, необходимо применить желаемый потенциал контролируемым образом и облегчить перенос заряда к и от анализируемого вещества. Второй электрод действует как другая половина ячейки. Этот второй электрод должен иметь известный потенциал, с помощью которого можно измерить потенциал рабочего электрода; кроме того, он должен уравновешивать заряд, добавляемый или удаляемый рабочим электродом. Хотя это жизнеспособная установка, у нее есть ряд недостатков. Что наиболее важно, для электрода чрезвычайно трудно поддерживать постоянный потенциал при пропускании тока для противодействия окислительно-восстановительным явлениям на рабочем электроде.
Чтобы решить эту проблему, функции подачи электронов и обеспечения опорного потенциала разделены между двумя отдельными электродами. Эталонный электрод представляет собой половину ячейки с известным потенциалом восстановления. Его единственная роль - действовать в качестве эталона при измерении и управлении потенциалом рабочего электрода, и ни в какой точке он не пропускает какой-либо ток. Вспомогательный электрод проходит весь ток , необходимый , чтобы сбалансировать ток наблюдаемый на рабочем электроде. Чтобы достичь этого тока, вспомогательный компонент часто будет колебаться до экстремальных потенциалов на краях окна для растворителя , где он окисляет или восстанавливает растворитель или поддерживающий электролит. Эти электроды: рабочий , эталонный ивспомогательный состав современной трехэлектродной системы.
Существует много систем с большим количеством электродов, но принципы их конструкции, как правило, такие же, как и у трехэлектродной системы. Например, вращающийся кольцевой дисковый электрод имеет два отдельных и отдельных рабочих электрода, диск и кольцо, которые можно использовать для сканирования или удержания потенциалов независимо друг от друга. Оба эти электрода уравновешены одной комбинацией опорного и вспомогательного электродов, что дает общую конструкцию из четырех электродов. В более сложных экспериментах при необходимости могут быть добавлены рабочие электроды, а иногда и электроды сравнения или вспомогательные электроды.
На практике может оказаться важным иметь рабочий электрод с известными размерами и характеристиками поверхности. В результате рабочие электроды обычно регулярно чистят и полируют. Вспомогательный электрод может быть практически любым, если он не вступает в реакцию с основной массой раствора аналита и хорошо проводит. Обычно (или было?) Ртуть использовалась в качестве рабочего электрода, например, DME и HMDE , а также в качестве вспомогательного, и метод вольтамперометрии получил название полярографии . Эталон - самый сложный из трех электродов; используется множество стандартов, и их стоит изучить в другом месте. Для неводных работ IUPAC рекомендует использовать ферроцен / ферроцений.пара как внутренний стандарт. [5] В большинстве экспериментов по вольтамперометрии объемный электролит (также известный как поддерживающий электролит ) используется для минимизации сопротивления раствора. Можно провести эксперимент без объемного электролита, но добавленное сопротивление значительно снижает точность результатов. В ионных жидкостях комнатной температуры растворитель может действовать как электролит.
Теория [ править ]
Анализ данных требует рассмотрения кинетики в дополнение к термодинамике из-за временной составляющей вольтамперометрии. Идеализированные теоретические электрохимические термодинамические отношения, такие как уравнение Нернста , моделируются без временной составляющей. Хотя эти модели являются недостаточными в одиночку , чтобы описать динамические аспекты вольтамперометрии, модель , как уравнения Тафеля и уравнения Батлер-Фольмер заложить основу для модифицированных отношений вольтамперограмм , которые относятся теория к наблюдаемым результатам. [6]
Типы вольтамперометрии [ править ]
- Вольтамперометрия с линейной разверткой
- Лестничная вольтамперометрия
- Прямоугольная вольтамперометрия
- Циклическая вольтамперометрия - вольтамперометрический метод, который можно использовать для определения коэффициентов диффузии и потенциалов восстановления половины ячейки .
- Анодная вольтамперометрия - количественный аналитический метод анализа следов катионов металлов. Аналит осаждается ( гальванически ) на рабочий электрод на этапе осаждения, а затем окисляется на этапе удаления. Ток измеряется на этапе снятия изоляции.
- Катодная вольтамперометрия - количественный аналитический метод анализа следов анионов. Применяется положительный потенциал, окисляющий ртутный электрод и образующий нерастворимые осадки анионов. Затем отрицательный потенциал переводит (снимает) осажденную пленку в раствор.
- Адсорбционная вольтамперометрия - количественный аналитический метод анализа следов. Аналит осаждается просто путем адсорбции на поверхности электрода (т. Е. Без электролиза), а затем подвергается электролизу для получения аналитического сигнала. Часто используются химически модифицированные электроды.
- Вольтамперометрия переменного тока
- Полярография - подкласс вольтамперометрии, в котором рабочим электродом является капающий ртутный электрод (DME), полезный благодаря широкому катодному диапазону и возобновляемой поверхности.
- Вольтамперометрия с вращающимся электродом - гидродинамический метод, при котором рабочий электрод , обычно вращающийся дисковый электрод (RDE) или вращающийся дисковый электрод (RRDE), вращается с очень высокой скоростью. Этот метод полезен для изучения кинетики и механизма электрохимической реакции для полуреакции .
- Нормальная импульсная вольтамперометрия
- Дифференциальная импульсная вольтамперометрия
- Хроноамперометрия
История [ править ]
Зарождение вольтамперометрии способствовало открытию полярографии в 1922 году химиком Ярославом Гейровским, лауреатом Нобелевской премии . Ранние вольтамперометрические методы имели много проблем, что ограничивало их жизнеспособность для повседневного использования в аналитической химии. В полярографии эти проблемы включали тот факт, что ртуть окисляется при потенциале более положительном, чем +0,2, что затрудняет анализ результатов для аналитов в положительной области потенциала. Другая проблема заключалась в остаточном токе, возникающем при зарядке большой емкости поверхности электрода. [7]Когда Гейровский впервые зарегистрировал первую зависимость тока, протекающего через падающий ртутный электрод, от приложенного потенциала в 1922 году, он провел измерения по точкам и построил вольт-амперную кривую. Это считалось первой полярограммой. Чтобы облегчить этот процесс, он вместе с М. Шикатой сконструировал так называемый полярограф, который позволил ему сфотографировать ту же самую кривую за считанные часы. ВНИМАНИЕ !!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!!! Он признал важность потенциала и управления им, а также признал возможности измерения ограничивающих токов. Он также был важным участником внедрения ртутного ртутного электрода как современного инструмента. [8]
В 1942 году Арчи Хиклинг построил первый потенциостат с тремя электродами, что явилось достижением в области электрохимии. [9] Он использовал этот потенциостат для контроля напряжения на электроде. Тем временем, в конце 1940-х годов Кеннет Коул изобрел электронную схему, которую он назвал зажимом напряжения. Зажим напряжения использовался для анализа ионной проводимости в нервах.
1960-е и 1970-е годы ознаменовались многими достижениями в теории, приборостроении и внедрением компьютерных систем с добавлением и управлением. Современные полярографические и вольтамперометрические методы на ртутных электродах представлены в трех разделах.
Первый раздел включает разработку ртутных электродов. Были изготовлены следующие электроды: капельный ртутный электрод, ртутный паровой электрод, висящий ртутный капельный электрод, статический ртутный капельный электрод, ртутный пленочный электрод, электроды из ртутной амальгамы, ртутные микроэлектроды, химически модифицированные ртутные электроды, ртутные электроды с контролируемым ростом и стягивающиеся электроды в виде капли .
Также были усовершенствованы используемые методы измерения. Эти методы измерения включают в себя: классическую полярографию постоянного тока, осциллополярографию, переключатель Калусека, полярографию переменного тока, магнитную поляографию, полярографию с нормальным импульсом, дифференциальную импульсную полярографию, прямоугольную вольтамперометрию, циклическую вольтамперометрию, анодную вольтамперометрию, методы свертки и методы исключения.
Наконец, были также усовершенствованы методы предварительного концентрирования, которые привели к увеличению чувствительности ртутных электродов. Это произошло благодаря развитию анодной вольтамперометрии, катодной вольтамперометрии и адсорбционной вольтамперометрии. [8]
Эти достижения улучшили чувствительность и создали новые аналитические методы, которые побудили промышленность отреагировать на это выпуском более дешевых потенциостатов , электродов и ячеек, которые можно было бы эффективно использовать в рутинной аналитической работе.
Приложения [ править ]
Вольтамперометрические датчики [ править ]
Ряд вольтамперометрических систем выпускается на коммерческой основе для определения конкретных видов, представляющих интерес для промышленности и исследований. Эти устройства иногда называют электродами, но на самом деле они представляют собой полные вольтамперометрические ячейки, и их лучше называть датчиками . Эти датчики могут использоваться для анализа различных органических и неорганических аналитов в различных матрицах. [10]
Кислородный электрод [ править ]
Определение растворенного кислорода в различных водных средах, таких как морская вода, кровь, сточные воды, сточные воды химических предприятий и почвы, имеет огромное значение для промышленности, биомедицинских и экологических исследований и клинической медицины. Одним из наиболее распространенных и удобных методов проведения таких измерений является кислородный датчик Кларка , который был запатентован LC Clark, Jr. в 1956 году.
См. Также [ править ]
- ВАХ
- Неополярограмма
Ссылки [ править ]
- ^ Киссинджер, Питер; Уильям Р. Хейнеман (1996-01-23). Лабораторные методы в электроаналитической химии, второе издание, исправленное и дополненное (2-е изд.). CRC. ISBN 0-8247-9445-1.
- ^ Zoski, Синтия Г. (2007-02-07). Справочник по электрохимии . Elsevier Science. ISBN 0-444-51958-0.
- ^ Харрис, Дэниел С. (2016-01-01). Количественный химический анализ, девятое издание (9 изд.). WH Freeman and Company. ISBN 978-1-4641-3538-5.
- ^ Бард, Аллен Дж .; Ларри Р. Фолкнер (2000-12-18). Электрохимические методы: основы и приложения (2-е изд.). Вайли. ISBN 0-471-04372-9.
- ^ Грицнер, G .; Дж. Кута (1984). «Рекомендации по регистрации электродных потенциалов в неводных растворителях» . Pure Appl. Chem . 56 (4): 461–466. DOI : 10,1351 / pac198456040461 . Проверено 17 апреля 2009 .
- ^ Николсон, RS; Ирвинг. Шайн (1964-04-01). «Теория стационарной электродной полярографии. Однократные и циклические методы, применяемые к обратимым, необратимым и кинетическим системам». Аналитическая химия . 36 (4): 706–723. DOI : 10.1021 / ac60210a007 .
- ^ Kounaves, Самуэль. «Вольтамперометрические методы». Кафедра химии Университета Тафтса
- ^ a b Барек, Дж. (2003). «Восемьдесят лет полярографии - история и будущее». Электроанализ . 15 : 467–472.
- ^ Хиклинг, А. (1942). «Исследования по поляризации электродов. Часть IV.-Автоматический контроль потенциала рабочего электрода». Труды общества Фарадея . 38 : 27–33. DOI : 10.1039 / TF9423800027 .
- ^ Сангхави, Банким; Шривастава, Ашвини (2010). «Одновременное вольтамперометрическое определение ацетаминофена, аспирина и кофеина с использованием in situ модифицированного поверхностно-активным веществом многослойного пастообразного электрода из углеродных нанотрубок». Electrochimica Acta . 55 : 8638–8648. DOI : 10.1016 / j.electacta.2010.07.093 .
Дальнейшее чтение [ править ]
- Рейнмут, WH (1961-11-01). «Теория стационарной электродной полярографии». Аналитическая химия . 33 (12): 1793–1794. DOI : 10.1021 / ac60180a004 .
- Скуг, Дуглас А .; Дональд М. Уэст; Ф. Джеймс Холлер (1995-08-25). Основы аналитической химии (7-е изд.). Издательство колледжа Харкорт Брейс. ISBN 0-03-005938-0.
- Занелло, П. (2003-10-01). Неорганическая электрохимия: теория, практика и применение (1-е изд.). Королевское химическое общество. ISBN 0-85404-661-5.
Внешние ссылки [ править ]
- http://new.ametek.com/content-manager/files/PAR/App%20Note%20E-4%20-%20Electrochemical%20Analysis%20Techniques1.pdf
- [1]