Белок, индуцирующий сборку актина
Белок , индуцирующий сборку актина ( ActA ), представляет собой белок, кодируемый и используемый Listeria monocytogenes для продвижения через клетку-хозяина млекопитающего. ActA представляет собой бактериальный поверхностный белок, содержащий трансмембранную область. [1] В клетке млекопитающих бактериальный ActA взаимодействует с комплексом Arp2/3 и мономерами актина , вызывая полимеризацию актина на поверхности бактерий, образуя хвост актиновой кометы. Ген, кодирующий ActA, называется actA или prtB. [2]
Как только бактерии L. monocytogenes попадают в организм человека, они интернализуются в клетки кишечного эпителия и быстро пытаются покинуть свою вакуоль для интернализации. [3] [4] В цитозоле они начинают полимеризовать актин на своей поверхности с помощью белка ActA. Было показано, что ActA не только необходим, но и достаточен для индукции подвижности бактерий в отсутствие других бактериальных факторов. [5]
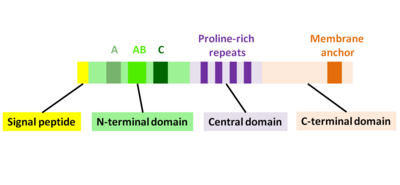
ActA был обнаружен путем анализа лецитиназо -негативных мутантов Tn 917-lac Listeria из-за фенотипа, согласно которому они не могли распространяться от клетки к клетке. Эти мутантные бактерии по-прежнему ускользали от фагосом так же эффективно, как бактерии дикого типа, и размножались внутри инфицированных клеток, но они не были окружены актином, как бактерии дикого типа. Дальнейший анализ показал, что Tn 917-lac встроился в actA , второй ген оперона. Третий ген этого оперона, plcB , кодирует лецитиназу L. monocytogenes . Чтобы определить, является ли сам actA , plcBили другие ко-транскрибируемые нижележащие области участвуют в сборке актина, генерируются мутации в соответствующих генах. Все мутанты, за исключением мутантов actA , были сходны с диким типом в отношении ассоциации с F-актином и межклеточным распространением. Комплементация с помощью actA восстанавливала фенотип дикого типа у мутантов actA . [1]
ActA представляет собой белок, который действует как имитатор белка синдрома Вискотта-Олдрича (WASP), фактора, способствующего нуклеации (NPF), присутствующего в клетках-хозяевах. NPF в клетке млекопитающих рекрутируют и связываются с уже существующими комплексами актин-родственных белков 2 и 3 (комплекс Arp2/3) и индуцируют активирующие конформационные изменения комплекса Arp2/3. [6]Из-за этого конформационного изменения NPFs инициируют полимеризацию нового актинового филамента под углом 70°, что приводит к характерным Y-разветвленным актиновым структурам на переднем крае подвижных клеток. ActA локализуется на старом полюсе бактерии и охватывает как бактериальную клеточную мембрану, так и клеточную стенку, латеральная диффузия ингибируется; таким образом, ActA локализуется поляризованным и закрепленным образом на бактериальной поверхности. Следовательно, полимеризация актина начинается только в этой области на поверхности бактерии. [7] Экспрессия ActA индуцируется только после проникновения в клетку-хозяин млекопитающего. [8]
Сборка актиновых филаментов создает силу, толкающую бактерию в цитоплазме хозяина млекопитающего вперед. Непрерывной полимеризации актина достаточно для подвижности в цитоплазме и даже для инфицирования соседних клеток. [9]
Новые данные указывают на то, что ActA также играет роль в разрушении вакуолей. Делеционный мутант ActA был дефектен в проницаемости вакуоли. Было показано, что участок из 11 аминокислот N-конца кислой области (32-42) важен для разрушения фагосомы . [10]