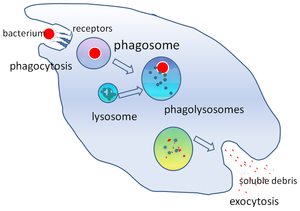
В клеточной биологии , A фагосома является везикула формируется вокруг частицы охвачены фагоцитами через фагоцитоз . Профессиональные фагоциты включают макрофаги , нейтрофилы и дендритные клетки (ДК). Фагосома образуется путем слияния клеточной мембраны вокруг микроорганизма , стареющей клетки или апоптозной клетки . Фагосомы имеют мембраносвязанные белки, которые рекрутируются и сливаются с лизосомами с образованием зрелых фаголизосом . Лизосомы содержатгидролитические ферменты и активные формы кислорода (АФК), которые убивают и переваривают патогены . Фагосомы также могут образовываться в непрофессиональных фагоцитах, но они могут охватывать только меньший диапазон частиц и не содержат АФК. Полезные материалы (например, аминокислоты ) из переваренных частиц перемещаются в цитозоль , а отходы удаляются путем экзоцитоза . Формирование фагосом имеет решающее значение для гомеостаза тканей и как врожденной, так и адаптивной защиты хозяина от патогенов.
Однако некоторые бактерии могут использовать фагоцитоз в качестве стратегии инвазии. Они либо воспроизводятся внутри фаголизосомы (например, Coxiella spp.) [1], либо уходят в цитоплазму до того, как фагосома сливается с лизосомой (например, Rickettsia spp.). [2] Многие микобактерии, включая Mycobacterium tuberculosis [3] [4] и Mycobacterium avium paratuberculosis , [5] могут манипулировать макрофагами хозяина.для предотвращения слияния лизосом с фагосомами и создания зрелых фаголизосом. Такое неполное созревание фагосомы поддерживает среду, благоприятную для патогенов внутри нее. [6]
Формирование [ править ]
Фагосомы достаточно велики, чтобы разлагать целые бактерии или апоптотические и стареющие клетки, которые обычно имеют диаметр> 0,5 мкм. [7] Это означает, что фагосома на несколько порядков больше эндосомы , которая измеряется в нанометрах .
Фагосомы образуются, когда патогены или опсонины связываются с трансмембранным рецептором, который случайным образом распределяется на поверхности клетки фагоцита. При связывании передача сигналов "снаружи-внутрь" запускает полимеризацию актина и образование псевдоподий , которые окружают и сливаются с микроорганизмом. Протеинкиназа C , фосфоинозитид-3-киназа и фосфолипаза C (PLC) необходимы для передачи сигналов и контроля интернализации частиц. [8] По мере того, как патоген окружен, с частицей может связываться больше рецепторов клеточной поверхности по механизму «застежки-молнии», что увеличивает авидность связывания . [9] Fc рецептор(FcR), рецепторы комплемента (CR), рецептор маннозы и Dectin-1 являются фагоцитарными рецепторами, что означает, что они могут вызывать фагоцитоз, если они экспрессируются в нефагоцитарных клетках, таких как фибробласты . [10] Другие белки, такие как Toll-подобные рецепторы , участвуют в распознавании паттернов патогенов и часто задействуются в фагосомах, но не вызывают специфического запуска фагоцитоза в нефагоцитарных клетках, поэтому они не считаются фагоцитарными рецепторами.
Опсонизация [ править ]
Опсонины - это молекулярные метки, такие как антитела и комплементы, которые прикрепляются к патогенам и активируют фагоцитоз. Иммуноглобулин G (IgG) является основным типом антител, присутствующих в сыворотке . Это часть адаптивной иммунной системы , но она связана с врожденной реакцией , рекрутируя макрофаги для фагоцитоза патогенов. Антитело связывается с микробами с помощью вариабельного домена Fab , а домен Fc связывается с рецепторами Fc (FcR), вызывая фагоцитоз.
Комплемент-опосредованная интернализация имеет гораздо менее значительные мембранные выступы, но нижестоящая передача сигналов обоих путей сходится, чтобы активировать Rho GTPases . [11] Они контролируют полимеризацию актина, которая необходима фагосомам для слияния с эндосомами и лизосомами.
Нефагоцитарные клетки [ править ]
Другие непрофессиональные фагоциты обладают некоторой степенью фагоцитарной активности, например, эпителиальные клетки щитовидной железы и мочевого пузыря, которые могут поглощать эритроциты, и эпителиальные клетки сетчатки, которые усваивают стержни сетчатки. [7] Однако непрофессиональные фагоциты не экспрессируют специфические фагоцитарные рецепторы, такие как FcR, и имеют гораздо более низкую скорость интернализации.
Некоторые инвазивные бактерии также могут вызывать фагоцитоз в нефагоцитарных клетках, чтобы опосредовать захват организма хозяином. Например, Shigella может секретировать токсины, которые изменяют цитоскелет хозяина и проникают в базолатеральную сторону энтероцитов . [12]
Структура [ править ]
Поскольку мембрана фагосомы образована путем слияния плазматической мембраны, основной состав фосфолипидного бислоя остается таким же. Затем эндосомы и лизосомы сливаются с фагосомой, чтобы внести свой вклад в мембрану, особенно когда поглощенная частица очень большая, например паразит . [13] Они также доставляют различные мембранные белки к фагосомам и изменяют структуру органелл.
Фагосомы могут поглощать искусственные латексные шарики низкой плотности, а затем очищаться в градиенте концентрации сахарозы , что позволяет изучать структуру и состав. [14] Процесс созревания также может быть охарактеризован путем очистки фагосом в разные моменты времени. Ранние фагосомы характеризуются Rab5, который переходит в Rab7 по мере созревания пузырьков в поздние фагосомы.
Процесс созревания [ править ]
Возникающая фагосома по своей природе не является бактерицидной. По мере созревания он становится более кислым от pH 6,5 до pH 4 и приобретает характерные белковые маркеры и гидролитические ферменты. Различные ферменты действуют при различных оптимальных значениях pH, образуя диапазон, поэтому каждый из них работает на узких стадиях процесса созревания. Активность ферментов можно точно настроить, изменив уровень pH, что обеспечивает большую гибкость. Фагосомы двигаются вдоль микротрубочек в цитоскелете , дублирующий с эндосомой и лизосомой последовательно в динамике «поцелуй и убежать» образом. [15]Этот внутриклеточный транспорт зависит от размера фагосом. Органеллы большего размера (с диаметром около 3 мкм) очень устойчиво транспортируются от периферии клетки к перинуклеарной области, тогда как органеллы меньшего размера (диаметром около 1 мкм) транспортируются более двунаправленно взад и вперед между центром клетки и периферией клетки. [16] Вакуолярные протонные насосы(v-АТФаза) доставляются к фагосомам для подкисления компартмента органелл, создавая более враждебную среду для патогенов и облегчая деградацию белка. Бактериальные белки денатурируются при низком pH и становятся более доступными для протеаз, на которые не влияет кислая среда. Позднее ферменты рециркулируются из фаголизосомы перед перевариванием, поэтому они не теряются. Состав фосфолипидной мембраны также изменяется по мере созревания фагосомы. [14]
Слияние может занять от нескольких минут до часов в зависимости от содержимого фагосомы; Слияние, опосредованное FcR или рецептором маннозы, длится менее 30 минут, но фагосомам, содержащим латексные шарики, может потребоваться несколько часов для слияния с лизосомами. [7] Предполагается, что состав фагосомной мембраны влияет на скорость созревания. Mycobacterium tuberculosis имеет очень гидрофобную клеточную стенку , которая, как предполагается, предотвращает повторное использование мембран и рекрутирование факторов слияния, поэтому фагосома не сливается с лизосомами, и бактерия избегает деградации. [17]
Молекулы меньшего размера в просвете переносятся путем слияния быстрее, чем молекулы большего размера, что предполагает образование небольшого водного канала между фагосомой и другими пузырьками во время «поцелуя и бегства», через который допускается только ограниченный обмен. [7]
Регулирование синтеза [ править ]
Вскоре после интернализации F-актин деполимеризуется из новообразованной фагосомы, поэтому он становится доступным для эндосом для слияния и доставки белков. [7] Процесс созревания делится на раннюю и позднюю стадии в зависимости от характерных белковых маркеров, регулируемых малыми Rab GTPases. Rab5 присутствует на ранних фагосомах и контролирует переход к поздним фагосомам, маркированным Rab7. [18]
Rab5 привлекает киназу PI-3 и другие связывающие белки, такие как Vps34, на мембрану фагосомы, поэтому эндосомы могут доставлять белки к фагосоме. Rab5 частично участвует в переходе к Rab7 через комплекс CORVET и комплекс HOPS у дрожжей. [18] Точный путь созревания у млекопитающих не совсем понятен, но предполагается, что HOPS может связывать Rab7 и замещать ингибитор диссоциации гуанозиновых нуклеотидов (GDI). [19] Rab11 участвует в рециклинге мембран. [20]
Фаголизосома [ править ]
Фагосома сливается с лизосомами с образованием фаголизосомы, которая обладает различными бактерицидными свойствами. Фаголизосома содержит активные формы кислорода и азота (ROS и RNS) и гидролитические ферменты. Компартмент также является кислым из-за протонных насосов (v-АТФаз), которые транспортируют H + через мембрану, используемые для денатурирования бактериальных белков.
Точные свойства фаголизосом варьируются в зависимости от типа фагоцита. Те, что находятся в дендритных клетках, обладают более слабыми бактерицидными свойствами, чем те, что находятся в макрофагах и нейтрофилах. Также макрофаги делятся на провоспалительные «киллеры» M1 и «ремонтные» M2. Фаголизосомы M1 могут метаболизировать аргинин в высокореактивный оксид азота , в то время как M2 использует аргинин для производства орнитина, способствующего пролиферации клеток и восстановлению тканей. [21]
Функция [ править ]
Распад патогенов [ править ]
Макрофаги и нейтрофилы - это профессиональные фагоциты, отвечающие за большую часть деградации патогенов, но они имеют разные бактерицидные методы. Нейтрофилы имеют гранулы, которые сливаются с фагосомой. Гранулы содержат НАДФН-оксидазу и миелопероксидазу , которые производят токсичные производные кислорода и хлора для уничтожения патогенов в результате окислительного взрыва . Протеазы и антимикробные пептиды также высвобождаются в фаголизосомы. Макрофаги не имеют гранул и больше полагаются на подкисление фаголизосом, гликозидазы и протеазы для переваривания микробов. [20] Фагосомы в дендритных клетках менее кислые и обладают гораздо более слабой гидролитической активностью из-за более низкой концентрации лизосомных протеаз и даже наличия ингибиторов протеаз.
Воспаление [ править ]
Образование фагосом связано с воспалением через общие сигнальные молекулы. Киназа PI-3 и PLC участвуют как в механизме интернализации, так и в запуске воспаления. [8] Эти два белка, наряду с Rho GTPases, являются важными компонентами врожденного иммунного ответа, индуцируя продукцию цитокинов и активируя сигнальный каскад MAP-киназ . Вырабатываются провоспалительные цитокины, включая IL-1β , IL-6 , TNFα и IL-12 . [7]
Этот процесс жестко регулируется, а воспалительная реакция зависит от типа частицы внутри фагосомы. Апоптотические клетки, инфицированные патогеном, вызывают воспаление, но поврежденные клетки, которые деградируют как часть нормального тканевого обмена, не вызывают. Ответ также различается в зависимости от опсонин-опосредованного фагоцитоза. FcR и реакции, опосредованные рецептором маннозы, производят провоспалительные реактивные формы кислорода и молекулы арахидоновой кислоты , но реакции, опосредованные CR, не приводят к этим продуктам. [7]
Презентация антигена [ править ]
Незрелые дендритные клетки (ДК) могут фагоцитозировать, но зрелые ДК не могут из-за изменений в Rho GTPases, участвующих в ремоделировании цитоскелета. [20] Фагосомы DC менее гидролитичны и кислые, чем фагосомы макрофагов и нейтрофилов, поскольку DC в основном участвуют в презентации антигена, а не в деградации патогенов. Они должны удерживать фрагменты белка подходящего размера для специфического распознавания бактериями, поэтому пептиды разлагаются лишь частично. [20] Пептиды бактерий попадают в Главный комплекс гистосовместимости (MHC). Пептидные антигены представлены лимфоцитам , где они связываются с рецепторами Т-клеток и активируют Т-клетки., преодолевая разрыв между врожденным и адаптивным иммунитетом. [8] Это характерно для млекопитающих , птиц и челюстей, поскольку насекомые не обладают адаптивным иммунитетом. [22]
Питательный [ править ]
Древние одноклеточные организмы, такие как амеба, используют фагоцитоз как способ получения питательных веществ, а не как иммунную стратегию. Они поглощают другие более мелкие микробы и переваривают их внутри фагосомы со скоростью около одной бактерии в минуту, что намного быстрее, чем профессиональные фагоциты. [23] Основным источником пищи почвенной амебы Dictyostelium discoideum являются бактерии Legionella pneumophila , вызывающие болезнь легионеров у людей. [24] Созревание фагосом у амебы очень похоже на созревание макрофагов, поэтому они используются в качестве модельного организма для изучения этого процесса. [15]
Очистка тканей [ править ]
Фагосомы разрушают стареющие клетки и апоптотические клетки для поддержания тканевого гомеостаза. У эритроцитов одна из самых высоких скоростей оборота в организме, и они фагоцитируются макрофагами в печени и селезенке . У эмбриона процесс удаления мертвых клеток недостаточно изучен, но он не выполняется макрофагами или другими клетками, происходящими из гемопоэтических стволовых клеток . [25] Только у взрослых апоптотические клетки фагоцитируются профессиональными фагоцитами. Воспаление вызывается только определенными молекулярными паттернами, связанными с патогенами или повреждениями.(PAMPs или DAMPs) удаление стареющих клеток не вызывает воспаления. [13]
Аутофагосома [ править ]
Аутофагосомы отличаются от фагосом тем, что они в основном используются для избирательной деградации поврежденных цитозольных органелл, таких как митохондрии ( митофагия ). Однако, когда клетка голодает или испытывает стресс, аутофагосомы также могут неизбирательно разрушать органеллы, чтобы обеспечить клетку аминокислотами и другими питательными веществами. [26] Аутофагия не ограничивается профессиональными фагоцитами, она впервые была обнаружена в гепатоцитах крыс клеточным биологом Кристианом де Дювом . [27] Аутофагосомы имеют двойную мембрану, внутреннюю из поглощенной органеллы, а внешняя мембрана, как предполагается, образована из эндоплазматической сети или эндоплазматического ретикулума.Промежуточный отсек ЭР-Гольджи (ERGIC). [28] Аутофагосома также сливается с лизосомами для разрушения своего содержимого. Когда M. tuberculosis подавляют закисление фагосом, гамма-интерферон может вызвать аутофагию и спасти процесс созревания. [29]
Бактериальное уклонение и манипуляции [ править ]
Многие бактерии эволюционировали, чтобы уклониться от бактерицидных свойств фагосом или даже использовать фагоцитоз в качестве стратегии инвазии.
- Mycobacterium tuberculosis нацелены на макрофаги M2 в нижних отделах дыхательного пути, которые не производят АФК. [30] M. tuberculosis также может управлять сигнальными путями, секретируя фосфатазы, такие как PtpA и SapM, которые нарушают рекрутирование белков и блокируют закисление фагосом. [7] [31]
- Legionella pneumophila может реконструировать мембрану фагосомы, чтобы имитировать везикулы в других частях секреторного пути, поэтому лизосомы не распознают фагосому и не сливаются с ней. Бактерия выделяет токсины, которые мешают перемещению хозяина, поэтому содержащая легионелла вакуоль привлекает мембранные белки, обычно обнаруживаемые в эндоплазматическом ретикулуме или ERGIC. [32] Это перенаправляет секреторные пузырьки в модифицированную фагосому и доставляет питательные вещества бактерии.
- Listeria monocytogenes секретирует порообразующий белок листериолизин O, поэтому бактерия может покинуть фагосому в цитозоль. Листериолизин активируется кислой средой фагосомы. [33] Кроме того, листерии секретируют два фермента фосфолипазы С, которые способствуют ускользанию от фагосом.
См. Также [ править ]
- Аутофагосома
- Фагоцит
Ссылки [ править ]
- ^ Hackstadt T, Williams JC (май 1981). «Биохимическая стратагема облигатного паразитирования эукариотических клеток Coxiella burnetii» . Труды Национальной академии наук Соединенных Штатов Америки . 78 (5): 3240–4. DOI : 10.1073 / pnas.78.5.3240 . PMC 319537 . PMID 6942430 .
- ^ Винклер HH (1990). «Виды риккетсий (как организмы)». Ежегодный обзор микробиологии . 44 : 131–153. DOI : 10.1146 / annurev.micro.44.1.131 .
- ^ MacMicking JD, Тейлор Г. А., Мак - Кинни JD (октябрь 2003). «Иммунный контроль туберкулеза с помощью IFN-гамма-индуцибельного LRG-47». Наука . 302 (5645): 654–9. Bibcode : 2003Sci ... 302..654M . DOI : 10.1126 / science.1088063 . PMID 14576437 .
- ^ Вандал ОН, Pierini LM, Schnappinger D, Nathan CF, EHRT S (август 2008). «Мембранный белок сохраняет внутрибактериальный pH при внутрифагосомных микобактериях туберкулеза» . Природная медицина . 14 (8): 849–54. DOI : 10.1038 / nm.1795 . PMC 2538620 . PMID 18641659 .
- ^ Kuehnel МП, Гете R, Хаберманн А, Е Мюллера, Роде М, Гриффитс О, Валентин-Уэиганд Р (август 2001 г.). «Характеристика внутриклеточной выживаемости Mycobacterium avium ssp. Paratuberculosis: фагосомный pH и фузогенность в макрофагах J774 по сравнению с другими микобактериями». Клеточная микробиология . 3 (8): 551–66. DOI : 10.1046 / j.1462-5822.2001.00139.x . PMID 11488816 .
- ^ Тессема М.З., Koets А.П., Rutten В.П., Gruys E (ноябрь 2001). «Как Mycobacterium avium subsp. Paratuberculosis противостоит внутриклеточной деградации?» . The Veterinary Quarterly . 23 (4): 153–62. DOI : 10.1080 / 01652176.2001.9695105 . PMID 11765232 .
- ^ a b c d e f g h Адерем А., Андерхилл DM (апрель 1999 г.). «Механизмы фагоцитоза в макрофагах». Ежегодный обзор иммунологии . 17 (1): 593–623. DOI : 10.1146 / annurev.immunol.17.1.593 . PMID 10358769 .
- ^ a b c Адерем А (июнь 2003 г.). «Фагоцитоз и воспалительная реакция» . Журнал инфекционных болезней . 187 Приложение 2 (s2): S340-5. DOI : 10.1086 / 374747 . PMID 12792849 .
- Перейти ↑ Dupuy AG, Caron E (июнь 2008 г.). «Интегрин-зависимый фагоцитоз: переход от микроадгезии к новым концепциям» . Журнал клеточной науки . 121 (11): 1773–83. DOI : 10,1242 / jcs.018036 . PMID 18492791 .
- Перейти ↑ Underhill DM, Ozinsky A (апрель 2002 г.). «Фагоцитоз микробов: сложность в действии». Ежегодный обзор иммунологии . 20 (1): 825–52. DOI : 10.1146 / annurev.immunol.20.103001.114744 . PMID 11861619 .
- Перейти ↑ Kaplan G (август 1977). «Различия в режиме фагоцитоза с рецепторами Fc и C3 в макрофагах». Скандинавский журнал иммунологии . 6 (8): 797–807. DOI : 10.1111 / j.1365-3083.1977.tb02153.x . PMID 561436 .
- Перейти ↑ Köhler H, Rodrigues SP, McCormick BA (март 2002). «Взаимодействия Shigella flexneri с базолатеральным мембранным доменом поляризованного модельного кишечного эпителия: роль липополисахарида в клеточной инвазии и в активации митоген-активированной протеинкиназы ERK» . Инфекция и иммунитет . 70 (3): 1150–8. DOI : 10.1128 / IAI.70.3.1150-1158.2002 . PMC 127798 . PMID 11854195 .
- ^ a b Desjardins M, Houde M, Gagnon E (октябрь 2005 г.). «Фагоцитоз: запутанный путь от питания к адаптивному иммунитету». Иммунологические обзоры . 207 (1): 158–65. DOI : 10.1111 / j.0105-2896.2005.00319.x . PMID 16181334 .
- ^ a b Desjardins M, Celis JE, van Meer G, Dieplinger H, Jahraus A, Griffiths G, Huber LA (декабрь 1994). «Молекулярная характеристика фагосом». Журнал биологической химии . 269 (51): 32194–200. PMID 7798218 .
- ^ a b Gotthardt D, Warnatz HJ, Henschel O, Brückert F, Schleicher M, Soldati T (октябрь 2002 г.). «Рассечение с высоким разрешением созревания фагосом выявляет различные фазы мембранного транспорта» . Молекулярная биология клетки . 13 (10): 3508–20. DOI : 10.1091 / mbc.E02-04-0206 . PMC 129962 . PMID 12388753 .
- ↑ Keller S, Berghoff K, Kress H (декабрь 2017 г.). «Фагосомный транспорт сильно зависит от размера фагосом» . Научные отчеты . 7 (1): 17068. Bibcode : 2017NatSR ... 717068K . DOI : 10.1038 / s41598-017-17183-7 . PMC 5719076 . PMID 29213131 .
- ↑ de Chastellier C, Thilo L (сентябрь 1997 г.). «Созревание фагосом и слияние с лизосомами в зависимости от свойств поверхности и размера фагоцитарной частицы». Европейский журнал клеточной биологии . 74 (1): 49–62. PMID 9309390 .
- ^ a b Fairn GD, Grinstein S (август 2012). «Как зарождающиеся фагосомы созревают, чтобы стать фаголизосомами». Тенденции в иммунологии . 33 (8): 397–405. DOI : 10.1016 / j.it.2012.03.003 . PMID 22560866 .
- ^ Kinchen JM, Ravichandran KS (апрель 2010). «Идентификация двух эволюционно консервативных генов, регулирующих процессинг поглощенных апоптотических клеток» . Природа . 464 (7289): 778–82. Bibcode : 2010Natur.464..778K . DOI : 10,1038 / природа08853 . PMC 2901565 . PMID 20305638 .
- ^ a b c d Савина А., Амигорена С. (октябрь 2007 г.). «Фагоцитоз и презентация антигенов в дендритных клетках». Иммунологические обзоры . 219 (1): 143–56. DOI : 10.1111 / j.1600-065X.2007.00552.x . PMID 17850487 .
- ↑ Mills CD (5 мая 2015 г.). «Анатомия открытия: макрофаги m1 и m2» . Границы иммунологии . 6 : 212. DOI : 10.3389 / fimmu.2015.00212 . PMC 4419847 . PMID 25999950 .
- ^ Warr GW (1997). «Адаптивная иммунная система рыб». Развитие биологической стандартизации . 90 : 15–21. PMID 9270830 .
- ^ Cosson P, Soldati T (июнь 2008). «Ешь, убей или умри: когда амеба встречается с бактериями». Текущее мнение в микробиологии . 11 (3): 271–6. DOI : 10.1016 / j.mib.2008.05.005 . PMID 18550419 .
- ↑ Соломон Дж. М., Руппер А., Карделли Дж. А., Исберг Р. Р. (май 2000 г.). «Внутриклеточный рост Legionella pneumophila в Dictyostelium discoideum, система для генетического анализа взаимодействий хозяин-патоген» . Инфекция и иммунитет . 68 (5): 2939–47. DOI : 10.1128 / iai.68.5.2939-2947.2000 . PMC 97507 . PMID 10768992 .
- ^ Lichanska AM, Юм Д. (июнь 2000). «Происхождение и функции фагоцитов в эмбрионе» (PDF) . Экспериментальная гематология . 28 (6): 601–11. DOI : 10.1016 / s0301-472x (00) 00157-0 . PMID 10880746 .
- ^ Дин WX, Инь XM (июль 2012). «Митофагия: механизмы, патофизиологические роли и анализ» . Биологическая химия . 393 (7): 547–64. DOI : 10,1515 / HSZ-2012-0119 . PMC 3630798 . PMID 22944659 .
- Перейти ↑ Castro-Obregon S (2010). «Открытие лизосом и аутофагии» . Природное образование . 3 (9): 49.
- ^ Се л, Schekman Р (январь 2014). «Промежуточный отсек ER-Golgi питает мембрану фагофора» . Аутофагия . 10 (1): 170–2. DOI : 10,4161 / auto.26787 . PMC 4389871 . PMID 24220263 .
- ^ Гутьеррес MG, Master SS, Singh С.Б., Тейлор Г.А., Colombo М.И., Deretic V (декабрь 2004). «Аутофагия - это защитный механизм, ингибирующий выживаемость БЦЖ и Mycobacterium tuberculosis в инфицированных макрофагах». Cell . 119 (6): 753–66. DOI : 10.1016 / j.cell.2004.11.038 . PMID 15607973 .
- ^ Cambier CJ, Takaki KK, Larson RP, Hernandez RE, Тобин DM, Urdahl KB, Cosma CL, Ramakrishnan L (январь 2014). «Микобактерии манипулируют набором макрофагов посредством скоординированного использования мембранных липидов» . Природа . 505 (7482): 218–22. DOI : 10,1038 / природа12799 . PMC 3961847 . PMID 24336213 .
- ↑ Wong D, Chao JD, Av-Gay Y (февраль 2013 г.). «Фосфатазы, секретируемые Mycobacterium tuberculosis: от патогенеза к мишеням для разработки противотуберкулезных препаратов». Тенденции в микробиологии . 21 (2): 100–9. DOI : 10.1016 / j.tim.2012.09.002 . PMID 23084287 .
- ↑ Рой CR, Каган JC (1 января 2013 г.). Уклонение от слияния лизосом фагосом и создание репликативной органеллы внутриклеточным патогеном Legionella pneumophila . Landes Bioscience.
- ^ Портной DA, Auerbuch V, Glomski IJ (август 2002). «Клеточная биология инфекции Listeria monocytogenes: пересечение бактериального патогенеза и клеточного иммунитета» . Журнал клеточной биологии . 158 (3): 409–14. DOI : 10,1083 / jcb.200205009 . PMC 2173830 . PMID 12163465 .