| аминоацилаза | ||||||||
|---|---|---|---|---|---|---|---|---|
| Идентификаторы | ||||||||
| ЕС нет. | 3.5.1.14 | |||||||
| № CAS | 9012-37-7 | |||||||
| Базы данных | ||||||||
| IntEnz | Просмотр IntEnz | |||||||
| BRENDA | BRENDA запись | |||||||
| ExPASy | Просмотр NiceZyme | |||||||
| КЕГГ | Запись в KEGG | |||||||
| MetaCyc | метаболический путь | |||||||
| ПРИАМ | профиль | |||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | |||||||
| Генная онтология | Amigo / QuickGO | |||||||
| ||||||||
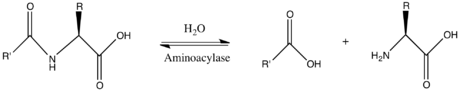
В энзимологии , аминоацилазы ( ЕС 3.5.1.14 ) представляет собой фермент , который катализирует в химическую реакцию
Таким образом, двумя субстратами этого фермента являются N-ацил-L-аминокислота и H 2 O , тогда как двумя его продуктами являются карбоксилат и L-аминокислота .
Этот фермент принадлежит к семейству гидролаз , действующих на связи углерод-азот, отличные от пептидных , особенно в линейных амидах . Систематическое название данного фермента класса N-ацил-L-аминокислоты amidohydrolase . Другие названия общего пользования включают дегидропептидазы II , histozyme , hippuricase , benzamidase , ацилазу I , hippurase , Amido кислоты deacylase , L-аминоацилазы , ацилазу ,аминоацилаза I , ацилаза L-аминокислоты , гидролаза альфа-N-ациламинокислоты , длинная ациламидоацилаза и короткая ациламидоацилаза . Этот фермент участвует в цикле мочевины и метаболизме аминогрупп .
Структура фермента [ править ]
По состоянию на конец 2007 г. были решены две структуры для этого класса ферментов с кодами доступа 1Q7L и 1YSJ . Эти структуры также соответствуют два известных последовательностям первичных аминокислот для aminoacylases . Соответствующие документы , выделить два типа доменов , содержащие aminoacylases: Цинк - связывающие домены - которые связывают Zn 2+ ионы - и домены , которые способствуют димеризациям из цинка связывающих доменов . [1] [2] Этодимеризация, которая позволяет катализу происходить, поскольку активный сайт аминоацилазы находится между двумя ее цинк- связывающими доменами . [1]
Связанный Цинк облегчает связывание из N-ацил-L-аминокислота субстрата , вызывая конформационное изменение , которое приносит белку субъединицы вместе вокруг подложки и позволяя катализ произойти. [3] аминоацилазы 1 существует в гетеротетрамерной структуре, то есть 2 Цинковых связывающих домены и 2 димеризации доменов объединяются , чтобы сделать аминоацилазы 1 «с четвертичной структурой .
Ферментный механизм [ править ]
Аминоацилаза - это металлофермент, которому для функционирования необходим цинк ( Zn 2+ ) в качестве кофактора . [3] [4] В Цинк ионов внутри аминоацилазы каждый координированный с гистидина , глутамата , аспартата и воды . [1] [3] [5] Цинк ион поляризует в воду , что облегчает его депротонирование с помощью близлежащего базового остатка . [3] [5]Отрицательно заряженный ион гидроксида является нуклеофильным и атакует электрофильный карбонил углерод из подложки ацильной группы . [5] Точный механизм после этой точки неизвестен, одна из возможностей состоит в том, что карбонил затем преобразуется, разрывает амидную связь и образует два продукта . В какой-то момент механизма другая молекула воды входит и координируется с цинком , возвращая фермент в исходное состояние. [5]
Нуклеофильная атака водой является лимитирующей стадией каталитического механизма аминоацилазы . [6] Эта нуклеофильная атака обратима, в то время как последующие шаги быстрые и необратимые. [6] Эта последовательность реакций является примером кинетики Михаэлиса-Ментен , позволяя определить K M , K cat , V max , число оборотов и специфичность субстрата с помощью классических экспериментов с ферментами Михаэлиса-Ментен . [6]Вторые и третьи шаги вперед вызвать образование и выделение реакции в продуктах . [6]
Биологическая функция [ править ]
Аминоацилазы экспрессируются в почках , где они рециркулируют N-ацил-L-аминокислоты в виде L-аминокислот и помогают в регуляции цикла мочевины.
N-ацил-L-аминокислоты образуются, когда L-аминокислоты имеют свой N-конец, ковалентно связанный с ацильной группой . Ацильная группа обеспечивает устойчивость к аминокислоте , что делает его более устойчивым к деградации. Кроме того, N-ацил-L-аминокислоты не могут использоваться непосредственно в качестве строительных блоков для белков и должны сначала быть преобразованы в L-аминокислоты с помощью аминоацилазы. Опять же, продукты L-аминокислоты можно использовать для биосинтеза или катаболизированной энергии .
Аминоацилазы участвуют в регуляции этого цикла мочевины . N-ацетил-L-глутамат представляет собой аллостерическая активатор из карбамоил фосфата синтетазы , решающий фермент , который совершает NH 4 + молекулы в цикле мочевины . [7] Цикл мочевины избавляет от избытка аммиака ( NH 4 + ) в организме, процесс, который необходимо регулировать в периоды повышенного катаболизма белков , так как при расщеплении аминокислот образуется большое количество NH 4.+ . [7] Когда катаболизм аминокислот увеличивается, N-ацетилглутаматсинтаза активируется , производя больше N-ацетил-L-глутамата, который регулирует карбамоилфосфатсинтетазу и позволяет избавляться от избытка NH 4 + от катаболизма . [7]
Аминоацилаза активируется во время дефицита питательных веществ или голодания , вызывая распад N-ацетил-L-глутамата , который подавляет карбамоилфосфатсинтетазу и остальную часть цикла мочевины . Этот ответ является эволюционно выгодным, поскольку дефицит питательных веществ означает, что не так много NH 4 + , от которого нужно избавляться, и поскольку организм хочет сохранить как можно больше аминокислот. [7]
Актуальность болезни [ править ]
Аминоацилазы 1 дефицита ( A1D ) является редким заболеванием , вызванным аутосомно - рецессивными мутациями в аминоацилазах 1 ген ( ACY1 ) на хромосоме 3p21 . [8] [9] [10] [11] [12] Недостаток функциональной аминоацилазы 1, вызванный A1D, приводит к дисфункциональному циклу мочевины , вызывая ряд неврологических расстройств, включая судороги , мышечную гипотонию , умственную отсталость инарушение психомоторного развития . [8] [13] [14] [15] A1D также был связан с аутизмом . [16] Пациенты с A1D часто начинают проявлять симптомы вскоре после рождения, но, похоже, полностью выздоравливают в следующие несколько лет. [13] [14] [15]
Аминоацилазы 2 дефицита - также известный как болезнь Канавана в - другое редкое заболевание , вызванное мутацией в гене ООРА (на хромосоме 17 ) , что приводит к дефициту в фермента аминоацилазы 2 . Аминоацилаза 2 известна тем, что она может гидролизовать N-ацетиласпартат, а аминоацилаза 1 - нет. [17]
Промышленное значение [ править ]
Аминоацилазы использовались для производства L- аминокислот в промышленных условиях с конца 1950-х годов. [18] Поскольку аминоацилазы являются субстрат- специфическими для N-ацил-L-аминокислот, а не для N-ацил-D-аминокислот , аминоацилазы можно использовать для надежного получения смеси этих двух реагентов и преобразования только L- энантиомеров в продукты - которые затем можно выделить по растворимости из непрореагировавших N-ацил-D-аминокислот . [18] [19] Хотя этот процесс выполнялся вреактор периодического действия в течение многих лет, более быстрый и менее расточительным процесс был разработан в конце 1970 - х годов , которые размещены aminoacylases в колонке , что N - ацил - аминокислоты были затем непрерывно промывают до конца. [18] [20] Этот процесс все еще используется в промышленных установках сегодня , чтобы преобразовать N-ацил-аминокислоты , чтобы аминокислоты в энантиомерно определенным образом.
Эволюция [ править ]
Многие научные исследования в течение половины прошлого века использовал свиные аминоацилазы как их модель аминоацилазы фермента . [21] Определены аминокислотная последовательность и первичная структура аминоацилазы свиньи. [4] Аминоацилаза 1 свиней состоит из двух идентичных гетеродимерных субъединиц, каждая из которых состоит из 406 аминокислот, с ацетилаланином на N-конце каждой. [4] Свиная аминоацилаза отличается от человеческой аминоацилазы в структуре , но повторяет свою функцию. [1][4] [22] Из этих данных можно сделать вывод, что эти два фермента произошли от общего предкового белка , сохранив функцию, но различающуюся по структуре с течением времени. [1] [4]
Ссылки [ править ]
- ^ a b c d e Линднер Х.А., Лунин В.В., Алари А., Хеккер Р., Циглер М., Менар Р. (ноябрь 2003 г.). «Существенные роли лигирования цинка и димеризации ферментов для катализа в семействе аминоацилазы-1 / M20» . Журнал биологической химии . 278 (45): 44496–504. DOI : 10.1074 / jbc.M304233200 . PMID 12933810 .
- ^ Fones WS Ли M (апрель 1953). «Гидролиз N-ацильных производных аланина и фенилаланина ацилазой I и карбоксипептидазой» . Журнал биологической химии . 201 (2): 847–56. PMID 13061423 .
- ^ a b c d Lindner HA, Alary A, Wilke M, Sulea T (апрель 2008 г.). «Исследование ацил-связывающего кармана аминоацилазы-1». Биохимия . 47 (14): 4266–75. DOI : 10.1021 / bi702156h . PMID 18341290 .
- ^ a b c d e Mitta M, Ohnogi H, Yamamoto A, Kato I, Sakiyama F, Tsunasawa S (декабрь 1992 г.). «Первичная структура аминоацилазы 1 свиньи, выведенная из последовательности кДНК» . Журнал биохимии . 112 (6): 737–42. DOI : 10.1093 / oxfordjournals.jbchem.a123968 . PMID 1284246 .
- ^ a b c d Hernick M, Fierke CA (январь 2005 г.). «Гидролазы цинка: механизмы цинк-зависимых деацетилаз». Архивы биохимии и биофизики . 433 (1): 71–84. DOI : 10.1016 / j.abb.2004.08.006 . PMID 15581567 .
- ^ a b c d Отвёс Л., Моравчик Э., Мади Г. (сентябрь 1971 г.). «Исследование механизма катализируемого ацилазой-I гидролиза ациламинокислоты». Сообщения о биохимических и биофизических исследованиях . 44 (5): 1056–64. DOI : 10.1016 / S0006-291X (71) 80192-4 . PMID 5160398 .
- ^ a b c d Берг, Джереми М .; Тимочко, Джон Л .; Страйер, Люберт (2012). Биохимия . Нью-Йорк: WH Freeman and Company. п. 688. ISBN 978-1-4292-2936-4.
- ^ a b Sommer A, Christensen E, Schwenger S и др. (Июнь 2011 г.). «Молекулярные основы дефицита аминоацилазы 1» (PDF) . Biochimica et Biophysica Acta (BBA) - Молекулярная основа болезни . 1812 (6): 685–90. DOI : 10.1016 / j.bbadis.2011.03.005 . PMID 21414403 .
- ^ Ферри Л., Фунгхини С., Фиораванти А. и др. (Октябрь 2013). «Дефицит аминоацилазы I из-за пропуска экзона мРНК ACY1». Клиническая генетика . 86 (4): 367–372. DOI : 10.1111 / cge.12297 . PMID 24117009 . S2CID 24017306 .
- ^ Миллер YE, Minna JD, Gazdar AF (июнь 1989). «Отсутствие экспрессии аминоацилазы-1 при мелкоклеточном раке легкого. Доказательства инактивации генов, кодируемых хромосомой 3р» . Журнал клинических исследований . 83 (6): 2120–4. DOI : 10.1172 / JCI114125 . PMC 303939 . PMID 2542383 .
- ^ EntrezGene 95
- ^ Миллер Ю.Е., Драбкин Н, Джонс С, Фишер JH (сентябрь 1990). «Аминоацилаза-1 человека: клонирование, региональное отнесение к дистальной хромосоме 3p21.1 и идентификация перекрестно гибридизирующейся последовательности на хромосоме 18». Геномика . 8 (1): 149–54. DOI : 10.1016 / 0888-7543 (90) 90237-O . PMID 1707030 .
- ^ a b Sass JO, Mohr V, Olbrich H, et al. (Март 2006 г.). «Мутации в ACY1, гене, кодирующем аминоацилазу 1, вызывают новую врожденную ошибку метаболизма» . Американский журнал генетики человека . 78 (3): 401–9. DOI : 10.1086 / 500563 . PMC 1380284 . PMID 16465618 .
- ^ a b Sass JO, Olbrich H, Mohr V и др. (Июнь 2007 г.). «Неврологические находки при дефиците аминоацилазы 1». Неврология . 68 (24): 2151–3. DOI : 10.1212 / 01.wnl.0000264933.56204.e8 . PMID 17562838 . S2CID 43376960 .
- ^ а б Ван Костер Р.Н., Герло Э.А., Джардина Т.Г. и др. (Декабрь 2005 г.). «Дефицит аминоацилазы I: новая врожденная ошибка метаболизма». Сообщения о биохимических и биофизических исследованиях . 338 (3): 1322–6. DOI : 10.1016 / j.bbrc.2005.10.126 . PMID 16274666 .
- ^ Tylki-Szymanska A, Gradowska W, Sommer A, et al. (Декабрь 2010 г.). «Дефицит аминоацилазы 1, связанный с аутичным поведением». Журнал наследственных метаболических заболеваний . 33 Дополнение 3: S211–4. DOI : 10.1007 / s10545-010-9089-3 . PMID 20480396 . S2CID 13374954 .
- ↑ Xie Q, Guo T, Wang T, Lu J, Zhou HM (ноябрь 2003 г.). «Индуцированная аспартатом укладка аминоацилазы и формирование расплавленной глобулы». Международный журнал биохимии и клеточной биологии . 35 (11): 1558–72. DOI : 10.1016 / S1357-2725 (03) 00131-6 . PMID 12824065 .
- ^ a b c Сато, Тадаши; Тоса, Тэцуя (2010). «Производство L-аминокислот аминоацилазой». Энциклопедия промышленной биотехнологии . С. 1–20. DOI : 10.1002 / 9780470054581.eib497 . ISBN 978-0-470-05458-1.
- ^ Бирнбаум С.М., Levintow л, Кингсли РБ, Гринштайн JP (январь 1952). «Специфичность аминокислотных ацилаз» . Журнал биологической химии . 194 (1): 455–70. PMID 14927637 .
- ^ Huang MQ, Чжоу HM (1994). «Щелочное разворачивание и солевое сворачивание аминоацилазы при высоком pH». Фермент и белок . 48 (4): 229–37. DOI : 10.1159 / 000474993 . PMID 8821711 .
- ^ Кореиси М., Асаяма Ф, Иманака Х и др. (Октябрь 2005 г.). «Очистка и характеристика новой аминоацилазы из Streptomyces mobaraensis» . Биология, биотехнология и биохимия . 69 (10): 1914–22. DOI : 10.1271 / bbb.69.1914 . PMID 16244442 .
- ^ Митта M, Kato I, Tsunasawa S (август 1993). «Нуклеотидная последовательность аминоацилазы-1 человека». Biochimica et Biophysica Acta (BBA) - Структура и экспрессия гена . 1174 (2): 201–3. DOI : 10.1016 / 0167-4781 (93) 90116-U . PMID 8357837 .