В химии , элемент представляет собой чистое вещество , состоящее только из атомов , которые все имеют одинаковое число протонов в их атомных ядрах . В отличие от химических соединений , химические элементы не могут быть расщеплены химическими средствами на более простые вещества. Число протонов в ядре является определяющим свойством элемента и называется его атомным номером (представлен символом Z ) - все атомы с одинаковым атомным номером являются атомами одного и того же элемента. [1] Вся барионная материяВселенная состоит из химических элементов. Когда различные элементы подвергаются химическим реакциям , атомы перестраиваются в новые соединения, удерживаемые вместе химическими связями . Лишь небольшая часть элементов, таких как серебро и золото , обнаруживается в несоединенном виде как относительно чистые минералы самородных элементов . Почти все другие природные элементы встречаются на Земле в виде соединений или смесей . Воздух в основном представляет собой смесь элементов азота , кислорода и аргона , хотя он и содержит соединения, в том числе углекислый газ ивода .
История открытия и использования элементов началась с примитивных человеческих обществ, которые открыли природные минералы, такие как углерод , сера , медь и золото (хотя концепция химического элемента еще не была понята). Попытки классифицировать такие материалы привели к появлению концепций классических элементов , алхимии и различных подобных теорий на протяжении всей истории человечества. Современное понимание элементов во многом основано на работах Дмитрия Менделеева , русского химика, опубликовавшего первую узнаваемую таблицу Менделеева в 1869 году. Эта таблица упорядочивает элементы путем увеличения атомного номера в строки ("периодов "), в которых столбцы (" группы ") имеют повторяющиеся (" периодические ") физические и химические свойства . Периодическая таблица суммирует различные свойства элементов, что позволяет химикам выявлять взаимосвязи между ними и делать прогнозы относительно соединений и потенциальных новых единицы.
К ноябрю 2016 года Международный союз теоретической и прикладной химии признал в общей сложности 118 элементов. Первые 94 встречаются на Земле в естественных условиях , а остальные 24 являются синтетическими элементами, образующимися в ядерных реакциях . За исключением нестабильных радиоактивных элементов ( радионуклидов ), которые быстро распадаются , почти все элементы доступны в промышленных масштабах в различных количествах. Открытие и синтез дополнительных новых элементов является постоянной областью научного исследования.
Описание
Самыми легкими химическими элементами являются водород и гелий , оба они созданы нуклеосинтезом Большого взрыва в течение первых 20 минут существования Вселенной [2] в соотношении примерно 3: 1 по массе (или 12: 1 по количеству атомов), [3] [4] вместе с крошечными следами следующих двух элементов, лития и бериллия . Почти все другие элементы, встречающиеся в природе, были получены различными естественными методами нуклеосинтеза . [5] На Земле небольшие количества новых атомов естественным образом образуются в результате нуклеогенных реакций или космогенных процессов, таких какрасщепление космических лучей . Новые атомы также естественным образом образуются на Земле в виде дочерних радиогенных изотопов текущих процессов радиоактивного распада, таких как альфа-распад , бета-распад , спонтанное деление , кластерный распад и другие более редкие формы распада.
Из 94 природных элементов, каждый с атомным номером от 1 до 82 имеет по крайней мере один стабильный изотоп (за исключением технеция , элемент 43, и прометия , элемент 61, у которых нет стабильных изотопов). Стабильными считаются изотопы, радиоактивный распад которых еще не наблюдался. Элементы с атомными номерами от 83 до 94 нестабильны до такой степени, что может быть обнаружен радиоактивный распад всех изотопов. Некоторые из этих элементов, особенно висмут (атомный номер 83), торий (атомный номер 90) и уран (атомный номер 92), имеют один или несколько изотопов с периодом полураспада, достаточно долгим, чтобы выжить в виде остатков взрывчатого вещества.звездный нуклеосинтез, который произвел тяжелые металлы до образования нашей Солнечной системы . Висмут-209 (атомный номер 83), более 1,9 × 10 19 лет, что более чем в миллиард раз больше, чем текущий предполагаемый возраст Вселенной, имеет самый длительный из известных элементов полураспада при альфа-распаде, и его почти всегда считают. наравне с 80 стабильными элементами. [6] [7] Самые тяжелые элементы (помимо плутония, элемент 94) подвергаются радиоактивному распаду с таким коротким периодом полураспада, что они не встречаются в природе и должны быть синтезированы .
Сейчас известно 118 элементов. В этом контексте «известный» означает достаточно хорошо наблюдаемый даже по нескольким продуктам распада, чтобы их можно было отличить от других элементов. [8] [9] Совсем недавно о синтезе элемента 118 (так называемого оганессон ) сообщалось в октябре 2006 года, а о синтезе элемента 117 ( теннессин ) сообщалось в апреле 2010 года. [10] [11] Из этих 118 элементов. , 94 встречаются в природе на Земле. Шесть из них присутствуют в очень незначительных количествах: технеций , атомный номер 43; прометий , число 61; астат , число 85; франций , число 87; нептуний , число 93; а такжеплутоний , номер 94. Эти 94 элемента были обнаружены во Вселенной в целом, в спектрах звезд, а также в сверхновых, где образуются короткоживущие радиоактивные элементы. Первые 94 элемента были обнаружены непосредственно на Земле как первичные нуклиды, появившиеся в результате образования Солнечной системы, или как естественные продукты деления или трансмутации урана и тория.
Остальные 24 более тяжелых элемента, которых сегодня нет ни на Земле, ни в астрономических спектрах, были произведены искусственно: все они радиоактивны с очень коротким периодом полураспада; Если какие-либо атомы этих элементов присутствовали при формировании Земли, они весьма вероятно, с точностью до уверенности, уже распались, а если они присутствуют в новых звездах, их количество слишком мало, чтобы их можно было заметить. Технеций был первым якобы не встречающимся в природе элементом, синтезированным в 1937 году, хотя с тех пор в природе были обнаружены следовые количества технеция (а также этот элемент, возможно, был обнаружен естественным образом в 1925 году). [12] Этот образец искусственного производства, а затем и естественных открытий был повторен с несколькими другими радиоактивными редкими элементами природного происхождения. [13]
Список элементов доступен по названию, атомному номеру, плотности, точке плавления, температуре кипения и по символу , а также по энергиям ионизации элементов . Нуклиды стабильных и радиоактивных элементов также доступны в виде списка нуклидов , отсортированных по продолжительности полураспада для тех, которые являются нестабильными. Одно из наиболее удобных и, безусловно, наиболее традиционных представлений элементов - это периодическая таблица , которая объединяет элементы со схожими химическими свойствами (и, как правило, также с подобными электронными структурами).
Атомный номер
Атомный номер элемента равен числу протонов в каждом атоме, и определяет элемент. [14] Например, все атомы углерода содержат 6 протонов в своем атомном ядре ; поэтому атомный номер углерода равен 6. [15] Атомы углерода могут иметь разное количество нейтронов; атомы одного и того же элемента, имеющие разное количество нейтронов, известны как изотопы элемента. [16]
Число протонов в атомном ядре также определяет его электрический заряд , который, в свою очередь, определяет количество электронов атома в его неионизированном состоянии. Электроны помещаются на атомные орбитали, которые определяют различные химические свойства атома . Количество нейтронов в ядре обычно очень мало влияет на химические свойства элемента (кроме водорода и дейтерия ). Таким образом, все изотопы углерода имеют почти идентичные химические свойства, потому что все они имеют шесть протонов и шесть электронов, хотя атомы углерода могут, например, иметь 6 или 8 нейтронов. Вот почему атомный номер, а немассовое число или атомный вес считается идентифицирующей характеристикой химического элемента.
Символ является атомным номером Z .
Изотопы
Изотопы - это атомы одного и того же элемента (то есть с одинаковым числом протонов в их атомном ядре ), но с разным числом нейтронов . Так, например, существует три основных изотопа углерода. У всех атомов углерода в ядре 6 протонов, но они могут иметь 6, 7 или 8 нейтронов. Так как массовые числа них 12, 13 и 14 , соответственно, три изотопы углерода, известны как углерод-12 , углерод-13 , и углерод-14 , часто сокращенно 12 С, 13 С и 14 ° С углерода в повседневная жизнь и в химии этоСмесь из 12 С (около 98,9%), 13 С (около 1,1%) и около 1 атома на триллион 14 ° С
Большинство (66 из 94) природных элементов имеют более одного стабильного изотопа. За исключением изотопов водорода (которые сильно отличаются друг от друга по относительной массе - достаточной, чтобы вызывать химические эффекты), изотопы данного элемента химически почти неразличимы.
Все элементы имеют некоторые изотопы, которые являются радиоактивными ( радиоизотопы ), хотя не все эти радиоизотопы встречаются в природе. Радиоизотопы обычно распадаются на другие элементы при излучении альфа- или бета-частицы . Если в элементе есть изотопы, которые не являются радиоактивными, их называют «стабильными» изотопами. Все известные стабильные изотопы встречаются в природе (см. Первичный изотоп ). Многие радиоизотопы, которые не встречаются в природе, были охарактеризованы после того, как были искусственно созданы. Некоторые элементы не имеют стабильных изотопов и состоят только из радиоактивных изотопов: в частности, элементами без каких-либо стабильных изотопов являются технеций (атомный номер 43), прометий (атомный номер 61) и все наблюдаемые элементы с атомными номерами больше 82.
Из 80 элементов, содержащих хотя бы один стабильный изотоп, 26 имеют только один стабильный изотоп. Среднее количество стабильных изотопов для 80 стабильных элементов составляет 3,1 стабильных изотопов на элемент. Наибольшее количество стабильных изотопов, которые встречаются для одного элемента, составляет 10 (для олова, элемент 50).
Изотопная масса и атомная масса
Массовое число элемента, A , это количество нуклонов (протонов и нейтронов) в атомном ядре. Различные изотопы данного элемента различаются их массовыми числами, которые обычно записываются в виде верхнего индекса в левой части атомного символа (например, 238 U). Массовое число всегда является целым числом и выражается в «нуклонах». Например, магний-24 (24 - массовое число) - это атом с 24 нуклонами (12 протонов и 12 нейтронов).
В то время как массовое число просто подсчитывает общее количество нейтронов и протонов и, таким образом, является натуральным (или целым) числом, атомная масса отдельного атома - это действительное число, дающее массу определенного изотопа (или «нуклида») элемент, выраженный в атомных единицах массы (символ: u). В общем, массовое число данного нуклида немного отличается по значению от его атомной массы, поскольку масса каждого протона и нейтрона не равна точно 1 u; поскольку электроны вносят меньшую долю в атомную массу, поскольку число нейтронов превышает число протонов; и (наконец) из-за энергии связи ядра. Например, атомная масса хлора-35 с точностью до пяти значащих цифр равна 34,969 ед., А хлора-37 - 36,966 ед. Однако атомная масса в единицах u каждого изотопа довольно близка к его простому массовому числу (всегда в пределах 1%). Единственный изотоп, атомная масса которого является в точности натуральным числом, - это 12 C, который по определению имеет массу ровно 12, потому что u определяется как 1/12 массы свободного нейтрального атома углерода-12 в основном состоянии.
Стандартный атомный вес (обычно называемый «атомный весом») элемент является средним атомных масс всех изотопов химического элемента, как обнаружено в определенной среде, взвешенный по изотопному содержанию, по отношению к атомной единицы массы. Это число может быть дробью, не близкой к целому. Например, относительная атомная масса хлора составляет 35,453 ед., Что сильно отличается от целого числа, так как в среднем это около 76% хлора-35 и 24% хлора-37. Всякий раз, когда значение относительной атомной массы отличается более чем на 1% от целого числа, это происходит из-за эффекта усреднения, поскольку в образце этого элемента естественным образом присутствуют значительные количества более чем одного изотопа.
Химически чистый и изотопно чистый
У химиков и ученых-ядерщиков разные определения чистого элемента . В химии чистый элемент означает вещество, все атомы которого (или практически все) имеют одинаковый атомный номер или количество протонов . Однако ученые-ядерщики определяют чистый элемент как элемент, состоящий только из одного стабильного изотопа . [17]
Например, медная проволока химически чиста на 99,99%, если 99,99% ее атомов - это медь с 29 протонами в каждом. Однако она не является изотопно чистой, поскольку обычная медь состоит из двух стабильных изотопов, 69% 63 Cu и 31% 65 Cu, с различным числом нейтронов. Однако слиток чистого золота будет как химически, так и изотопно чистым, поскольку обычное золото состоит только из одного изотопа - 197 Au.
Аллотропы
Атомы химически чистых элементов могут связываться друг с другом химически более чем одним способом, позволяя чистому элементу существовать в нескольких химических структурах ( пространственном расположении атомов ), известных как аллотропы , которые различаются по своим свойствам. Например, углерод можно найти в виде алмаза , который имеет тетраэдрическую структуру вокруг каждого атома углерода; графит , который имеет слои атомов углерода с гексагональной структурой, уложенные друг на друга; графен , который представляет собой однослойный очень прочный графит; фуллерены , имеющие форму, близкую к сферической; и углеродные нанотрубки, которые представляют собой трубки с гексагональной структурой (даже они могут отличаться друг от друга по электрическим свойствам). Способность элемента существовать в одной из многих структурных форм известна как «аллотропия».
Стандартное состояние , также известный в качестве эталонного состояния, элемента определяется как ее термодинамически наиболее стабильное состояние при давлении 1 бар и при данной температуре (обычно при температуре 298,15 К). В термохимии элемент определяется как имеющий нулевую энтальпию образования в стандартном состоянии. Например, эталонным состоянием для углерода является графит, потому что структура графита более стабильна, чем у других аллотропов.
Характеристики
К элементам можно широко применить несколько видов описательной категоризации, включая рассмотрение их общих физических и химических свойств, их состояния вещества в знакомых условиях, их точек плавления и кипения, их плотности, их кристаллических структур как твердых тел и их происхождения.
Общие свойства
Несколько терминов обычно используются для характеристики общих физических и химических свойств химических элементов. Первое различие заключается между металлами , которые легко проводят электричество , неметаллами , которые этого не делают, и небольшой группой ( металлоидами ), имеющими промежуточные свойства и часто ведущими себя как полупроводники .
Более точная классификация часто представлена в цветных представлениях таблицы Менделеева. Эта система ограничивает термины «металл» и «неметалл» только некоторыми из более широко определенных металлов и неметаллов, добавляя дополнительные термины для определенных наборов более широко рассматриваемых металлов и неметаллов. Версия этой классификации, используемая в представленных здесь периодических таблицах, включает: актиниды , щелочные металлы , щелочноземельные металлы , галогены , лантаноиды , переходные металлы , постпереходные металлы , металлоиды , химически активные неметаллы и благородные газы.. В этой системе щелочные металлы, щелочноземельные металлы и переходные металлы, а также лантаноиды и актиниды представляют собой особые группы металлов, рассматриваемые в более широком смысле. Точно так же химически активные неметаллы и благородные газы считаются неметаллами в более широком смысле. В некоторых презентациях галогены не различаются, астатин идентифицирован как металлоид, а другие идентифицированы как неметаллы.
состояния вещества
Другое часто используемое основное различие между элементами - это их состояние вещества (фазы), будь то твердое , жидкое или газовое , при выбранной стандартной температуре и давлении (STP). Большинство элементов представляют собой твердые тела при обычных температурах и атмосферном давлении, а некоторые - газы. Только бром и ртуть являются жидкостями при 0 градусах Цельсия (32 градуса по Фаренгейту) и нормальному атмосферному давлению; цезий и галлий являются твердыми веществами при этой температуре, но плавятся при 28,4 ° C (83,2 ° F) и 29,8 ° C (85,6 ° F) соответственно.
Точки плавления и кипения
Точки плавления и кипения , обычно выражаемые в градусах Цельсия при давлении в одну атмосферу, обычно используются для характеристики различных элементов. Хотя для большинства элементов известно, один или оба этих измерения все еще не определены для некоторых радиоактивных элементов, доступных только в крошечных количествах. Поскольку гелий остается жидкостью даже при абсолютном нуле при атмосферном давлении, в обычных представлениях он имеет только точку кипения, а не точку плавления.
Плотности
Плотность при выбранной стандартной температуре и давлении ( STP ) часто используется при характеристике элементов. Плотность часто выражается в граммах на кубический сантиметр (г / см 3 ). Поскольку некоторые элементы являются газами при обычно встречающихся температурах, их плотности обычно указываются для их газообразных форм; в сжиженном или затвердевшем состоянии газообразные элементы имеют плотность, аналогичную плотности других элементов.
Когда элемент имеет аллотропы с разной плотностью, в сводных презентациях обычно выбирается один репрезентативный аллотроп, в то время как плотности для каждого аллотропа могут быть указаны там, где представлены более подробные сведения. Например, три известных аллотропа углерода ( аморфный углерод , графит и алмаз ) имеют плотности 1,8–2,1, 2,267 и 3,515 г / см 3 соответственно.
Кристаллические структуры
Элементы, изученные на сегодняшний день как твердые образцы, имеют восемь видов кристаллических структур : кубическую , объемно-центрированную кубическую , гранецентрированную кубическую , гексагональную , моноклинную , ромбическую , ромбоэдрическую и тетрагональную . Для некоторых синтетически произведенных трансурановых элементов доступные образцы были слишком малы для определения кристаллических структур.
Возникновение и происхождение на Земле
Химические элементы также могут быть классифицированы по их происхождению на Земле: первые 94 считаются естественными, тогда как элементы с атомными номерами выше 94 были произведены только искусственно как синтетические продукты искусственных ядерных реакций.
Из 94 встречающихся в природе элементов 83 считаются первичными и либо стабильными, либо слабо радиоактивными. Остальные 11 природных элементов обладают слишком коротким периодом полураспада, чтобы они присутствовали в начале Солнечной системы , и поэтому считаются переходными элементами. Из этих 11 переходных элементов, 5 ( полоний , радон , радий , актиний и протактиния ) относительно обычные продукты распада из тория и урана . Остальные 6 переходных элементов ( технеций ,прометий , астат , франций , нептуний и плутоний ) встречаются редко, как продукты редких режимов распада или процессов ядерных реакций с участием урана или других тяжелых элементов.
Для элементов с атомными номерами от 1 до 82, за исключением 43 ( технеций ) и 61 ( прометий ), радиоактивный распад не наблюдался . Однако стабильные изотопы некоторых элементов (таких как вольфрам и свинец ), по прогнозам, будут слегка радиоактивными с очень большим периодом полураспада: [18] например, период полураспада, прогнозируемый для стабильных изотопов свинца, колеблется от 10 35 к 10 189годы. Элементы с атомными номерами 43, 61 и 83–94 достаточно нестабильны, чтобы их радиоактивный распад можно было легко обнаружить. Три из этих элементов, висмут (элемент 83), торий (элемент 90) и уран (элемент 92), имеют один или несколько изотопов с периодом полураспада, достаточно долгим, чтобы выжить в виде остатков взрывного звездного нуклеосинтеза, который произвел тяжелые элементы до формирование Солнечной системы . Например, более 1,9 × 10 19 лет, что более чем в миллиард раз больше, чем нынешний оценочный возраст Вселенной, висмут-209 имеет самый длинный известный период полураспада при альфа-распаде среди всех природных элементов. [6] [7] Самые тяжелые 24 элемента (помимо плутония, элемент 94) подвергаются радиоактивному распаду с коротким периодом полураспада и не могут образовываться в качестве дочерних элементов более долгоживущих элементов и, следовательно, вообще не известны в природе.
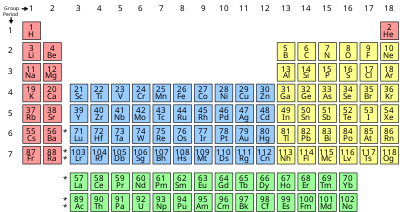
Периодическая таблица
| Группа | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Водород и щелочные металлы | Щелочноземельные металлы | Пниктогены | Халькогены | Галогены | Благородные газы | ||||||||||||||
| Период 1 | Водород1ЧАСВзаимодействие с другими людьми1,008 | Гелий2ОнВзаимодействие с другими людьми4,0026 | |||||||||||||||||
| 2 | Литий3ЛиВзаимодействие с другими людьми6,94 | Бериллий4БытьВзаимодействие с другими людьми9,0122 | Бор5BВзаимодействие с другими людьми10,81 | Углерод6CВзаимодействие с другими людьми12,011 | Азот7NВзаимодействие с другими людьми14.007 | Кислород8ОВзаимодействие с другими людьми15,999 | Фтор9FВзаимодействие с другими людьми18,998 | Неон10NeВзаимодействие с другими людьми20,180 | |||||||||||
| 3 | Натрий11NaВзаимодействие с другими людьми22,990 | Магний12MgВзаимодействие с другими людьми24.305 | Алюминий13AlВзаимодействие с другими людьми26,982 | Кремний14SiВзаимодействие с другими людьми28,085 | Фосфор15пВзаимодействие с другими людьми30 974 | Сера16SВзаимодействие с другими людьми32.06 | Хлор17ClВзаимодействие с другими людьми35,45 | Аргон18ArВзаимодействие с другими людьми39,95 | |||||||||||
| 4 | Калий19KВзаимодействие с другими людьми39,098 | Кальций20CaВзаимодействие с другими людьми40,078 | Скандий21 годScВзаимодействие с другими людьми44,956 | Титана22TiВзаимодействие с другими людьми47,867 | Ванадий23VВзаимодействие с другими людьми50,942 | Хром24CrВзаимодействие с другими людьми51,996 | Марганец25MnВзаимодействие с другими людьми54,938 | Утюг26 годFeВзаимодействие с другими людьми55,845 | Кобальт27CoВзаимодействие с другими людьми58,933 | Никель28 годNiВзаимодействие с другими людьми58,693 | Медь29CuВзаимодействие с другими людьми63,546 | Цинк30ZnВзаимодействие с другими людьми65,38 | Галлий31 годGaВзаимодействие с другими людьми69,723 | Германий32GeВзаимодействие с другими людьми72,630 | Мышьяк33В видеВзаимодействие с другими людьми74,922 | Селен34SeВзаимодействие с другими людьми78,971 | Бром35 годBrВзаимодействие с другими людьми79,904 | Криптон36KrВзаимодействие с другими людьми83,798 | |
| 5 | Рубидий37Руб.Взаимодействие с другими людьми85,468 | Стронций38SrВзаимодействие с другими людьми87,62 | Иттрий39YВзаимодействие с другими людьми88,906 | Цирконий40ZrВзаимодействие с другими людьми91,224 | Ниобий41 годNbВзаимодействие с другими людьми92,906 | Молибден42ПнВзаимодействие с другими людьми95,95 | Технеций43 годTc[97] | Рутений44 годRUВзаимодействие с другими людьми101,07 | Родий45RhВзаимодействие с другими людьми102,91 | Палладий46PdВзаимодействие с другими людьми106,42 | Серебро47AgВзаимодействие с другими людьми107,87 | Кадмий48CDВзаимодействие с другими людьми112,41 | Индий49ВВзаимодействие с другими людьми114,82 | Банка50SnВзаимодействие с другими людьми118,71 | Сурьма51SbВзаимодействие с другими людьми121,76 | Теллур52TeВзаимодействие с другими людьми127,60 | Йод53яВзаимодействие с другими людьми126,90 | Ксенон54XeВзаимодействие с другими людьми131,29 | |
| 6 | Цезий55CSВзаимодействие с другими людьми132,91 | Барий56БаВзаимодействие с другими людьми137,33 | Лютеций71ЛуВзаимодействие с другими людьми174,97 | Гафний72HfВзаимодействие с другими людьми178,49 | Тантал73ТаВзаимодействие с другими людьми180,95 | Вольфрам74WВзаимодействие с другими людьми183,84 | Рений75ReВзаимодействие с другими людьми186,21 | Осмий76Операционные системыВзаимодействие с другими людьми190,23 | Иридий77IrВзаимодействие с другими людьми192,22 | Платина78PtВзаимодействие с другими людьми195,08 | Золото79AuВзаимодействие с другими людьми196,97 | Меркурий80HgВзаимодействие с другими людьми200,59 | Таллий81 годTlВзаимодействие с другими людьми204,38 | Вести82PbВзаимодействие с другими людьми207,2 | Висмут83БиВзаимодействие с другими людьми208,98 | Полоний84По[209] | Астатин85В[210] | Радон86Rn[222] | |
| 7 | Франций87Пт[223] | Радий88Ра[226] | Лоуренсий103Lr[266] | Резерфордий104Rf[267] | Дубний105Db[268] | Сиборгий106Sg[269] | Бориум107Bh[270] | Калий108Hs[269] | Мейтнерий109Mt[278] | Дармштадтиум110Ds[281] | Рентгений111Rg[282] | Копернициум112Cn[285] | Нихоний113Nh[286] | Флеровий114Fl[289] | Московиум115Mc[290] | Ливерморий116Ур.[293] | Tennessine117Ц[294] | Оганессон118Og[294] | |
| Лантан57ЛаВзаимодействие с другими людьми138,91 | Церий58CeВзаимодействие с другими людьми140,12 | Празеодим59PrВзаимодействие с другими людьми140,91 | Неодим60NdВзаимодействие с другими людьми144,24 | Прометий61Вечера[145] | Самарий62СмВзаимодействие с другими людьми150,36 | Европий63ЕвросоюзВзаимодействие с другими людьми151,96 | Гадолиний64Б-гВзаимодействие с другими людьми157,25 | Тербий65TbВзаимодействие с другими людьми158,93 | Диспрозий66DyВзаимодействие с другими людьми162,50 | Гольмий67ХоВзаимодействие с другими людьми164,93 | Эрбий68ЭВзаимодействие с другими людьми167,26 | Тулий69ТмВзаимодействие с другими людьми168,93 | Иттербий70YbВзаимодействие с другими людьми173,05 | ||||||
| Актиний89Ac[227] | Торий90ЧтВзаимодействие с другими людьми232,04 | Протактиний91ПаВзаимодействие с другими людьми231,04 | Уран92UВзаимодействие с другими людьми238,03 | Нептуний93Np[237] | Плутоний94Пу[244] | Америций95Являюсь[243] | Кюрий96См[247] | Берклиум97Bk[247] | Калифорний98Cf[251] | Эйнштейний99Es[252] | Фермий100FM[257] | Менделевий101Мкр[258] | Нобелий102Нет[259] | ||||||
- Ca: 40.078 - Формальное краткое значение, округленное (без неопределенности) [20]
- Po: [209] - массовое число наиболее стабильного изотопа
| s-блок | f-блок | d-блок | p-блок |
Свойства химических элементов часто суммируются с использованием периодической таблицы , которая мощно и элегантно организует элементы, увеличивая атомный номер в строки ( «периоды» ), в которых столбцы ( «группы» ) разделяют повторяющиеся («периодические») физические и химические свойства. Текущая стандартная таблица содержит 118 подтвержденных элементов по состоянию на 2019 год.
Хотя существуют более ранние предшественники этой презентации, ее изобретение обычно приписывают русскому химику Дмитрию Менделееву в 1869 году, который задумал таблицу, чтобы проиллюстрировать повторяющиеся тенденции в свойствах элементов. Структура таблицы со временем уточнялась и расширялась по мере открытия новых элементов и разработки новых теоретических моделей для объяснения химического поведения.
Периодическая таблица Менделеева теперь повсеместно используется в академической дисциплине химия, обеспечивая чрезвычайно полезную основу для классификации, систематизации и сравнения всех множества различных форм химического поведения. Таблица также нашла широкое применение в физике , геологии , биологии , материаловедении , инженерии , сельском хозяйстве , медицине , питании , гигиене окружающей среды и астрономии . Его принципы особенно важны в химической инженерии .
Номенклатура и условные обозначения
Различные химические элементы формально идентифицируются по уникальным атомным номерам , принятым названиям и символам .
Атомные числа
Известные элементы имеют атомные номера от 1 до 118, обычно представленные арабскими цифрами . Поскольку элементы могут быть однозначно упорядочены по атомному номеру, обычно от самого низкого до самого высокого (как в периодической таблице ), наборы элементов иногда задаются такими обозначениями, как «через», «за пределами» или «от ... до» , например, «через железо», «помимо урана» или «от лантана через лютеций». Термины «легкий» и «тяжелый» иногда также неофициально используются для обозначения относительных атомных номеров (не плотности), например, «легче углерода» или «тяжелее свинца»,хотя технически вес или масса атомов элемента (их атомные веса или атомные массы) не всегда монотонно увеличиваются с их атомными номерами.
Имена элементов
Обозначение различных веществ, ныне известных как элементы, предшествует атомной теории материи , поскольку названия давались местными различными культурами различным минералам, металлам, соединениям, сплавам, смесям и другим материалам, хотя в то время не было известно, какие химические вещества были элементы и какие соединения. Поскольку они были идентифицированы как элементы, существующие названия для древнеизвестных элементов (например, золото, ртуть, железо) сохранились в большинстве стран. Национальные различия возникли из-за названий элементов либо из соображений удобства, либо из соображений лингвистики, либо из соображений национализма. Вот несколько наглядных примеров: говорящие на немецком языке используют «Wasserstoff» (водное вещество) для «водорода», «Sauerstoff» (кислотное вещество) для «кислорода» и «Stickstoff» (удушающее вещество) для «азота»,в то время как английский и некоторые романские языкииспользуйте «натрий» вместо «натрий» и «калий» для «калий», а французы, итальянцы, греки, португальцы и поляки предпочитают «азот / азот / азото» (от корней, означающих «нет жизни») вместо «азота».
В целях международного общения и торговли официальные названия химических элементов, как древних, так и недавно признанных, определяются Международным союзом чистой и прикладной химии (IUPAC), который выбрал своего рода международный английский язык, опираясь на традиционный Английские названия, даже если химический символ элемента основан на латинском или другом традиционном слове, например, приняв «золото», а не «aurum» в качестве названия для 79-го элемента (Au). ИЮПАК предпочитает английское написание « алюминий»."и" цезий "вместо" алюминия "и" цезий "в США, а" сера "в США - вместо британского" сера ". Однако элементы, которые можно продавать оптом во многих странах, часто все еще имеют местные национальные названия. , а страны, в национальных языках которых не используется латинский алфавит , скорее всего, будут использовать имена элементов IUPAC.
Согласно IUPAC, химические элементы не являются существительными собственными в английском языке; следовательно, полное название элемента в английском языке обычно не пишется с заглавной буквы, даже если оно образовано от имени собственного , как в californium и einsteinium . Изотопные названия химических элементов также не пишутся заглавными буквами, например, углерод-12 или уран-235 . Символы химических элементов (например, Cf для калифорния и Es для эйнштейния) всегда пишутся с заглавной буквы (см. Ниже).
Во второй половине двадцатого века в физических лабораториях появилась возможность производить ядра химических элементов с периодом полураспада, слишком коротким для того, чтобы их заметное количество могло существовать когда-либо. Они также названы IUPAC, который обычно принимает имя, выбранное первооткрывателем. Такая практика может привести к спорному вопросу о том, какая исследовательская группа на самом деле открыла элемент, вопрос, который задержал присвоение имен элементам с атомным номером 104 и выше на значительный промежуток времени. (См. Спор об именах элементов ).
Предшественниками таких противоречий стали националистические наименования элементов в конце 19 века. Например, лютеций был назван в честь Парижа, Франция. Немцы не хотели уступать права на наименование французам, часто называя это кассиопеем . Точно так же британский первооткрыватель ниобия первоначально назвал его колумбием, имея в виду Новый Свет . Он широко использовался как таковой в американских публикациях до международной стандартизации (в 1950 г.).
Химические символы
Конкретные химические элементы
До того, как химия стала наукой , алхимики создали загадочные символы как для металлов, так и для обычных соединений. Однако они использовались как сокращения в схемах или процедурах; не существовало концепции объединения атомов в молекулы . Благодаря своим достижениям в атомной теории материи Джон Далтон разработал свои собственные более простые символы, основанные на кругах, для изображения молекул.
Современная система химических обозначений была изобретена Берцелиусом . В этой типографской системе химические символы - это не просто сокращения, хотя каждый из них состоит из букв латинского алфавита . Они предназначены как универсальные символы для людей всех языков и алфавитов.
Первый из этих символов должен был быть полностью универсальным. Поскольку латынь в то время была общепринятым языком науки, это были сокращения, основанные на латинских названиях металлов. Cu происходит из меди, Fe - из железа, Ag - из серебра. После символов не ставилась точка (точка), как в аббревиатурах. Более поздним химическим элементам также были присвоены уникальные химические символы, основанные на названии элемента, но не обязательно на английском языке. Например, у натрия есть химический символ «Na» после латинского natrium . То же самое относится к «Fe» (ferrum) для железа , «Hg» (hydrargyrum) для ртути , «Sn» ( олово ) для олова , «Au» (aurum) для золота., «Ag» (argentum) для серебра , «Pb» (свинец) для свинца , «Cu» ( медь ) для меди и «Sb» (сурьма) для сурьмы . «W» (вольфрам) для вольфрама происходит от немецкого, «K» (калий) для калия - от арабского.
Химические символы понимаются во всем мире, когда названия элементов могут потребовать перевода. В прошлом иногда были различия. Например, немцы в прошлом использовали «J» (альтернативное название Jod) для йода, но теперь используют «I» и «Iod».
Первая буква химического символа всегда пишется с заглавной буквы, как в предыдущих примерах, а последующие буквы, если таковые имеются, всегда строчные (строчные). Таким образом, символы калифорния и эйнштейния - Cf и Es.
Общие химические символы
Также есть символы в химических уравнениях для групп химических элементов, например, в сравнительных формулах. Часто это одна заглавная буква, и эти буквы зарезервированы и не используются для имен конкретных элементов. Например, « X » обозначает переменную группу (обычно галоген ) в классе соединений, а « R » обозначает радикал , означающий структуру соединения, такую как углеводородная цепь. Буква « Q » обозначает «тепло» в химической реакции. « Y » также часто используется как общий химический символ, хотя он также является символом иттрия . " Z "также часто используется как общая группа переменных. " E"используется в органической химии для обозначения электроноакцепторной группы или электрофила ; аналогично" Nu "обозначает нуклеофил ." L "используется для обозначения общего лиганда в неорганической и металлоорганической химии ." M "также часто используется вместо из обычного металла.
По крайней мере, два дополнительных двухбуквенных общих химических символа также используются неофициально: « Ln » для любого элемента лантаноида и « An » для любого актинидного элемента. « Rg » раньше использовалось для обозначения любого элемента инертного газа , но теперь группа инертных газов была переименована в благородные газы, а символ « Rg » теперь присвоен элементу рентгений .
Изотопные символы
Изотопы различаются по атомному массовому числу (общее количество протонов и нейтронов) для определенного изотопа элемента, при этом это число совмещено с соответствующим символом элемента. ИЮПАК предпочитает, чтобы символы изотопов были записаны в виде надстрочного обозначения, когда это возможно, например 12 C и 235 U. Однако также используются другие обозначения, такие как углерод-12 и уран-235 или C-12 и U-235.
В качестве особого случая три встречающихся в природе изотопа элемента водорода часто обозначаются как H для 1 H ( протий ), D для 2 H ( дейтерий ) и T для 3 H ( тритий ). Это соглашение легче использовать в химических уравнениях, поскольку оно заменяет необходимость записывать массовое число для каждого атома. Например, формула тяжелой воды может быть записана D 2 O вместо 2 H 2 O.
Происхождение элементов
Этот раздел требует дополнительных ссылок для проверки . ( апрель 2021 г. ) ( Узнайте, как и когда удалить это сообщение-шаблон ) |
Только около 4% общей массы Вселенной состоит из атомов или ионов и, следовательно, состоит из химических элементов. Эта фракция составляет около 15% от всей материи, а остальная часть вещества (85%) - темная материя . Природа темной материи неизвестна, но она не состоит из атомов химических элементов, поскольку не содержит протонов, нейтронов или электронов. (Оставшаяся нематериальная часть массы Вселенной состоит из еще менее изученной темной энергии ).
94 встречающихся в природе химических элемента были произведены по крайней мере четырьмя классами астрофизических процессов. Большая часть водорода , гелия и очень небольшое количество лития были произведены в первые несколько минут Большого взрыва . Этот нуклеосинтез Большого взрыва произошел только однажды; другие процессы продолжаются. Ядерный синтез внутри звезд производит элементы посредством звездного нуклеосинтеза , включая все элементы от углерода до железа по атомному номеру. Элементы с более высоким атомным номером, чем железо, включая тяжелые элементы, такие как уран и плутоний., образуются в результате различных форм взрывного нуклеосинтеза при слиянии сверхновых и нейтронных звезд . Легкие элементы литий , бериллий и бор образуются в основном за счет расщепления космическими лучами (фрагментации, вызванной космическими лучами ) углерода, азота и кислорода .
На ранних этапах Большого взрыва нуклеосинтез ядер водорода привел к образованию водорода-1 ( протий , 1 H) и гелия-4 ( 4 He), а также меньшего количества дейтерия ( 2 H) и очень мизерные количества (порядка 10 -10 ) лития и бериллия. Во время Большого взрыва могло образоваться еще меньшее количество бора, поскольку он наблюдался у некоторых очень старых звезд, а углерод - нет. [21] Во время Большого взрыва не было произведено элементов тяжелее бора. В результате изначальное содержание атомов (или ионов) составляло примерно 75% 1 H, 25% 4.Он и 0,01% дейтерия, только с крошечными следами лития, бериллия и, возможно, бора. [22] Последующее обогащение галактических гало произошло из-за звездного нуклеосинтеза и нуклеосинтеза сверхновой . [23] Однако изобилие элементов в межгалактическом пространстве может по-прежнему сильно напоминать изначальные условия, если только оно не было обогащено каким-либо образом.
На Земле (и в других местах) следовые количества различных элементов продолжают производиться из других элементов как продукты ядерных процессов трансмутации . К ним относятся некоторые, произведенные космическими лучами или другими ядерными реакциями (см. Космогенные и нуклеогенные нуклиды), а другие - продуктами распада долгоживущих первичных нуклидов . [24] Например, следовые (но поддающиеся обнаружению) количества углерода-14 ( 14 C) постоянно производятся в атмосфере космическими лучами, поражающими атомы азота , а аргон-40 ( 40Ar) постоянно образуется при распаде первично встречающегося, но нестабильного калия-40 ( 40 K). Кроме того, три изначально встречающихся, но радиоактивных актинида , торий , уран и плутоний, распадаются через серию периодически образующихся, но нестабильных радиоактивных элементов, таких как радий и радон , которые временно присутствуют в любом образце этих металлов или их руд или соединений. Три другие радиоактивные элементы, технеций , прометий , и нептуний , происходят лишь случайно в природных материалах, производятся в виде отдельных атомов деления ядер из ядер различных тяжелых элементов или в других редких ядерных процессах.
В дополнение к 94 естественным элементам, несколько искусственных элементов были произведены с помощью технологий ядерной физики человека . По состоянию на 2021 год в [Обновить]этих экспериментах были произведены все элементы до атомного номера 118.
Избыток
Следующий график (шкала журнала заметок) показывает количество элементов в нашей Солнечной системе . В таблице показаны двенадцать наиболее распространенных элементов в нашей галактике (оцененные спектроскопически), измеренные в частях на миллион по массе . [25] Соседние галактики, которые развивались по аналогичным направлениям, имеют соответствующее обогащение элементами более тяжелыми, чем водород и гелий. Более далекие галактики рассматриваются такими, какими они были в прошлом, поэтому их содержание элементов кажется более близким к изначальной смеси. Однако, поскольку физические законы и процессы кажутся общими для всей видимой Вселенной , ученые ожидают, что в этих галактиках эволюционировали элементы в таком же количестве.
Обилие элементов в Солнечной системе соответствует их происхождению от нуклеосинтеза во время Большого взрыва и ряда звезд-прародителей сверхновых. В большом количестве водород и гелий являются продуктами Большого взрыва, но следующие три элемента встречаются редко, так как у них было мало времени для образования во время Большого взрыва, и они не образуются в звездах (однако они образуются в небольших количествах в результате распада более тяжелые элементы в межзвездной пыли в результате воздействия космических лучей ). Начиная с углерода, элементы образуются в звездах путем накопления из альфа-частиц (ядер гелия), что приводит к попеременно большему количеству элементов с четными атомными номерами (они также более стабильны). Вообще такие элементы, вплоть до железа, производятся в больших звездах в процессе становления.сверхновые . Железо-56 является особенно распространенным, поскольку это наиболее стабильный элемент, который можно легко получить из альфа-частиц (являющийся продуктом распада радиоактивного никеля-56, в конечном итоге состоящего из 14 ядер гелия). Элементы тяжелее железа образуются в процессах поглощения энергии в крупных звездах, и их содержание во Вселенной (и на Земле) обычно уменьшается вместе с их атомным номером.
Обилие химических элементовна Земле варьируется от воздуха до коры и океана, а также в различных формах жизни. Обилие элементов в земной коре отличается от такового в Солнечной системе (как видно на Солнце и тяжелых планетах, таких как Юпитер), главным образом избирательной потерей самых легких элементов (водорода и гелия), а также летучих неона, углерода (в виде углеводородов). , азот и сера, в результате солнечного нагрева в начале формирования солнечной системы. Кислород, самый распространенный элемент Земли по массе, удерживается на Земле за счет соединения с кремнием. Алюминий в количестве 8% по массе более распространен в земной коре, чем во Вселенной и Солнечной системе, но состав гораздо более объемной мантии, в которой магний и железо заменены на алюминий (который присутствует там только в количестве 2% по массе). ) более точно отражает элементный состав Солнечной системы,за исключением отмеченной потери летучих элементов в космос и потери железа, которое переместилось в ядро Земли.
Состав человеческого тела , напротив, более близко следует за состав морской воды -Save , что человеческое тело имеет дополнительные запасы углерода и азота , необходимого для образования белков и нуклеиновых кислот , вместе с фосфором в молекуле нуклеиновых кислот и переноса энергии аденозинтрифосфат (АТФ), который встречается в клетках всех живых организмов. Определенным видам организмов требуются особые дополнительные элементы, например, магний в хлорофилле зеленых растений, кальций враковин моллюсков , или железо в гемоглобине в позвоночных животных " красных кровяных клеток .
| Элементы в нашей галактике | Частей на миллион по массе |
|---|---|
| Водород | 739 000 |
| Гелий | 240 000 |
| Кислород | 10 400 |
| Углерод | 4600 |
| Неон | 1,340 |
| Утюг | 1,090 |
| Азот | 960 |
| Кремний | 650 |
| Магний | 580 |
| Сера | 440 |
| Калий | 210 |
| Никель | 100 |
| ЧАС | Он | |||||||||||||||||
| Ли | Быть | B | C | N | О | F | Ne | |||||||||||
| Na | Mg | Al | Si | п | S | Cl | Ar | |||||||||||
| K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | В виде | Se | Br | Kr | |
| Руб. | Sr | Y | Zr | Nb | Пн | Tc | RU | Rh | Pd | Ag | CD | В | Sn | Sb | Te | я | Xe | |
| CS | Ба | * | Лу | Hf | Та | W | Re | Операционные системы | Ir | Pt | Au | Hg | Tl | Pb | Би | По | В | Rn |
| Пт | Ра | ** | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Ур. | Ц | Og |
| * | Ла | Ce | Pr | Nd | Вечера | См | Евросоюз | Б-г | Tb | Dy | Хо | Э | Тм | Yb | ||||
| ** | Ac | Чт | Па | U | Np | Пу | Являюсь | См | Bk | Cf | Es | FM | Мкр | Нет | ||||
| Легенда: | ||
|---|---|---|
| ||
| ||
| ||
| ||
| ||
| ||
|
История
Развивающиеся определения
Концепция «элемента» как неделимой субстанции развивалась на протяжении трех основных исторических фаз: классических определений (например, древних греков), химических определений и атомных определений.
Классические определения
Античная философия постулировала набор классических элементов для объяснения наблюдаемых закономерностей в природе . Эти элементы первоначально относились к земле , воде , воздуху и огню, а не к химическим элементам современной науки.
Термин «элементы» ( стоихея ) был впервые использован греческим философом Платоном примерно в 360 г. до н. Э. В его диалоге « Тимей» , который включает обсуждение состава неорганических и органических тел и представляет собой теоретический трактат по химии. Платон полагал, что элементы, введенные столетием ранее Эмпедоклом, состоят из малых многогранных форм : тетраэдра (огонь), октаэдра (воздух), икосаэдра (вода) и куба (земля). [28] [29]
Аристотель , ок. 350 г. до н.э. также использовали термин стоихея и добавили пятый элемент, названный эфиром , который сформировал небеса. Аристотель определил элемент как:
Элемент - одно из тех тел, на которое могут разложиться другие тела, и которое само не может быть разделено на другие. [30]
Химические определения
В 1661 году Роберт Бойль предложил свою теорию корпускуляризма, которая отдавала предпочтение анализу материи как составной из несводимых единиц материи (атомов) и, выбрав сторону ни Аристотеля, ни взгляда Парацельса на три основных элемента, не оставил открытым вопрос о количестве элементов. [31] Первый современный список химических элементов был дан в « Элементах химии» Антуана Лавуазье 1789 года , который содержал тридцать три элемента, включая легкий и калорийный . [32] К 1818 году Йенс Якоб Берцелиусопределила атомные веса сорока пяти из сорока девяти тогда принятых элементов. В периодической таблице Дмитрия Менделеева 1869 года было шестьдесят шесть элементов .
От Бойля до начала 20 века элемент определялся как чистое вещество, которое нельзя разложить на более простое вещество. [31] Другими словами, химический элемент не может быть преобразован в другие химические элементы с помощью химических процессов. Элементы в то время обычно различались по их атомному весу, а это свойство можно было с достаточной точностью измерить доступными аналитическими методами.
Атомарные определения
Открытие в 1913 году английским физиком Генри Мозли того, что заряд ядра является физической основой атомного номера атома, которое было уточнено после того, как стала оценена природа протонов и нейтронов , в конечном итоге привело к нынешнему определению элемента, основанному на атомном номере (число протонов на атомное ядро). Использование атомных чисел, а не атомных весов для различения элементов имеет большую прогностическую ценность (поскольку эти числа являются целыми числами), а также устраняет некоторые неоднозначности в представлении на основе химии из-за различных свойств изотопов и аллотропов в одном элементе. В настоящее время ИЮПАК определяет элемент как существующий, если у него есть изотопы со сроком службы более 10−14 секунд требуется ядру, чтобы сформировать электронное облако. [33]
К 1914 году было известно семьдесят два элемента, все встречающиеся в природе. [34] Остальные природные элементы были обнаружены или выделены в последующие десятилетия, а также синтетическим путем были произведены различные дополнительные элементы, причем большая часть этой работы была начата Гленном Т. Сиборгом . В 1955 году был открыт элемент 101, названный менделевием в честь Д.И. Менделеева, первого элемента, расположившего элементы периодическим образом.
Открытие и признание различных элементов
Десять материалов, знакомых различным доисторическим культурам, теперь известны как химические элементы: углерод , медь , золото , железо , свинец , ртуть , серебро , сера , олово и цинк . Три дополнительных материала, которые теперь считаются элементами, мышьяк , сурьма и висмут , были признаны отдельными веществами до 1500 года нашей эры. Фосфор , кобальт и платина были выделены до 1750 г.
Большинство оставшихся в природе химических элементов были идентифицированы и охарактеризованы к 1900 году, в том числе:
- Такие привычные сейчас промышленные материалы, как алюминий , кремний , никель , хром , магний и вольфрам.
- Реактивные металлы, такие как литий , натрий , калий и кальций.
- Галогены фтор , хлор , бром и йод
- Газы, такие как водород , кислород , азот , гелий , аргон и неон.
- Большинство редкоземельных элементов , включая церий , лантан , гадолиний и неодим .
- Наиболее распространенные радиоактивные элементы, включая уран , торий , радий и радон.
Элементы, изолированные или производимые с 1900 года, включают:
- Три оставшихся неоткрытых регулярно встречающихся стабильных природных элемента: гафний , лютеций и рений.
- Плутоний , который впервые был произведен синтетически в 1940 году Гленном Т. Сиборгом , но теперь известен также из нескольких давно существующих природных явлений.
- Три случайно встречающихся природных элемента ( нептуний , прометий и технеций ), которые сначала были произведены синтетическим путем, но позже обнаружены в следовых количествах в определенных геологических образцах.
- Четыре дефицитных продукта распада урана или тория ( астат , франций , актиний и протактиний ) и
- Различные синтетические трансурановые элементы, начиная с америция и кюрия.
Недавно обнаруженные элементы
Первым трансурановым элементом (элемент с атомным номером больше 92) был обнаружен нептуний в 1940 году. С 1999 года заявления об открытии новых элементов рассматриваются Совместной рабочей группой IUPAC / IUPAP . По состоянию на январь 2016 года все 118 элементов были подтверждены IUPAC как обнаруженные . Открытие 112-го элемента было признано в 2009 году, и для него было предложено название copernicium и атомный символ Cn . [35] Название и символ были официально одобрены ИЮПАК 19 февраля 2010 года. [36] Считается, что самым тяжелым элементом, синтезированным на сегодняшний день, является элемент 118, оганессон., 9 октября 2006 г., Лаборатория ядерных реакций им. Флерова в Дубне , Россия. [9] [37] Теннессин , элемент 117, был последним элементом, который, как утверждалось, был обнаружен в 2009 году. [38] 28 ноября 2016 года ученые ИЮПАК официально признали названия четырех новейших химических элементов с атомными номерами 113 , 115, 117 и 118. [39] [40]
Список 118 известных химических элементов
Следующая таблица с возможностью сортировки показывает 118 известных химических элементов.
- Атомный номер , элемент и символ служат независимо друг от друга как уникальные идентификаторы.
- Названия элементов приняты ИЮПАК .
- Цвет фона столбца символа указывает блок периодической таблицы для каждого элемента: красный = s-блок, желтый = p-блок, синий = d-блок, зеленый = f-блок.
- Группа и период относятся к положению элемента в периодической таблице . Номера групп здесь показывают принятую в настоящее время нумерацию; старые альтернативные нумерации см. в разделе Группа (таблица Менделеева) .
| Список химических элементов | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Атомный номер | Символ | Элемент | Этимология [41] [42] | Группа | Период | Атомный вес [43] [44] | Плотность | Точка плавления [45] | Точка кипения | Удельная теплоемкость | Электроотрицательность | Изобилие в земной коре [I] |
| ( Да ) | (грамм/см 3) | ( К ) | (К) | (J/г · К) | (мг/кг) | |||||||
| 1 | ЧАС | Водород | Греческие элементы гидро- и -gen , « воды образующая» | 1 | 1 | 1,008 | 0,00008988 | 14.01 | 20,28 | 14.304 | 2,20 | 1400 |
| 2 | Он | Гелий | Греческий Helios « ВС » | 18 | 1 | 4.002602 (2) | 0,0001785 | - [II] | 4,22 | 5,193 | - | 0,008 |
| 3 | Ли | Литий | Греческий LITHOS , « камень » | 1 | 2 | 6.94 [III] [IV] [V] [VI] [VII] | 0,534 | 453,69 | 1560 | 3,582 | 0,98 | 20 |
| 4 | Быть | Бериллий | Берилл , минерал (в конечном счете, от названия Белура на юге Индии [ необходима цитата ] ) | 2 | 2 | 9.0121831 (5) | 1,85 | 1560 | 2742 | 1,825 | 1,57 | 2,8 |
| 5 | B | Бор | Бура , минерал (от арабского bawraq ) | 13 | 2 | 10,81 [III] [IV] [V] [VII] | 2.34 | 2349 | 4200 | 1.026 | 2,04 | 10 |
| 6 | C | Углерод | Latin карбо « уголь » | 14 | 2 | 12.011 [III] [V] [VII] | 2,267 | > 4000 (в зависимости от давления) | 4300 | 0,709 | 2,55 | 200 |
| 7 | N | Азот | Греческий нитрон и -gen « селитра образующая» | 15 | 2 | 14.007 [III] [V] [VII] | 0,0012506 | 63,15 | 77,36 | 1.04 | 3,04 | 19 |
| 8 | О | Кислород | Греческий окси- и -gen , « кислота образующая» | 16 | 2 | 15,999 [III] [V] [VII] | 0,001429 | 54,36 | 90,20 | 0,918 | 3,44 | 461000 |
| 9 | F | Фтор | Латинское fluere , «течь» | 17 | 2 | 18.998403163 (6) | 0,001696 | 53,53 | 85,03 | 0,824 | 3,98 | 585 |
| 10 | Ne | Неон | Греческое néon , "новый" | 18 | 2 | 20.1797 (6) [III] [IV] | 0,0008999 | 24,56 | 27.07 | 1.03 | - | 0,005 |
| 11 | Na | Натрий | Английский (от средневековой латыни) soda (символ Na происходит от нового латинского natrium , от немецкого Natron , ' натрон ') | 1 | 3 | 22.98976928 (2) | 0,971 | 370,87 | 1156 | 1,228 | 0,93 | 23600 |
| 12 | Mg | Магний | Магнезия , район Восточной Фессалии в Греции. | 2 | 3 | 24.305 [VII] | 1,738 | 923 | 1363 | 1.023 | 1,31 | 23300 |
| 13 | Al | Алюминий | глинозем , от латинского alumen (gen. aluminis ), «горькая соль, квасцы » | 13 | 3 | 26.9815384 (3) | 2,698 | 933,47 | 2792 | 0,897 | 1,61 | 82300 |
| 14 | Si | Кремний | Латинское silx , ' кремень ' (первоначально кремний ) | 14 | 3 | 28.085 [V] [VII] | 2,3296 | 1687 | 3538 | 0,705 | 1,90 | 282000 |
| 15 | п | Фосфор | Греческое phōsphóros , "светоносный" | 15 | 3 | 30.973761998 (5) | 1,82 | 317,30 | 550 | 0,769 | 2,19 | 1050 |
| 16 | S | Сера | Латинское сера , сера | 16 | 3 | 32.06 [III] [V] [VII] | 2,067 | 388,36 | 717,87 | 0,71 | 2,58 | 350 |
| 17 | Cl | Хлор | Греческий chlōrós , "зеленовато-желтый" | 17 | 3 | 35,45 [III] [IV] [V] [VII] | 0,003214 | 171,6 | 239,11 | 0,479 | 3,16 | 145 |
| 18 | Ar | Аргон | Греческие Argos , «простаивает» (из - за своей инертности ) | 18 | 3 | 39,95 [III] [V] [VII] | 0,0017837 | 83,80 | 87,30 | 0,52 | - | 3.5 |
| 19 | K | Калий | Новое латинское potassa , « поташ », исельф от слова горшок и ясень (символ K происходит от латинского kalium ). | 1 | 4 | 39,0983 (1) | 0,862 | 336,53 | 1032 | 0,757 | 0,82 | 20900 |
| 20 | Ca | Кальций | Latin окалины , « лайм » | 2 | 4 | 40.078 (4) [III] | 1,54 | 1115 | 1757 | 0,647 | 1,00 | 41500 |
| 21 год | Sc | Скандий | Латинская Скандия , ' Скандинавия ' | 3 | 4 | 44.955908 (5) | 2,989 | 1814 г. | 3109 | 0,568 | 1,36 | 22 |
| 22 | Ti | Титана | Титаны , сыновья богини земли из греческой мифологии | 4 | 4 | 47,867 (1) | 4,54 | 1941 г. | 3560 | 0,523 | 1,54 | 5650 |
| 23 | V | Ванадий | Ванадис , древнескандинавское имя скандинавской богини Фрейи. | 5 | 4 | 50,9415 (1) | 6,11 | 2183 | 3680 | 0,489 | 1,63 | 120 |
| 24 | Cr | Хром | Греческий Chroma , « цвет » | 6 | 4 | 51,9961 (6) | 7,15 | 2180 | 2944 | 0,449 | 1,66 | 102 |
| 25 | Mn | Марганец | Осквернено магнезией негра ; см. Магний | 7 | 4 | 54.938043 (2) | 7,44 | 1519 | 2334 | 0,479 | 1,55 | 950 |
| 26 год | Fe | Утюг | Английское слово (символ Fe происходит от латинского ferrum ) | 8 | 4 | 55,845 (2) | 7,874 | 1811 г. | 3134 | 0,449 | 1,83 | 56300 |
| 27 | Co | Кобальт | Немецкий Kobold , « Гоблин » | 9 | 4 | 58.933194 (3) | 8,86 | 1768 г. | 3200 | 0,421 | 1,88 | 25 |
| 28 год | Ni | Никель | Никель, озорной спрайт немецкой шахтерской мифологии | 10 | 4 | 58,6934 (4) | 8,912 | 1728 | 3186 | 0,444 | 1,91 | 84 |
| 29 | Cu | Медь | Английское слово, от латинского cuprum , от древнегреческого Kýpros ' Кипр '. | 11 | 4 | 63,546 (3) [V] | 8,96 | 1357,77 | 2835 | 0,385 | 1,90 | 60 |
| 30 | Zn | Цинк | Скорее всего, от немецкого Zinke , «зубец» или «зуб», хотя некоторые предполагают, что персидский пел , «камень». | 12 | 4 | 65,38 (2) | 7,134 | 692,88 | 1180 | 0,388 | 1,65 | 70 |
| 31 год | Ga | Галлий | Латинское Gallia , ' Франция ' | 13 | 4 | 69,723 (1) | 5,907 | 302,9146 | 2673 | 0,371 | 1,81 | 19 |
| 32 | Ge | Германий | Латинская Германия , ' Германия ' | 14 | 4 | 72,630 (8) | 5,323 | 1211,40 | 3106 | 0,32 | 2,01 | 1.5 |
| 33 | В виде | Мышьяк | Французский мышьяк , от греческого arsenikón «желтый мышьяк» (под влиянием arsenikós , «мужской» или «мужской»), из западноазиатского странствующего слова, в конечном счете, от древнеиранского * zarniya-ka , «золотой». | 15 | 4 | 74.921595 (6) | 5,776 | 1090 [VIII] | 887 | 0,329 | 2,18 | 1,8 |
| 34 | Se | Селен | Греческое selḗnē , ' луна ' | 16 | 4 | 78.971 (8) [V] | 4,809 | 453 | 958 | 0,321 | 2,55 | 0,05 |
| 35 год | Br | Бром | Греческие brômos , «вонь» | 17 | 4 | 79,904 [VII] | 3,122 | 265,8 | 332,0 | 0,474 | 2,96 | 2,4 |
| 36 | Kr | Криптон | Греческие Kryptos , «скрытый» | 18 | 4 | 83,798 (2) [III] [IV] | 0,003733 | 115,79 | 119,93 | 0,248 | 3,00 | 1 × 10 −4 |
| 37 | Руб. | Рубидий | Латинское rubidus , глубокий красный | 1 | 5 | 85.4678 (3) [III] | 1,532 | 312,46 | 961 | 0,363 | 0,82 | 90 |
| 38 | Sr | Стронций | Стронтиан , деревня в Шотландии , где он был найден. | 2 | 5 | 87,62 (1) [III] [V] | 2,64 | 1050 | 1655 | 0,301 | 0,95 | 370 |
| 39 | Y | Иттрий | Иттерби , Швеция , где был найден | 3 | 5 | 88,90584 (1) | 4,469 | 1799 | 3609 | 0,298 | 1,22 | 33 |
| 40 | Zr | Цирконий | Циркон , минерал, персидский заргун, золотистый | 4 | 5 | 91.224 (2) [III] | 6,506 | 2128 | 4682 | 0,278 | 1,33 | 165 |
| 41 год | Nb | Ниобий | Ниоба , дочь царя Тантала из греческой мифологии | 5 | 5 | 92.90637 (1) | 8,57 | 2750 | 5017 | 0,265 | 1.6 | 20 |
| 42 | Пн | Молибден | Греческое molýbdaina , «кусок свинца », от mólybdos , «свинец», из-за путаницы со свинцовой рудой галенитом (PbS). | 6 | 5 | 95,95 (1) [III] | 10,22 | 2896 | 4912 | 0,251 | 2,16 | 1.2 |
| 43 год | Tc | Технеций | Греческие tekhnētós , «искусственный» | 7 | 5 | [98] [IX] | 11,5 | 2430 | 4538 | - | 1.9 | ~ 3 × 10 −9 [X] |
| 44 год | RU | Рутений | Новая Латинская Малороссия , ' Россия ' | 8 | 5 | 101.07 (2) [III] | 12,37 | 2607 | 4423 | 0,238 | 2.2 | 0,001 |
| 45 | Rh | Родий | Греческое rhodóeis , « цвет розы », от rhódon , « роза ». | 9 | 5 | 102,90549 (2) | 12,41 | 2237 | 3968 | 0,243 | 2,28 | 0,001 |
| 46 | Pd | Палладий | Астероид Паллада , который в то время считался планетой | 10 | 5 | 106,42 (1) [III] | 12.02 | 1828,05 | 3236 | 0,244 | 2,20 | 0,015 |
| 47 | Ag | Серебро | Английское слово (символ происходит от латинского argentum ) | 11 | 5 | 107.8682 (2) [III] | 10,501 | 1234,93 | 2435 | 0,235 | 1,93 | 0,075 |
| 48 | CD | Кадмий | Новая латинская кадмия от короля Кадмоса | 12 | 5 | 112.414 (4) [III] | 8,69 | 594,22 | 1040 | 0,232 | 1,69 | 0,159 |
| 49 | В | Индий | Латинское indicum , ' индиго ' (цвет в его спектре) | 13 | 5 | 114,818 (1) | 7.31 | 429,75 | 2345 | 0,233 | 1,78 | 0,25 |
| 50 | Sn | Банка | Английское слово (символ происходит от латинского stannum ) | 14 | 5 | 118,710 (7) [III] | 7,287 | 505,08 | 2875 | 0,228 | 1,96 | 2.3 |
| 51 | Sb | Сурьма | Латинский антимоний , происхождение которого неясно: народные этимологии предполагают, что оно происходит от греческого antí («против») + mónos («одинокий») или старофранцузского anti- moine , «проклятие монаха», но вполне вероятно, что оно произошло от или связано с арабским ʾiṯmid , «сурьма», переформатированное как латинское слово. (Символ происходит от латинского сурьма « антимонита ».) | 15 | 5 | 121.760 (1) [III] | 6,685 | 903,78 | 1860 г. | 0,207 | 2,05 | 0,2 |
| 52 | Te | Теллур | Латинское tellus , "земля, Земля" | 16 | 5 | 127.60 (3) [III] | 6,232 | 722,66 | 1261 | 0,202 | 2.1 | 0,001 |
| 53 | я | Йод | Французское iode , от греческого ioeidḗs , 'фиолетовый' | 17 | 5 | 126,90447 (3) | 4,93 | 386,85 | 457,4 | 0,214 | 2,66 | 0,45 |
| 54 | Xe | Ксенон | Греческий xénon , средний род от xénos 'странный' | 18 | 5 | 131.293 (6) [III] [IV] | 0,005887 | 161,4 | 165,03 | 0,158 | 2,60 | 3 × 10 −5 |
| 55 | CS | Цезий | Латинское caesius , "небесно-голубой" | 1 | 6 | 132.90545196 (6) | 1,873 | 301,59 | 944 | 0,242 | 0,79 | 3 |
| 56 | Ба | Барий | Греческое barýs , тяжелый | 2 | 6 | 137,327 (7) | 3,594 | 1000 | 2170 | 0,204 | 0,89 | 425 |
| 57 | Ла | Лантан | Греческий lanthánein «врать скрытый» | 6 | 138.90547 (7) [III] | 6,145 | 1193 | 3737 | 0,195 | 1.1 | 39 | |
| 58 | Ce | Церий | Карликовая планета Церера , считавшаяся планетой на момент ее открытия | 6 | 140.116 (1) [III] | 6,77 | 1068 | 3716 | 0,192 | 1,12 | 66,5 | |
| 59 | Pr | Празеодим | Греческие prásios Didymos , «зеленый близнец» | 6 | 140,90766 (1) | 6,773 | 1208 | 3793 | 0,193 | 1.13 | 9.2 | |
| 60 | Nd | Неодим | Греческие ОСЗ Didymos , «новый близнец» | 6 | 144.242 (3) [III] | 7,007 | 1297 | 3347 | 0,19 | 1.14 | 41,5 | |
| 61 | Вечера | Прометий | Прометей из греческой мифологии | 6 | [145] [IX] | 7,26 | 1315 | 3273 | - | 1.13 | 2 × 10 −19 [X] | |
| 62 | См | Самарий | Самарскит , минерал, названный в честь полковника Василия Самарского-Быховца , российского шахтёра. | 6 | 150.36 (2) [III] | 7,52 | 1345 | 2067 | 0,197 | 1.17 | 7,05 | |
| 63 | Евросоюз | Европий | Европа | 6 | 151.964 (1) [III] | 5,243 | 1099 | 1802 г. | 0,182 | 1.2 | 2 | |
| 64 | Б-г | Гадолиний | Гадолинит , минерал, названный в честь Йохана Гадолина , финского химика, физика и минералога. | 6 | 157,25 (3) [III] | 7,895 | 1585 | 3546 | 0,236 | 1.2 | 6.2 | |
| 65 | Tb | Тербий | Иттерби , Швеция , где был найден | 6 | 158.925354 (8) | 8,229 | 1629 г. | 3503 | 0,182 | 1.2 | 1.2 | |
| 66 | Dy | Диспрозий | Греческий dysprósitos , "трудно достать" | 6 | 162 500 (1) [III] | 8,55 | 1680 | 2840 | 0,17 | 1,22 | 5.2 | |
| 67 | Хо | Гольмий | Новая латинская Holmia , ' Стокгольм ' | 6 | 164.930328 (7) | 8,795 | 1734 | 2993 | 0,165 | 1,23 | 1.3 | |
| 68 | Э | Эрбий | Иттерби , Швеция , где был найден | 6 | 167.259 (3) [III] | 9,066 | 1802 г. | 3141 | 0,168 | 1,24 | 3.5 | |
| 69 | Тм | Тулий | Туле , древнее название неясного северного местоположения | 6 | 168.934218 (6) | 9,321 | 1818 г. | 2223 | 0,16 | 1,25 | 0,52 | |
| 70 | Yb | Иттербий | Иттерби , Швеция , где был найден | 6 | 173.045 (10) [III] | 6,965 | 1097 | 1469 | 0,155 | 1.1 | 3,2 | |
| 71 | Лу | Лютеций | Латинская лютеция , ' Париж ' | 3 | 6 | 174.9668 (1) [III] | 9,84 | 1925 г. | 3675 | 0,154 | 1,27 | 0,8 |
| 72 | Hf | Гафний | Новая латинская Hafnia , ' Копенгаген ' (от датского havn , гавань) | 4 | 6 | 178,49 (2) | 13.31 | 2506 | 4876 | 0,144 | 1.3 | 3 |
| 73 | Та | Тантал | Царь Тантал , отец Ниобы из греческой мифологии | 5 | 6 | 180.94788 (2) | 16,654 | 3290 | 5731 | 0,14 | 1.5 | 2 |
| 74 | W | Вольфрам | Шведский дун Стен , «тяжелый камень» (символ W от Wolfram , имя , используемое для элемента во многих языках, родом из средневерхненемецких волчьей Rahm (пены волка) , описывающих минеральный вольфрамит ) [46] | 6 | 6 | 183,84 (1) | 19,25 | 3695 | 5828 | 0,132 | 2,36 | 1.3 |
| 75 | Re | Рений | Латинское Rhenus , ' Рейн ' | 7 | 6 | 186.207 (1) | 21.02 | 3459 | 5869 | 0,137 | 1.9 | 7 × 10 −4 |
| 76 | Операционные системы | Осмий | Греческий osmḗ , « запах » | 8 | 6 | 190,23 (3) [III] | 22,59 | 3306 | 5285 | 0,13 | 2.2 | 0,002 |
| 77 | Ir | Иридий | Ирис , греческая богиня радуги | 9 | 6 | 192,217 (2) | 22,56 | 2719 | 4701 | 0,131 | 2,20 | 0,001 |
| 78 | Pt | Платина | Платина испанская , серебрянка, от plata silver | 10 | 6 | 195.084 (9) | 21,46 | 2041,4 | 4098 | 0,133 | 2,28 | 0,005 |
| 79 | Au | Золото | Английское слово (символ Au происходит от латинского aurum ) | 11 | 6 | 196.966570 (4) | 19 282 | 1337,33 | 3129 | 0,129 | 2,54 | 0,004 |
| 80 | Hg | Меркурий | Меркурий , римский бог торговли, общения и удачи, известный своей скоростью и подвижностью (символ Hg происходит от латинского названия элемента hydrargyrum , от греческого hydrágeryros , «вода-серебро»). | 12 | 6 | 200,592 (3) | 13,5336 | 234,43 | 629,88 | 0,14 | 2,00 | 0,085 |
| 81 год | Tl | Таллий | Греческий талло , «зеленый побег или веточка» | 13 | 6 | 204,38 [VII] | 11,85 | 577 | 1746 | 0,129 | 1,62 | 0,85 |
| 82 | Pb | Вести | Английское слово (символ Pb происходит от латинского plumbum ) | 14 | 6 | 207,2 (1) [III] [V] | 11,342 | 600,61 | 2022 год | 0,129 | 1,87 ( 2+ ), 2,33 (4+) | 14 |
| 83 | Би | Висмут | Немецкий Wismut , от weiß Masse 'белая масса', если не арабский | 15 | 6 | 208.98040 (1) [IX] | 9,807 | 544,7 | 1837 г. | 0,122 | 2,02 | 0,009 |
| 84 | По | Полоний | Латинская Полония , ' Польша ' (родина Марии Кюри ) | 16 | 6 | [209] [IX] | 9,32 | 527 | 1235 | - | 2.0 | 2 × 10 −10 [X] |
| 85 | В | Астатин | Греческое ástatos , нестабильный | 17 | 6 | [210] [IX] | 7 | 575 | 610 | - | 2.2 | 3 × 10 −20 [X] |
| 86 | Rn | Радон | Излучение радия , первоначально название изотопа радон-222 . | 18 | 6 | [222] [IX] | 0,00973 | 202 | 211,3 | 0,094 | 2.2 | 4 × 10 −13 [X] |
| 87 | Пт | Франций | Франция | 1 | 7 | [223] [IX] | 1,87 | 281 | 890 | - | > 0,79 [47] | ~ 1 × 10 −18 [X] |
| 88 | Ра | Радий | Французский радий , от латинского радиуса , ' луч ' | 2 | 7 | [226] [IX] | 5.5 | 973 | 2010 г. | 0,094 | 0,9 | 9 × 10 −7 [X] |
| 89 | Ac | Актиний | Греческое aktís , луч | 7 | [227] [IX] | 10.07 | 1323 | 3471 | 0,12 | 1.1 | 5,5 × 10 −10 [X] | |
| 90 | Чт | Торий | Тор , скандинавский бог грома | 7 | 232.0377 (4) [IX] [III] | 11,72 | 2115 | 5061 | 0,113 | 1.3 | 9,6 | |
| 91 | Па | Протактиний | Прото- (от греч. Protos , «сначала, до») + актиний , так как актиний образуется в результате радиоактивного распада протактиния. | 7 | 231.03588 (1) [IX] | 15,37 | 1841 г. | 4300 | - | 1.5 | 1,4 × 10 −6 [X] | |
| 92 | U | Уран | Уран , седьмая планета Солнечной системы | 7 | 238.02891 (3) [IX] | 18,95 | 1405,3 | 4404 | 0,116 | 1,38 | 2,7 | |
| 93 | Np | Нептуний | Нептун , восьмая планета Солнечной системы | 7 | [237] [IX] | 20,45 | 917 | 4273 | - | 1,36 | ≤ 3 × 10 −12 [X] | |
| 94 | Пу | Плутоний | Карликовая планета Плутон , считавшаяся девятой планетой Солнечной системы на момент ее открытия. | 7 | [244] [IX] | 19,85 [XI] | 912,5 | 3501 | - | 1,28 | ≤ 3 × 10 −11 [X] | |
| 95 | Являюсь | Америций | Америка , поскольку элемент был впервые синтезирован на континенте по аналогии с европием | 7 | [243] [IX] | 13,69 | 1449 | 2880 | - | 1.13 | 0 [XII] | |
| 96 | См | Кюрий | Пьер Кюри и Мария Кюри , французские физики и химики | 7 | [247] [IX] | 13,51 | 1613 | 3383 | - | 1,28 | 0 [XII] | |
| 97 | Bk | Берклиум | Беркли , Калифорния, где элемент был впервые синтезирован по аналогии с тербием. | 7 | [247] [IX] | 14,79 | 1259 | 2900 | - | 1.3 | 0 [XII] | |
| 98 | Cf | Калифорний | Калифорния , где впервые был синтезирован элемент | 7 | [251] [IX] | 15.1 | 1173 | (1743) [XIII] | - | 1.3 | 0 [XII] | |
| 99 | Es | Эйнштейний | Альберт Эйнштейн , немецкий физик | 7 | [252] [IX] | 8,84 | 1133 | (1269) [XIII] | - | 1.3 | 0 [XII] | |
| 100 | FM | Фермий | Энрико Ферми , итальянский физик | 7 | [257] [IX] | (9.7) [XIII] | (1125) [XIII] | - | - | 1.3 | 0 [XII] | |
| 101 | Мкр | Менделевий | Дмитрий Менделеев , русский химик и изобретатель, предложивший периодическую таблицу | 7 | [258] [IX] | (10.3) [XIII] | (1100) [XIII] | - | - | 1.3 | 0 [XII] | |
| 102 | Нет | Нобелий | Альфред Нобель , шведский химик и инженер | 7 | [259] [IX] | (9.9) [XIII] | (1100) [XIII] | - | - | 1.3 | 0 [XII] | |
| 103 | Lr | Лоуренсий | Эрнест Лоуренс , американский физик | 3 | 7 | [266] [IX] | (15,6) [XIII] | (1900) [XIII] | - | - | 1.3 | 0 [XII] |
| 104 | Rf | Резерфордий | Эрнест Резерфорд , химик и физик из Новой Зеландии | 4 | 7 | [267] [IX] | (23.2) [XIII] | (2400) [XIII] | (5800) [XIII] | - | - | 0 [XII] |
| 105 | Db | Дубний | Дубна , Россия, где Объединенный институт ядерных исследований расположен | 5 | 7 | [268] [IX] | (29,3) [XIII] | - | - | - | - | 0 [XII] |
| 106 | Sg | Сиборгий | Гленн Т. Сиборг , американский химик | 6 | 7 | [269] [IX] | (35,0) [XIII] | - | - | - | - | 0 [XII] |
| 107 | Bh | Бориум | Нильс Бор , датский физик | 7 | 7 | [270] [IX] | (37.1) [XIII] | - | - | - | - | 0 [XII] |
| 108 | Hs | Калий | Новый латинский Hassia « Гесс » (государство в Германии) | 8 | 7 | [270] [IX] | (40,7) [XIII] | - | - | - | - | 0 [XII] |
| 109 | Mt | Мейтнерий | Лиз Мейтнер , австрийский физик | 9 | 7 | [278] [IX] | (37,4) [XIII] | - | - | - | - | 0 [XII] |
| 110 | Ds | Дармштадтиум | Дармштадт , Германия, где элемент был впервые синтезирован. | 10 | 7 | [281] [IX] | (34,8) [XIII] | - | - | - | - | 0 [XII] |
| 111 | Rg | Рентгений | Вильгельм Конрад Рентген , немецкий физик | 11 | 7 | [282] [IX] | (28,7) [XIII] | - | - | - | - | 0 [XII] |
| 112 | Cn | Копернициум | Николай Коперник , польский астроном | 12 | 7 | [285] [IX] | (14,0) [XIII] | (283) [XIV] | (340) [XIV] | - | - | 0 [XII] |
| 113 | Nh | Нихоний | Японский Nihon , ' Япония ' (где элемент был впервые синтезирован) | 13 | 7 | [286] [IX] | (16) [XIII] | (700) [XIII] | (1400) [XIII] | - | - | 0 [XII] |
| 114 | Fl | Флеровий | Лаборатория ядерных реакций , часть ОИЯИ , где был синтезирован элемент; Сама названа в честь Георгия Флёрова , российского физика. | 14 | 7 | [289] [IX] | (9.928) [XIII] | (200) | (380) | - | - | 0 [XII] |
| 115 | Mc | Московиум | Московская область , Россия, где элемент был впервые синтезирован | 15 | 7 | [290] [IX] | (13,5) [XIII] | (700) [XIII] | (1400) [XIII] | - | - | 0 [XII] |
| 116 | Ур. | Ливерморий | Ливерморская национальная лаборатория Лоуренса в Ливерморе, Калифорния , которая сотрудничала с ОИЯИ в его синтезе. | 16 | 7 | [293] [IX] | (12.9) [XIII] | (700) [XIII] | (1100) [XIII] | - | - | 0 [XII] |
| 117 | Ц | Tennessine | Теннесси , США (где находится Национальная лаборатория Ок-Ридж ) | 17 | 7 | [294] [IX] | (7.2) [XIII] | (700) [XIII] | (883) [XIII] | - | - | 0 [XII] |
| 118 | Og | Оганессон | Юрий Оганесян , армянский физик российского происхождения | 18 | 7 | [294] [IX] | (7) [XIII] [XV] | (325) [XIII] | (450) [XIII] [XVI] | - | - | 0 [XII] |
Заметки
| ||||||||||||
Цвет фона показывает категорию:
| s-блок | f-блок | d-блок | p-блок |
Смотрите также
- Биологические роли элементов
- Химическая база данных
- Открытие химических элементов
- Сбор элементов
- Вымышленный элемент
- Классификация Гольдшмидта
- Остров стабильности
- Список химических элементов
- Список нуклидов
- Список плотностей элементов
- Минеральное (питательное)
- Периодические системы малых молекул
- Цены на химические элементы
- Имя систематического элемента
- Таблица нуклидов
- Хронология открытий химических элементов
- Тайна материи: поиск элементов (фильм PBS)
Рекомендации
- ^ ИЮПАК , Сборник химической терминологии , 2-е изд. («Золотая книга») (1997). Исправленная онлайн-версия: (2006–) « химический элемент ». ‹См. Tfd› doi : 10.1351 / goldbook.C01022 ‹См. Tfd›
- ↑ См. Хронологию на стр. 10 в Оганесян Ю. Ц .; Утёнков, В .; Лобанов Ю.А. Абдуллин, Ф .; Поляков, А .; Sagaidak, R .; Широковский, И .; Цыганов Ю.А. и другие. (2006). «Доказательства темной материи» (PDF) . Physical Review C . 74 (4): 044602. Bibcode : 2006PhRvC..74d4602O . DOI : 10.1103 / PhysRevC.74.044602 .
- ^ lbl.gov (2005). «Вселенское приключение водорода и гелия» . Национальная лаборатория Лоуренса Беркли Министерство энергетики США . Архивировано из оригинального 21 сентября 2013 года .
- ^ Astro.soton.ac.uk (3 января 2001). «Формирование световых элементов» . Саутгемптонский университет . Архивировано из оригинального 21 сентября 2013 года .
- ^ foothill.edu (18 октября 2006 г.). «Как звезды производят энергию и новые элементы» (PDF) . Предгорный колледж .
- ^ a b Дюме, Б. (23 апреля 2003 г.). «Висмут побил рекорд периода полураспада для альфа-распада» . Physicsworld.com . Бристоль, Англия: Институт физики . Проверено 14 июля 2015 года .
- ^ a b de Marcillac, P .; Coron, N .; Dambier, G .; Leblanc, J .; Моалич, JP (2003). «Экспериментальное обнаружение альфа-частиц от радиоактивного распада природного висмута». Природа . 422 (6934): 876–8. Bibcode : 2003Natur.422..876D . DOI : 10,1038 / природа01541 . PMID 12712201 . S2CID 4415582 .
- ^ Сандерсон, К. (17 октября 2006 г.). «Изготовлен самый тяжелый элемент - снова» . Новости @ природа . DOI : 10.1038 / news061016-4 . S2CID 121148847 .
- ^ a b Schewe, P .; Стейн, Б. (17 октября 2000 г.). «Обнаружены элементы 116 и 118» . Новости физики . Американский институт физики . Архивировано из оригинала на 1 января 2012 года . Проверено 19 октября 2006 года .
- ^ Гланц, J. (6 апреля 2010). «Ученые открывают новый тяжелый элемент» . Нью-Йорк Таймс .
- ^ Оганесян, Ю. Ц .; Абдуллин, Ф. Ш .; Бейли, Полицейский; Benker, DE; Беннетт, Мэн; Дмитриев С.Н.; Ezold, JG; Гамильтон, JH; Хендерсон, РА; Иткис, MG; Лобанов, Ю. V .; Мезенцев, АН; Moody, KJ; Нельсон, SL; Поляков, АН; Портер, CE; Рамайя, AV; Райли, ФО; Роберто, JB; Рябинин, М.А. Рыкачевский, КП; Сагайдак, РН; Шонесси, DA; Широковский, И.В. Стойер, Массачусетс; Субботин В.Г .; Sudowe, R .; Сухов, AM; Цыганов, Ю. S .; и другие. (Апрель 2010 г.). «Синтез нового элемента с атомным номером Z = 117». Письма с физическим обзором . 104 (14): 142502. Bibcode : 2010PhRvL.104n2502O . DOI : 10.1103 / PhysRevLett.104.142502 .PMID 20481935 .
- ^ Агентство по охране окружающей среды США . «Технеций-99» . epa.gov . Проверено 26 февраля 2013 года .
- ^ Гарвард-Смитсоновский центр астрофизики . «Истоки тяжелых стихий» . cfa.harvard.edu . Проверено 26 февраля 2013 года .
- ^ «Атомный номер и массовые числа» . ndt-ed.org. Архивировано из оригинального 12 февраля 2014 года . Проверено 17 февраля 2013 года .
- ^ periodical.lanl.gov. «Периодическая таблица элементов: LANL Carbon» . Лос-Аламосская национальная лаборатория .
- ^ Кацуя Ямада. «Атомная масса, изотопы и массовое число» (PDF) . Лос-Анджелесский колледж Пирса . Архивировано из оригинального (PDF) 11 января 2014 года.
- ^ "Чистый элемент" . Европейское ядерное общество . Архивировано из оригинального 13 июня 2017 года . Проверено 13 августа 2013 года .
- ^ Audi, G .; Кондев Ф.Г .; Wang, M .; Хуанг, WJ; Наими, С. (2017). «Оценка ядерных свойств NUBASE2016» (PDF) . Китайская физика C . 41 (3): 030001. Bibcode : 2017ChPhC..41c0001A . DOI : 10.1088 / 1674-1137 / 41/3/030001 .
- ^ Meija, Juris; и другие. (2016). «Атомный вес элементов 2013 (Технический отчет IUPAC)» . Чистая и прикладная химия . 88 (3): 265–91. DOI : 10,1515 / пак-2015-0305 .
- ^ Meija, Juris; и другие. (2016). «Атомный вес элементов 2013 (Технический отчет IUPAC)» . Чистая и прикладная химия . 88 (3). Таблицы 2, 3 вместе взятые; неуверенность устранена. DOI : 10,1515 / пак-2015-0305 .
- Перейти ↑ Wilford, JN (14 января 1992 г.). «Наблюдения Хаббла приносят некоторые сюрпризы» . Нью-Йорк Таймс .
- Перейти ↑ Wright, EL (12 сентября 2004 г.). «Нуклеосинтез Большого взрыва» . UCLA , Отдел астрономии . Проверено 22 февраля 2007 года .
- ^ Валлерстайн, Джордж; Ибен, Ико; Паркер, Питер; Boesgaard, Ann; Хейл, Джеральд; Шампанское, Артур; Барнс, Чарльз; Каппелер, Франц; и другие. (1999). «Синтез элементов в звездах: сорок лет прогресса» (PDF) . Обзоры современной физики . 69 (4): 995–1084. Bibcode : 1997RvMP ... 69..995W . DOI : 10.1103 / RevModPhys.69.995 . hdl : 2152/61093 . Архивировано из оригинального (PDF) 28 сентября 2006 года.
- ^ Earnshaw, A .; Гринвуд, Н. (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн .
- ^ Croswell, К. (1996). Алхимия Небес . Якорь. ISBN 978-0-385-47214-2.
- ^
- Ультра-следовые минералы. Авторы: Нильсен, Форрест Х. USDA, ARS Источник: Современное питание в здоровье и болезнях / редакторы, Морис Э. Шилс ... и др. Балтимор: Williams & Wilkins, c1999, стр. 283-303. Дата выпуска: 1999 URI: [1]
- ^ Daumann Лена J. (25 апреля 2019). «Важное и повсеместное: появление металлобиохимии лантанидов» . Angewandte Chemie International Edition . DOI : 10.1002 / anie.201904090 . Проверено 15 июня 2019 .
- ^ Платон (2008) [c. 360 г. до н.э.]. Тимей . Забытые книги. п. 45. ISBN 978-1-60620-018-6.
- ^ Хиллар, М. (2004). «Проблема души в« Де аниме »Аристотеля» . НАСА / WMAP . Архивировано из оригинала 9 сентября 2006 года . Проверено 10 августа 2006 года .
- ^ Партингтон, JR (1937). Краткая история химии . Нью-Йорк: Dover Publications . ISBN 978-0-486-65977-0.
- ^ а б Бойл Р. (1661). Скептический химик . Лондон. ISBN 978-0-922802-90-6.
- ^ Лавуазье, AL (1790). Элементы химии переведены Робертом Керром . Эдинбург. С. 175–6. ISBN 978-0-415-17914-0.
- ^ Трансактинид-2 . www.kernchemie.de
- ^ Кэри, GW (1914). Химия человеческой жизни . Лос-Анджелес. ISBN 978-0-7661-2840-8.
- ^ «ИЮПАК объявляет о начале процесса утверждения названия для элемента с атомным номером 112» (PDF) . ИЮПАК . 20 июля 2009 . Проверено 27 августа 2009 года .
- ^ «IUPAC (Международный союз чистой и прикладной химии): элемент 112 назван Copernicium» . ИЮПАК . 20 февраля 2010 года Архивировано из оригинала 24 февраля 2010 года.
- ^ Оганесян, Ю. Ц .; Утёнков, В .; Лобанов Ю.А. Абдуллин, Ф .; Поляков, А .; Sagaidak, R .; Широковский, И .; Цыганов Ю.А. и другие. (2006). «Доказательства темной материи» (PDF) . Physical Review C . 74 (4): 044602. Bibcode : 2006PhRvC..74d4602O . DOI : 10.1103 / PhysRevC.74.044602 .
- ^ Greiner, W. "Рекомендации" (PDF) . 31-е заседание ПКК по ядерной физике . Объединенный институт ядерных исследований . Архивировано из оригинального (PDF) 14 апреля 2010 года.
- ^ Персонал (30 ноября 2016 г.). «ИЮПАК объявляет названия элементов 113, 115, 117 и 118» . ИЮПАК . Проверено 1 декабря +2016 .
- ↑ Сент-Флер, Николас (1 декабря 2016 г.). «Четыре новых имени официально добавлены в Периодическую таблицу элементов» . Нью-Йорк Таймс . Проверено 1 декабря +2016 .
- ^ "Периодическая таблица - Королевское химическое общество" . www.rsc.org .
- ^ "Интернет-словарь этимологии" . etymonline.com .
- ^ Визер, Майкл Э .; и другие. (2013). «Атомный вес элементов 2011 (Технический отчет IUPAC)» . Чистая и прикладная химия . 85 (5): 1047–1078. DOI : 10.1351 / PAC-REP-13-03-02 . (для стандартных атомных весов элементов)
- ^ Sonzogni, Алехандро. «Интерактивная карта нуклидов» . Национальный центр ядерных данных: Брукхейвенская национальная лаборатория . Проверено 6 июня 2008 года . (для атомных масс элементов с атомными номерами 103–118)
- ^ Holman, SW; Лоуренс, Р.Р .; Барр, Л. (1 января 1895 г.). «Точки плавления алюминия, серебра, золота, меди и платины». Труды Американской академии искусств и наук . 31 : 218–233. DOI : 10.2307 / 20020628 . JSTOR 20020628 .
- ^ ван дер Крогт, Питер. «Вольфрам Вольфрам Вольфрам» . Элементимология и элементы Multidict. Архивировано из оригинала 23 января 2010 года . Проверено 11 марта 2010 года .
- ^ Первоначально оценено Полингом как 0,7, но никогда не пересматривалось после того, как электроотрицательность других элементов была обновлена для обеспечения точности. Предполагается, что он будет выше, чем у цезия.
- ^ Рассчитано на основе атомного веса и атомного объема. По данным Зигфрида С. Хеккера (2000), элементарная ячейка, содержащая 16 атомов, имеет объем 319,96 кубических Å . «Плутоний и его сплавы: от атомов к микроструктуре» (PDF) . Лос-Аламосская наука . 26 : 331. . Это дает для 239 Pu плотность (1,66053906660 × 10 −24 г / дальтон × 239,0521634 дальтон / атом × 16 атомов / элементарную ячейку) / (319,96 Å 3 / элементарная ячейка × 10 −24 см 3 / Å 3 ) или 19,85 г / cc.
дальнейшее чтение
| Викискладе есть медиафайлы по теме химических элементов . |
- Болл, П. (2004). Элементы: очень краткое введение . Издательство Оксфордского университета . ISBN 978-0-19-284099-8.
- Эмсли, Дж. (2003). Природа Строительные блоки: A-Z Руководство по элементам . Издательство Оксфордского университета . ISBN 978-0-19-850340-8.
- Грей, Т. (2009). Элементы: визуальное исследование каждого известного атома во Вселенной . ISBN Black Dog & Leventhal Publishers Inc. 978-1-57912-814-2.
- Шерри, ER (2007). Периодическая таблица, ее история и ее значение . Издательство Оксфордского университета .
- Стрэтерн, П. (2000). Сон Менделеева: В поисках стихий . Хэмиш Гамильтон Ltd . ISBN 978-0-241-14065-9.
- Кин, Сэм (2011). Исчезающая ложка: и другие правдивые сказки о безумии, любви и истории мира из Периодической таблицы элементов . Книги Бэк-Бэй.
- Составлено AD McNaught и A. Wilkinson. (1997). Научные публикации Блэквелла, Оксфорд (ред.). Сборник химической терминологии, 2-е изд. («Золотая книга») . DOI : 10.1351 / goldbook . ISBN 978-0-9678550-9-7.CS1 maint: использует параметр авторов ( ссылка )
- Он-лайн исправленная версия XML: создана М. Ником, Дж. Джиратом, Б. Косатой; обновления составлены А. Дженкинсом.
Внешние ссылки
- Видео по каждому элементу от Ноттингемского университета
- «Химические элементы» , в наше время , обсуждение BBC Radio 4 с Полом Стрэтерном, Мэри Арчер и Джоном Мюрреллом (25 мая 2000 г.).