Дендротоксины - это класс пресинаптических нейротоксинов, продуцируемых змеями мамба ( Dendroaspis ), которые блокируют определенные подтипы потенциалзависимых калиевых каналов в нейронах , тем самым увеличивая высвобождение ацетилхолина в нервно-мышечных соединениях . Из-за их высокой эффективности и избирательности в отношении калиевых каналов дендротоксины оказались чрезвычайно полезными в качестве фармакологических инструментов для изучения структуры и функции этих белков ионных каналов .
Функциональные эффекты в нервной системе [ править ]
Было показано, что дендротоксины блокируют определенные подтипы потенциал-управляемых калиевых (K + ) каналов в нейрональной ткани. [ цитата необходима ] В нервной системе управляемые напряжением K + каналы контролируют возбудимость нервов и мышц, контролируя мембранный потенциал покоя и реполяризуя мембрану во время потенциалов действия . Дендротоксин был показан , чтобы связать узлы Ранвия из двигательных нейронов [1]и блокировать активность этих калиевых каналов. Таким образом, дендротоксины увеличивают продолжительность потенциалов действия и увеличивают высвобождение ацетилхолина в нервно-мышечном соединении, что может приводить к повышенной возбудимости мышц и судорожным симптомам.
Структура дендротоксина [ править ]
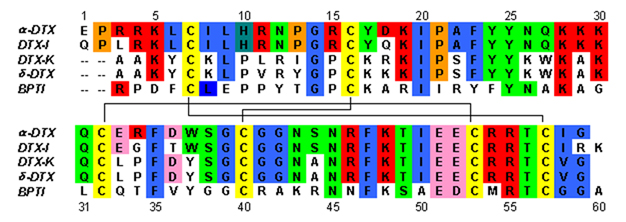
Дендротоксины представляют собой белки массой ~ 7 кДа, состоящие из одной пептидной цепи, состоящей примерно из 57-60 аминокислот . Было выделено несколько гомологов альфа-дендротоксина, все из которых имеют несколько иную последовательность. Однако молекулярная архитектура и складчатая конформация этих белков очень похожи. Дендротоксин обладает очень коротким 3 10 - спирали вблизи N-конца пептида, в то время как два поворота альфа-спираль происходит вблизи С-конец . Двухцепочечный антипараллельный β-лист занимает центральную часть молекулярной структуры. Эти две β-тяжи соединены искаженной областью β-витков [2]это считается важным для связывающей активности белка. Все дендротоксины поперечно сшиты тремя дисульфидными мостиками , которые повышают стабильность белка и вносят большой вклад в его структурную конформацию. В цистеиновых остатках , образующие эти дисульфидные связи были консервативными среди всех членов семьи дендротоксина, и расположены в C7-C57, C16-C40, и C32-C53 (нумерация в соответствии с альфа-дендротоксином).
Дендротоксины структурно гомологичны ингибиторам сериновой протеазы типа Кунитца , включая ингибитор трипсина поджелудочной железы крупного рогатого скота (BPTI). Было показано, что альфа-дендротоксин и BPTI имеют 35% идентичность последовательностей, а также идентичные дисульфидные связи. Несмотря на структурную гомологию между этими двумя белками, дендротоксины, по-видимому, не проявляют какой-либо измеримой ингибирующей протеазной активности, такой как BPTI. Эта потеря активности, по-видимому, является результатом отсутствия ключевых аминокислотных остатков, которые вызывают структурные различия, которые препятствуют ключевым взаимодействиям, необходимым для протеазной активности, наблюдаемой в BPTI.
Дендротоксины - это основные белки, которые обладают чистым положительным зарядом при нейтральном pH . Большинство положительно заряженных аминокислотных остатков дендротоксинов расположены в нижней части структуры, создавая катионный домен на одной стороне белка. Положительный заряд возникает в результате остатков лизина (Lys) и аргинина (Arg), которые сосредоточены в трех основных областях белка: около N-конца (Arg3, Arg4, Lys5), около C-конца (Arg54, Arg55) и на узкая область β-разворота (Lys28, Lys29, Lys30). [3] Считается, что эти положительно заряженные остатки могут играть решающую роль в связывающей активности дендротоксина, поскольку они могут осуществлять потенциальные взаимодействия с анионными сайтами (отрицательно заряженными аминокислотами) в порах калиевых каналов.
Биологическая активность [ править ]
Фармакология [ править ]
Одиночная молекула дендротоксина обратимо связывается с калиевым каналом, чтобы оказывать его ингибирующее действие. Предполагается, что это взаимодействие опосредуется электростатическими взаимодействиями между положительно заряженными аминокислотными остатками в катионном домене дендротоксина и отрицательно заряженными остатками в поре ионного канала . Считается, что калиевые каналы, как и другие катион-селективные каналы, имеют облако отрицательных зарядов, которые предшествуют открытию поры канала, которая помогает проводить ионы калия по пути проникновения. Обычно считается (хотя и не доказано), что молекулы дендротоксина связываются с анионнымиучастки рядом с внеклеточной поверхностью канала и физически закрывают поры, тем самым предотвращая ионную проводимость. Однако Имреди и Маккиннон [4] предположили, что дельта-дендротоксин может иметь нецентральный сайт связывания на их белках-мишенях и может ингибировать канал, изменяя структуру канала, а не физически блокируя поры.
Биологически важные остатки [ править ]
Многие исследования пытались определить, какие аминокислотные остатки важны для активности связывания дендротоксинов с их мишенями для калиевых каналов. Харви и др. [5] использовали специфичные для остатков модификации для идентификации положительно заряженных остатков, которые имеют решающее значение для блокирующей активности дендротоксина-I. Они сообщили, что ацетилирование Lys5 вблизи N-концевой области и Lys29 в области бета-поворота привело к существенному снижению аффинности связывания DTX-I. Аналогичные результаты были показаны с дендротоксином-K с использованием сайт-направленного мутагенеза для замены положительно заряженных остатков лизина и аргинина на нейтральные аланины.. Эти результаты, наряду со многими другими, указывают на то, что положительно заряженные лизины в N-концевой половине, особенно Lys5 в 3 10 -спирали, играют очень важную роль в связывании дендротоксинов с их мишенями калиевых каналов. Остатки лизина в области β-поворота дали более противоречивые результаты, оказавшись биологически важными для одних гомологов дендротоксина и не обязательными для других. Кроме того, мутация всего триплета лизина (K28-K29-K30) в Ala-Ala-Gly в альфа-DTX привела к очень небольшому изменению биологической активности.
Существует общее согласие с тем, что консервативный остаток лизина около N-конца (Lys5 в альфа-DTX) имеет решающее значение для биологической активности всех дендротоксинов, в то время как дополнительные остатки, например, в области бета-поворота, могут играть роль в специфичности дендротоксина, опосредуя взаимодействия отдельных токсинов с их индивидуальными целевыми сайтами. Это не только помогает объяснить строгую специфичность некоторых дендротоксинов для различных подтипов потенциал-управляемых K + -каналов , но также объясняет различия в эффективности дендротоксинов для общих K + -каналов . Например, Wang et al. [6] показали, что взаимодействие дендротоксина-К с K V1.1 опосредуется остатками лизина как на N-конце, так и в области β-поворота, тогда как альфа-дендротоксин, по-видимому, взаимодействует со своей мишенью только через N-конец. Этот менее обширный интерактивный домен может помочь объяснить, почему альфа-дендротоксин менее различим, в то время как дендротоксин-K строго селективен для K V 1.1.
Использование в исследованиях [ править ]
Калиевые каналы нейронов позвоночных демонстрируют высокую степень разнообразия, что позволяет нейронам точно настраивать свои электрические сигнальные свойства путем экспрессии различных комбинаций субъединиц калиевых каналов. Кроме того, поскольку они регулируют поток ионов через биологические мембраны, они важны во многих аспектах клеточной регуляции и передачи сигналов различных типов клеток. Таким образом, потенциалзависимые калиевые каналы являются мишенями для широкого спектра мощных биологических токсинов от таких организмов, как змеи, скорпионы , морские анемоны и шишки . Таким образом, очищение ядапривело к выделению пептидных токсинов, таких как дендротоксины, которые стали полезными фармакологическими инструментами для изучения калиевых каналов. Из-за их эффективности и селективности в отношении различных подтипов калиевых каналов дендротоксины стали полезными в качестве молекулярных зондов для структурного и функционального исследования этих белков. Это может помочь улучшить наше понимание роли, которую играют отдельные типы каналов, а также помочь в фармакологической классификации этих различных типов каналов. [7] Кроме того, наличие радиоактивно меченных дендротоксинов обеспечивает инструмент для скрининга других источников в поисках новых токсинов калиевых каналов, таких как класс каликлюдина токсинов калиевых каналов у морских анемонов. Наконец, структурная информация, предоставляемая дендротоксинами, может дать ключ к разгадке синтеза терапевтических соединений, которые могут воздействовать на определенные классы калиевых каналов. Дендротоксин I также использовался, чтобы помочь очистить и охарактеризовать белок K + канала, с которым он связывается, с помощью различных методов анализа связывания и хроматографии. [8]
Ссылки [ править ]
- ^ Gasparini S, Danse JM, Licoq A, S Pinkasfeld, Зинн-Justin S, Young LC, CLде Медейрус C, Роуэн EG, Харви AL и Me'nez A (1998). Определение функционального сайта альфа-дендротоксина: функциональная топография дендротоксинов отличается, но имеет консервативное ядро с таковыми у другихтоксинов, блокирующих калиевые каналыK V 1. Журнал биологической химии 273: 25393-25403
- ^ Като Е, Нисио Н, Инуи Т, Nishiuchi У, Т Кимура, Сакакибара S, Ямазаки Т (2000). Структурная основа биологической активности дендротоксина-I, мощного блокатора калиевых каналов. Биополимеры 54: 44-57
- ^ Сваминатана Р, Харихаран М, Мурали Р, Синг CU (1996). Молекулярная структура, конформационный анализ и изучение структуры-активности дендротоксина и его гомологов с использованием методов молекулярной механики и молекулярной динамики. Журнал медицинской химии . 39: 2141-2155
- ^ Imredy ДП, и МакКиннон R (2000). Энергетические и структурные взаимодействия между дельта-дендротоксином и калиевым каналом, управляемым напряжением. Журнал молекулярной биологии 296: 1283-1294
- ^ Харви А.Л., Роуэн Е.Г., Vatanpour Н, Энгстр А, Вестерлунд В, Karlsson Е (1997). Изменения биологической активности после ацетилирования дендротоксина I из Dendroaspis polylepis (черная мамба). ' 35: 1263-1273
- ↑ Wang FC, Bell N, Reid P, Smith LA, McIntosh P, Robertson B и Dolly JO (1999). Идентификация остатков в дендротоксине Kответственных за ее дискриминацию между нейронными К + каналамсодержащим К V 1.1 и 1.2 альфасубъединицы. Европейский журнал биохимии 263: 222-229
- ↑ Ёсида С. и Мацумото С. (2005). Влияние альфа-дендротоксина натокиK + и потенциалы действия в нейронах тройничного ганглия взрослых крыс, устойчивых к тетродотоксину. Журнал фармакологии и экспериментальной терапии 314: 437-445
- ^ Рем, H .; Лаздунский, М. (1988-07-01). «Очистка и субъединичная структура предполагаемого белка K + -канала, идентифицированного по его связывающим свойствам для дендротоксина I.» Труды Национальной академии наук . 85 (13): 4919–4923. DOI : 10.1073 / pnas.85.13.4919 . ISSN 0027-8424 . PMC 80549 . PMID 2455300 .
Внешние ссылки [ править ]
- дендротоксин в Национальной медицинской библиотеке США по медицинским предметным рубрикам (MeSH)