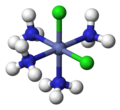
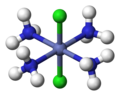
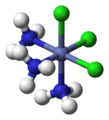
| Октаэдрическая молекулярная геометрия | |
|---|---|
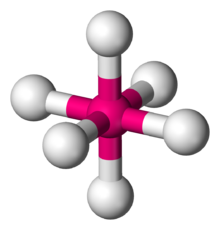 | |
| Примеры | SF 6 , Mo (CO) 6 |
| Группа точек | О ч |
| Координационный номер | 6 |
| Угол крепления | 90 ° |
| μ (полярность) | 0 |
В химии , октаэдрической молекулярная геометрия описывает форму соединений с шестью атомами или группами атомов или лигандов симметрично расположенных вокруг центрального атома, определяя вершинах октаэдра . Октаэдр имеет восемь граней, отсюда и приставка octa . Октаэдр является одним из Платоновых тел , хотя октаэдрические молекулы обычно имеют атом в центре и не имеют связей между атомами лиганда. Совершенный октаэдр принадлежит точечной группе O h . Примерами октаэдрических соединений являются гексафторид серы SF 6 и гексакарбонил молибдена.Мо (CO) 6 . Термин «октаэдрический» используется химиками несколько вольно, акцентируя внимание на геометрии связей с центральным атомом и не принимая во внимание различия между самими лигандами. Например, [Co (NH 3 ) 6 ] 3+ , который не является октаэдрическим в математическом смысле из-за ориентации связей NH, называется октаэдрическим. [1]
Концепция октаэдрической координационной геометрии была разработана Альфредом Вернером для объяснения стехиометрии и изомерии координационных соединений . Его проницательность позволила химикам рационализировать количество изомеров координационных соединений. Октаэдрические комплексы переходных металлов, содержащие амины и простые анионы, часто называют комплексами типа Вернера .

Изомерия в октаэдрических комплексах [ править ]
Когда два или более типов лигандов (L a , L b , ...) координированы с октаэдрическим металлическим центром (M), комплекс может существовать в виде изомеров. Система наименования этих изомеров зависит от количества и расположения различных лигандов.
цис и транс [ править ]
Для MLа
4Lб
2, существует два изомера. Эти изомеры MLа
4Lб
2являются цис , если лиганды L b взаимно смежны, и транс , если группы L b расположены на 180 ° друг к другу. Именно анализ таких комплексов привел Альфреда Вернера к получившему Нобелевскую премию 1913 г. постулату октаэдрических комплексов.
Лицевые и меридиональные изомеры [ править ]
Для MLа
3Lб
3возможны два изомера - лицевой изомер ( fac ), в котором каждый набор из трех идентичных лигандов занимает одну грань октаэдра, окружающего атом металла, так что любые два из этих трех лигандов являются взаимно цис-цис, и меридиональный изомер ( mer ) в котором каждый набор из трех идентичных лигандов занимает плоскость, проходящую через атом металла.
Хиральность [ править ]
Более сложные комплексы с несколькими различными типами лигандов или с бидентатными лигандами также могут быть хиральными , с парами изомеров, которые не могут накладываться друг на друга зеркальными изображениями или энантиомерами друг друга.
Λ - [Fe (ox) 3 ] 3− Δ - [Fe (ox) 3 ] 3– Λ - цис - [CoCl 2 (en) 2 ] + Δ - цис - [CoCl 2 (en) 2 ] +
Другое [ править ]
Для MLа
2Lб
2Lc
2, всего возможно шесть изомеров. [2]
- Один изомер, в котором все три пары идентичных лигандов являются транс
- Три различных изомеров , в которых одна пара идентичных лигандов (L через или L б или L гр ) является транс , а два других являются цис .
- Два энантиомерных хиральных изомера, в которых все три пары идентичных лигандов являются цис .
Число возможных изомеров может достигать 30 для октаэдрического комплекса с шестью различными лигандами (напротив, для тетраэдрического комплекса с четырьмя разными лигандами возможны только два стереоизомера). В следующей таблице перечислены все возможные комбинации монодентатных лигандов:
| Формула | Количество изомеров | Количество энантиомерных пар |
|---|---|---|
| ML 6 | 1 | 0 |
| MLа 5L b | 1 | 0 |
| MLа 4Lб 2 | 2 | 0 |
| MLа 4L b L c | 2 | 0 |
| MLа 3Lб 3 | 2 | 0 |
| MLа 3Lб 2L c | 3 | 0 |
| MLа 3Л б Л в Л г | 5 | 1 |
| MLа 2Lб 2Lc 2 | 6 | 1 |
| MLа 2Lб 2L c L d | 8 | 2 |
| MLа 2Л б Л в Л д Л е | 15 | 6 |
| ML a L b L c L d L e L f | 30 | 15 |
Таким образом, все 15 диастереомеров ML a L b L c L d L e L f являются хиральными, тогда как для MLа
2L b L c L d L e , шесть диастереомеров являются хиральными, а три - нет (те, у которых L a являются транс ). Можно видеть, что октаэдрическая координация допускает гораздо большую сложность, чем тетраэдр, который доминирует в органической химии . Тетраэдр ML a L b L c L d существует в виде единой энатиомерной пары. Для образования двух диастереомеров в органическом соединении необходимы по крайней мере два углеродных центра.
Отклонения от идеальной симметрии [ править ]
Эффект Яна – Теллера [ править ]
Термин может также относиться к октаэдру, на который влияет эффект Яна-Теллера , который является обычным явлением, встречающимся в координационной химии . Это снижает симметрию молекулы с O h до D 4h и известно как тетрагональное искажение.
Искаженная октаэдрическая геометрия [ править ]
Некоторые молекулы, такие как XeF 6 или IF-
6, имеют неподеленную пару, которая искажает симметрию молекулы с O h на C 3v . [3] [4] Конкретная геометрия известна как октаэдр с одной вершиной , поскольку она образована от октаэдра путем размещения неподеленной пары над центром одной треугольной грани октаэдра в качестве «колпачка» (и смещения положения вершины октаэдра). другие шесть атомов для его размещения). [5] Оба они представляют собой отклонение от геометрии, предсказанной VSEPR, который для AX 6 E 1 предсказывает пятиугольную пирамидальную форму.
Биоктаэдрические структуры [ править ]
Пары октаэдров могут быть слиты таким образом, чтобы сохранить октаэдрическую координационную геометрию, путем замены концевых лигандов мостиковыми лигандами . Распространены два мотива для слияния октаэдров: разделение ребер и разделение граней. Биоктаэдры с общими ребрами и гранями имеют формулы [M 2 L 8 (μ-L)] 2 и M 2 L 6 (μ-L) 3 соответственно. Полимерные версии одного и того же образца связывания дают стехиометрии [ML 2 (μ-L) 2 ] ∞ и [M (μ-L) 3 ] ∞ соответственно.
Совместное использование ребра или грани октаэдра дает структуру, называемую биоктаэдром. Многие металл пента галогенида и пент алкоксидов соединений существует в растворе и твердое вещество с bioctahedral структур. Одним из примеров является пентахлорид ниобия . Тетрагалогениды металлов часто существуют в виде полимеров с октаэдрами с общими ребрами. Примером может служить тетрахлорид циркония . [6] Соединения с октаэдрическими цепями с разделенными гранями включают MoBr 3 , RuBr 3 и TlBr 3 .
Бал-и-палки модели из пентахлорида ниобия , в bioctahedral координационного соединения.
Шарообразная модель тетрахлорида циркония , неорганического полимера, основанного на октаэдрах с разделенными ребрами.
Шаровидная модель бромида молибдена (III) , неорганического полимера на основе октаэдров с разделенными гранями.
Посмотрите почти вниз на цепочку иодида титана (III), высветив затенение галогенидных лигандов в таких октаэдрах с общими гранями.
Тригональная призматическая геометрия [ править ]
Для соединений с формулой MX 6 основной альтернативой октаэдрической геометрии является тригонально-призматическая геометрия, которая имеет симметрию D 3h . В этой геометрии шесть лигандов также эквивалентны. Есть также искаженные тригональные призмы с симметрией C 3v ; ярким примером является W (CH 3 ) 6 . Взаимопревращения А - и Λ -комплексов, которая, как правило , медленно, предлагается перейти через тригональной призматической промежуточный, процесс называется « Байлар поворот ». Альтернативный путь рацемизации тех же комплексов - поворот Рея-Датта .
Расщепление энергии d-орбиталей в октаэдрических комплексах [ править ]
Для свободного иона, например газообразного Ni 2+ или Mo 0 , энергии d-орбиталей равны по энергии; то есть они «выродившиеся». В октаэдрическом комплексе это вырождение снимается. Энергия d z 2 и d x 2 - y 2 , так называемый набор e g , которые направлены непосредственно на лиганды, дестабилизируются. С другой стороны, энергия орбиталей d xz , d xy и d yz , так называемого набора t 2g , стабилизируется. Метки t 2g и e g относятся к неприводимым представлениям, которые описывают свойства симметрии этих орбиталей. Энергетическая щель, разделяющая эти два набора, является основой теории кристаллического поля и более полной теории поля лигандов . Утрата вырожденности при образовании октаэдрического комплекса из свободного иона называется расщеплением кристаллического поля или расщеплением поля лиганда . Запрещенная зона обозначена буквой Δ o , которая варьируется в зависимости от количества и природы лигандов. Если симметрия комплекса ниже октаэдрической, уровни e g и t 2g могут расщепляться дальше. Например, наборы t 2g и e g далее разделяются на транс-MLа
4Lб
2.
Для этих доноров электронов сила лиганда имеет следующий порядок:
- слабый: йод < бром < фтор < ацетат < оксалат < вода < пиридин < цианид : сильный
Так называемые «лиганды слабого поля» вызывают малую Δ o и поглощают свет с более длинными волнами .
Реакции [ править ]
Учитывая, что существует практически бесчисленное множество октаэдрических комплексов, неудивительно, что было описано большое разнообразие реакций. Эти реакции можно классифицировать следующим образом:
- Реакции замещения лиганда (через различные механизмы)
- Реакции присоединения лиганда, в том числе протонирование
- Редокс- реакции (когда электроны приобретаются или теряются)
- Перестройки, при которых относительная стереохимия лиганда изменяется в координационной сфере .
Многие реакции октаэдрических комплексов переходных металлов протекают в воде. Когда анионный лиганд заменяет координированную молекулу воды, реакция называется анатом . Обратная реакция, когда вода заменяет анионный лиганд, называется аквацией . Например, [CoCl (NH 3 ) 5 ] 2+ медленно акватируется с образованием [Co (NH 3 ) 5 (H 2 O)] 3+ в воде, особенно в присутствии кислоты или основания. Добавление концентрированной HCl превращает комплекс AQUO обратно в хлорид посредством процесса анионирования.
См. Также [ править ]
- Октаэдрические кластеры
- Метод AX
- Молекулярная геометрия
Ссылки [ править ]
- ^ Von Zelewsky, A. (1995). Стереохимия координационных соединений . Чичестер: Джон Вили. ISBN 0-471-95599-X.
- ^ Мисслер, GL; Тарр, Д.А. (1999). Неорганическая химия (2-е изд.). Прентис-Холл. п. 290. ISBN 0-13-841891-8.
- ^ Кроуфорд, Т. Дэниэл; Спрингер, Кристен В .; Шефер, Генри Ф. (1994). «Вклад в понимание структуры гексафторида ксенона». J. Chem. Phys. 102 (8): 3307–3311. Bibcode : 1995JChPh.102.3307C . DOI : 10.1063 / 1.468642 .
- ^ Mahjoub, Али R .; Сеппельт, Конрад (1991). «Структура ИФ-
6". Angewandte Chemie International Edition . 30 (3): 323–324. DOI : 10.1002 / anie.199103231 . - ^ Зима, Марк (2015). «ВСЭПР и более шести электронных пар» . Шеффилдский университет: химический факультет . Проверено 25 сентября 2018 года .
структура XeF
6
основана на искаженном октаэдре, вероятно, в сторону октаэдра с одной вершиной
- ^ Уэллс, AF (1984). Структурная неорганическая химия . Оксфорд: Clarendon Press. ISBN 0-19-855370-6.
Внешние ссылки [ править ]
- Chem | Химия, структуры и трехмерные молекулы [ постоянная мертвая ссылка ]
- Центр молекулярной структуры Университета Индианы
- Примеры точечной групповой симметрии