В этой статье отсутствует информация о других ненуклеотидных функциях . ( Февраль 2021 г. ) |
| Россманноподобная альфа / бета / альфа-сэндвич-складка | |
|---|---|
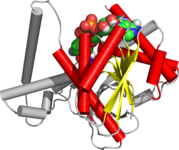
 НАД / НАДФ связываются с доменами россмановской складки. На рисунке изображен бета-альфа-фолдинг в алкогольдегидрогеназе. | |
| Идентификаторы | |
| Символ | Россманн-like_a / b / a_fold |
| Клан пфам | CL0039 |
| ИнтерПро | IPR014729 |
Укладка россман представляет собой третичная складку найдены в белках , которые связывают нуклеотиды , такие как ферментные кофакторы ФАД , НАД + и НАДФ + . Эта складка состоит из чередующихся бета-нитей и альфа-спиральных сегментов, где бета-нити связаны друг с другом водородными связями, образуя протяженный бета-лист, а альфа-спирали окружают обе стороны листа, образуя трехслойный сэндвич. Классическая складка Россманна содержит шесть бета-тяжей, тогда как складки, подобные Россманну, иногда называемые складками Россманноида., содержат всего пять нитей. Начальная бета-альфа-бета (bab) складка является наиболее консервативным сегментом складки Россмана. [1] Мотив назван в честь Майкла Россманна, который первым заметил этот структурный мотив в ферменте лактатдегидрогеназе в 1970 году, а позже заметил, что это часто встречающийся мотив в нуклеотидсвязывающих белках. [2]
Россманн и Россманноидные складчатые белки чрезвычайно распространены. Они составляют 20% белков с известной структурой в базе данных по белкам и обнаруживаются более чем в 38% метаболических путей KEGG . [3] Складка чрезвычайно универсальна, так как может вмещать широкий диапазон лигандов. Они могут функционировать как метаболические ферменты, связывающие ДНК / РНК и регуляторные белки в дополнение к традиционной роли. [4]
История [ править ]
Фолда Россманна была впервые описана доктором Майклом Россманном с сотрудниками в 1974 году. [5] Он был первым, кто установил структуру лактатдегидрогеназы и охарактеризовал структурный мотив внутри этого фермента, который позже будет назван складкой Россманна. Впоследствии было обнаружено, что большинство дегидрогеназ, которые используют НАД или НАДФ, содержат этот же структурно консервативный мотив складки Россмана. [5] [6]
В 1989 году Исраэль Ханукоглу из Научного института Вейцмана обнаружил, что консенсусная последовательность сайта связывания NADP + в некоторых ферментах, которые используют NADP +, отличается от мотива связывания NAD + . [7] Это открытие было использовано для изменения коферментной специфичности ферментов. [8]
Структура [ править ]
Складка Россмана состоит из шести параллельных бета-нитей, которые образуют протяженный бета-лист . Первые три нити соединены α-спиралями, в результате чего получается структура бета-альфа-бета-альфа-бета. Этот образец дублируется один раз, чтобы получить перевернутый тандемный повтор, содержащий шесть нитей. В целом жилы расположены в порядке 321456 (1 = N-концевой, 6 = C-концевой). [9] Пять скрученных нитей, подобных Россманну, расположены в порядке 32145. [10] Общая третичная структура складки напоминает трехслойный бутерброд, в котором начинка состоит из удлиненного бета-листа и формируются два ломтика хлеба. соединяющими параллельными альфа-спиралями. [1]
Одна из особенностей складки Россмана - ее специфичность связывания кофакторов . Путем анализа четырех НАДН-связывающих ферментов было обнаружено, что во всех четырех ферментах нуклеотидный кофактор имеет одинаковую конформацию и ориентацию по отношению к полипептидной цепи. [1]
Сгиб может содержать дополнительные нити, соединенные короткими спиралями или витками. [1] Наиболее консервативный сегмент складок Россмана - это первый бета-альфа-бета сегмент. Поскольку этот сегмент находится в контакте с частью АДФ динуклеотидов, таких как FAD , NAD и NADP, его также называют «ADP-связывающей бета-бета складкой».
Функция [ править ]
Функция укладки Россмана в ферментах заключается в связывании кофакторов нуклеотидов. Он также часто способствует связыванию субстрата.
Метаболические ферменты обычно выполняют одну специфическую функцию, а в случае UDP-глюкозо-6-дегидрогеназы основной функцией является катализирование двухстадийного NAD (+) -зависимого окисления UDP-глюкозы до UDP-глюкуроновой кислоты . [11] N- и C-концевые домены UgdG имеют общие структурные особенности с древними митохондриальными рибонуклеазами, названными MAR. MAR присутствуют в низших эукариотических микроорганизмах, имеют Россманноидную складку и принадлежат к надсемейству изохоризматаз. Это наблюдение подтверждает, что структурные мотивы Россмана, обнаруженные в NAD (+) - зависимых дегидрогеназах, могут выполнять двойную функцию, работая как домен связывания нуклеотидного кофактора и как рибонуклеаза.
Эволюция [ править ]
Россман и Россманноиды [ править ]
Эволюционная связь между складками Россмана и Россманн-подобными складками неясна. Эти складки получили название россманноидов. Была выдвинута гипотеза, что все эти складки, включая складку Россмана, произошли от единой общей предковой складки, которая помимо неспецифической каталитической активности обладала способностью связывания нуклеотидов. [5]
Однако анализ PDB обнаруживает свидетельства конвергентной эволюции [3] со 156 отдельными H-группами очевидной гомологии, из которых можно найти 123 X-группы вероятной гомологии. Группы интегрированы в ECOD . [4]
Обычная группа Россмана [ править ]
Филогенетический анализ NADP-связывающего фермента адренодоксинредуктазы показал, что от прокариот, через метазоа и до приматов отличие мотивов последовательности от большинства сайтов связывания FAD и NAD строго сохраняется. [12]
Во многих статьях и учебниках фолд Россмана определяется как строго повторяющаяся серия структуры βαβ. Тем не менее, всестороннее изучение складок Россмана во многих сайтах связывания NAD (P) и FAD показало, что строго консервативна только первая βα структура. В некоторых ферментах может быть много петель и несколько спиралей (т.е. не одна спираль) между бета-цепями, которые образуют бета-лист. [1] По словам Ханукоглу, эти ферменты имеют общее происхождение, на что указывают консервативная последовательность и структурные особенности. [12]
Результат Ханукоглу (2017) подтверждается Медведевым и др. (2020) в виде «H-группы» ECOD, называемой « связанной с Россманном ». Даже внутри этой группы ECOD описывает широкий спектр ненуклеотидных активностей. [4]
Ссылки [ править ]
- ^ а б в г д Ханукоглу I (2015). «Proteopedia: Rossmann fold: бета-альфа-бета складка на сайтах связывания динуклеотидов» . Биохимия и молекулярная биология образования . 43 (3): 206–9. DOI : 10.1002 / bmb.20849 . PMID 25704928 .
- Перейти ↑ Cox MM, Nelson DL (2013). Принципы биохимии Ленингера (6-е изд.). Нью-Йорк: WH Freeman. ISBN 978-1-4292-3414-6.
- ^ a b Медведев К.Е., Кинч Л.Н., Шеффер Р.Д., Гришин Н.В. (декабрь 2019 г.). «Функциональный анализ Россманн-подобных доменов показывает конвергентную эволюцию топологии и путей реакции» . PLoS вычислительная биология . 15 (12): e1007569. DOI : 10.1371 / journal.pcbi.1007569 . PMID 31869345 .
- ^ a b c Медведев, Кирилл Е .; Кинч, Лиза Н .; Дастин Шеффер, Р .; Пей, Чимин; Гришин, Ник В. (19 февраля 2021 г.). «Пятая часть белкового мира: Россманноподобные белки как эволюционно успешная структурная единица» . Журнал молекулярной биологии . п. 166788. дои : 10.1016 / j.jmb.2020.166788 .
Медведев К.Е., и др. «Россманн-фолд проект» . Гришин Лаб . Юго-Западный медицинский центр UT. - ^ а б в Кессель А (2010). Введение в белки: структура, функции и движение . Флорида: CRC Press. п. 143. ISBN 978-1-4398-1071-2.
- ↑ Rao ST, Rossmann MG (май 1973). «Сравнение супервторичных структур в белках». Журнал молекулярной биологии . 76 (2): 241–56. DOI : 10.1016 / 0022-2836 (73) 90388-4 . PMID 4737475 .
- ^ Hanukoglu I, Gutfinger T (март 1989). «Последовательность кДНК адренодоксинредуктазы. Идентификация сайтов связывания НАДФ в оксидоредуктазах» (PDF) . Европейский журнал биохимии . 180 (2): 479–84. DOI : 10.1111 / j.1432-1033.1989.tb14671.x . PMID 2924777 .
- ^ Scrutton NS, Berry A, Perham RN (январь 1990). «Перепроектирование коферментной специфичности дегидрогеназы с помощью белковой инженерии». Природа . 343 (6253): 38–43. DOI : 10.1038 / 343038a0 . PMID 2296288 .
- ^ "NAD (P) -связывающие Россманновские складки домены" . SCOP: Структурная классификация белков .
- ^ «Нуклеотид-связывающий домен» . SCOP: Структурная классификация белков .
- ^ Бхаттачариа М, Upadhyay R, S Vishveshwara (2012). «Сигнатуры взаимодействия, стабилизирующие NAD (P)-связывающую складку Россмана: структурно-сетевой подход» . PLOS ONE . 7 (12): e51676. DOI : 10.1371 / journal.pone.0051676 . PMC 3524241 . PMID 23284738 .
- ^ а б Ханукоглу I (2017). «Сохранение интерфейсов фермент-кофермент в FAD и NADP-связывающем адренодоксинредуктазе-А повсеместном ферменте». Журнал молекулярной эволюции . 85 (5): 205–218. DOI : 10.1007 / s00239-017-9821-9 . PMID 29177972 .
Внешние ссылки [ править ]
- Страница Proteopedia о складках Россманна