| Эпоксидирование по методу Sharpless | |
|---|---|
| Названный в честь | Карл Барри Шарплесс |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| Портал органической химии | резкое эпоксидирование |
| Идентификатор онтологии RSC | RXNO: 0000141 |
Реакция эпоксидирования Шарплесса представляет собой энантиоселективную химическую реакцию для получения 2,3-эпоксиспиртов из первичных и вторичных аллиловых спиртов . [1] [2]
Стереохимия полученного эпоксида определяется энантиомером хирального диэфира тартрата (обычно диэтилтартрата или диизопропилтартрата ), используемого в реакции. Окислитель - гидропероксид трет- бутила . Энантиоселективность достигается с помощью катализатора, образованного из тетра (изопропоксида) титана и диэтилтартрата. Только 5-10 мол% катализатора в присутствии фиг.3А молекулярных сит (3A MS) необходимо. [3]
Успех эпоксидирования Шарплесса можно объяснить пятью основными аспектами. Во-первых, эпоксиды можно легко превратить в диолы , аминоспирты и простые эфиры , поэтому образование хиральных эпоксидов важно в синтезе природных продуктов. Во-вторых, объем субстратов велик, включая множество первичных и вторичных аллиловых спиртов. В-третьих, продукты эпоксидирования Шарплесса часто имеют избыток энантиомеров выше 90%. В-четвертых, предсказуемы продукты эпоксидирования Шарплесса. Наконец, реагенты для эпоксидирования Шарплесса коммерчески доступны и относительно недороги. [4]
Опубликовано несколько обзоров. [5] [6] [7] [8]
К. Барри Шарплесс разделил 2001 Нобелевскую премию по химии за свою работу на асимметричных окислениях. Приз был разделен с Уильямом С. Ноулзом и Рёдзи Ноёри .
Структура катализатора [ править ]
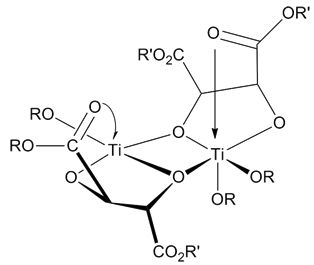
Структура катализатора неясна. Несмотря на это, все исследования пришли к выводу, что катализатор представляет собой димер [Ti (тартрат) (OR) 2 ]. Предполагаемый катализатор был определен с использованием рентгеноструктурных определений модельных комплексов, которые имеют необходимые структурные компоненты, чтобы катализировать эпоксидирование Шарплесса. [9]
Избирательность [ править ]
Хиральность продукта эпоксидирования Шарплесса иногда предсказывают с помощью следующей мнемоники . Прямоугольник нарисован вокруг двойной связи в той же плоскости, что и атомы углерода двойной связи ( плоскость xy ), с аллильным спиртом в правом нижнем углу и другими заместителями в соответствующих углах. В этой ориентации тартрат (-) сложного диэфира предпочтительно взаимодействует с верхней половиной молекулы, а тартрат (+) сложного диэфира предпочтительно взаимодействует с нижней половиной молекулы. Эта модель кажется верной, несмотря на замену олефина. Селективность уменьшается с увеличением R 1 , но увеличивается с увеличением R 2 и R 3 (см. Введение). [1]
Однако этот метод неверно предсказывает продукт аллильных 1,2-диолов. [10]
Кинетическое разрешение [ править ]
Эпоксидирование по Шарплесу также может дать кинетическое разрешение рацемической смеси вторичных 2,3-эпоксиспиртов. Хотя выход процесса кинетического разделения не может быть выше 50%, энантиомерный избыток в некоторых реакциях приближается к 100%. [11] [12]
Синтетическая утилита [ править ]
Эпоксидирование по Шарплесу возможно с широким спектром первичных и вторичных алкеновых спиртов. Кроме того, за исключением, отмеченным выше, данный диалкилтартрат предпочтительно будет присоединяться к одной и той же поверхности независимо от замещения алкена . [1] Чтобы продемонстрировать синтетическую полезность эпоксидирования Шарплесса, группа Шарплесса создала синтетические промежуточные соединения различных природных продуктов: метимицина, эритромицина , лейкотриена C-1 и (+) - диспарлюра. [13]
В качестве одной из немногих высокоэнантиоселективных реакций в свое время было разработано множество манипуляций с 2,3-эпокси-спиртами. [14]
Эпоксидирование Шарплесса использовалось для полного синтеза различных сахаридов , терпенов , лейкотриенов , феромонов и антибиотиков . [4]
Главный недостаток этого протокола - необходимость наличия аллилового спирта . Джекобсно эпоксидирование , альтернативный метод энантиоселективно окислить алкен, преодолевает эту проблему , и допускает более широкий спектр функциональных групп .
Предпосылки эпоксидирования аллиловых спиртов [ править ]
Ранние исследования показали, что аллиловые спирты придают лицевую селективность при использовании m-CPBA в качестве окислителя. При ацетилировании аллилового спирта эта селективность изменялась . Это открытие приводит к выводу, что водородная связь играет ключевую роль в селективности, и была предложена следующая модель. [15]
Для циклических аллиловых спиртов большая селективность наблюдается, когда спирт фиксируется в псевдоэкваториальном положении, а не в псевдоосевом положении. [16] Однако было обнаружено, что для систем с металлическими катализаторами, таких как системы на основе ванадия, скорость реакции увеличивалась, когда гидроксильная группа находилась в аксиальном положении, в 34 раза. Были показаны субстраты, которые были заблокированы в псевдоэкваториальном положении. подвергнуться окислению с образованием ен-она . В обеих случаях ванадия катализируемой эпоксидировании, то epoxidzed продукт показал превосходную селективность по отношению к син - диастереомеру . [17]
В отсутствие водородных связей стерические эффекты обеспечивают прямое добавление перекиси к противоположной поверхности. Однако перфтористые перкислоты все еще способны образовывать водородные связи с защищенными спиртами и обеспечивать нормальную селективность по отношению к водороду, присутствующему в перкислоте. [18]
Хотя присутствие аллилового спирта действительно приводит к повышенной стереоселективности, скорости этих реакций ниже, чем в системах без спиртов. Однако скорость реакции субстратов с водородной связующей группой все же выше, чем у эквивалентных защищенных субстратов. Это наблюдение объясняется балансом двух факторов. Первый - это стабилизация переходного состояния в результате образования водородных связей. Во-вторых, это электроноакцепторная природа кислорода, которая отводит электронную плотность от алкена, снижая его реакционную способность. [19]
Ациклические аллиловые спирты также обладают хорошей селективностью. В этих системах учитываются как штамм A 1,2 (стерические взаимодействия с винилом ), так и штамм A 1,3 . Было показано, что двугранный угол 120 лучше всего направляет подложки, водородные связи которых с направляющей группой. Эта геометрия позволяет правильно расположить перекись, а также обеспечить минимальное пожертвование от CC pi в сигма-звезду CO. [20]Это пожертвование снизит электронную плотность алкена и дезактивирует реакцию. Однако комплексы ванадия не образуют водородной связи со своими субстратами. Вместо этого они согласуются с алкоголем. Это означает, что двугранный угол, равный 40, обеспечивает идеальное положение орбитали перекиси сигма-звезды. [21]
В системах, которые связываются водородом, деформация A 1,3 играет большую роль, потому что требуемая геометрия вынуждает любые аллильные заместители иметь сильные взаимодействия A 1,3 , но позволяет избежать A 1,2 . Это приводит к син-добавлению полученного эпоксида. В случае ванадия требуемая геометрия приводит к сильным взаимодействиям A 1,2 , но позволяет избежать A 1,3 , что приводит к образованию эпоксида против направляющей группы. Было показано, что эпоксидирование, катализируемое ванадием, очень чувствительно к стерической массе винильной группы. [22] [23] [24]
Гомоаллильные спирты являются эффективными направляющими группами для эпоксидирования как в циклических, так и в ациклических системах для субстратов, которые демонстрируют водородные связи. Однако эти реакции обычно имеют более низкий уровень селективности. [25] [26]
В то время как субстраты, связывающие водородные связи, дают один и тот же тип селективности в аллильном и гомоаллильном случаях, противоположное верно для ванадиевых катализаторов.
Переходное состояние, предложенное Михелихом, показывает, что для этих реакций движущей силой селективности является минимизация деформации A 1,3 в структуре псевдокресла.
Предлагаемое переходное состояние показывает, что субстрат будет пытаться принять конформацию, которая минимизирует аллическую деформацию. Для этого наименее громоздкая группа R повернется, чтобы занять позицию R4. [27]
Хотя перкислоты и катализируемые металлами воздействия проявляют разную селективность в ациклических системах, они показывают относительно одинаковую селективность в циклических системах. Для циклических кольцевых систем, которые меньше семи или меньше или 10 или больше, наблюдаются аналогичные модели селективности. Однако было показано, что для колец среднего размера (восемь и девять) надкислотные окислители проявляют обратную селективность, в то время как реакции, катализируемые ванадием, продолжают показывать образование синэпоксида. [28]
Хотя ванадий является наименее химически активным металлическим катализатором эпоксидирования, он очень селективен в отношении алкенов с аллильными спиртами. Ранняя работа Шарплесса показывает, что он предпочитает реакцию алкенов с аллильными спиртами над более замещенными электронно-плотными алкенами. В этом случае ванадий показал обратную региоселективность как по отношению к m-CPBA, так и к более реакционноспособным формам молибдена. Хотя ванадий обычно менее реакционноспособен, чем комплексы других металлов, в присутствии аллиловых спиртов скорость реакции выше, чем у молибдена, наиболее реактивного металла для эпоксидирования. [29]
См. Также [ править ]
- Асимметричное каталитическое окисление
- Эпоксидирование Хулиа – Колонна
Ссылки [ править ]
- ^ a b c Кацуки, Т .; К. Барри Шарплесс (1980). «Первый практический метод асимметричного эпоксидирования». Варенье. Chem. Soc. 102 (18): 5974. DOI : 10.1021 / ja00538a077 .
- ^ Хилл, JG; Шарплесс, КБ; Exon, CM; Регенье, Р. (1985). «Энантиоселективное эпоксидирование аллиловых спиртов: (2s, 3s) -3-пропилоксиранметанол». Орг. Synth. 63 : 66. DOI : 10,15227 / orgsyn.063.0066 . CS1 maint: использует параметр авторов ( ссылка )
- ^ Gao, Y .; Hanson, RM; Klunder, JM; Ко, SY; Masamune, H .; Шарплесс, КБ (1987). «Каталитическое асимметричное эпоксидирование и кинетическое разрешение: модифицированные процедуры, включая дериватизацию in situ». Варенье. Chem. Soc. 109 (19): 5765–5780. DOI : 10.1021 / ja00253a032 .
- ^ a b Uetikon, CF (1986). Синтез : 88–116. Отсутствует или пусто
|title=( справка ) - ^ Джонсон, РА; Шарплесс, КБ (1991). «Реакции присоединения с образованием углеродно-кислородных связей: (ii) асимметричные методы эпоксидирования». Компр. Орг. Synth . 7 : 389–436. DOI : 10.1016 / B978-0-08-052349-1.00196-7 . ISBN 978-0-08-052349-1.
- ^ Hüft, Е. (1993). «Энантиоселективное эпоксидирование перекисным кислородом». Вершина. Curr. Chem . Темы современной химии. 164 : 63–77. DOI : 10.1007 / 3-540-56252-4_25 . ISBN 978-3-540-56252-8.
- ^ Кацуки, Т .; Мартин, VS (1996). Орг. Реагировать . 48 : 1–300. Отсутствует или пусто
|title=( справка ) - ^ Pfenninger, A. (1986). «Асимметричное эпоксидирование аллиловых спиртов: эпоксидирование по Шарплесу». Синтез . 1986 (2): 89–116. DOI : 10,1055 / с-1986-31489 .
- ^ Финн, MG; Шарплесс, КБ (1991). «Механизм асимметричного эпоксидирования. 2. Структура катализатора». Варенье. Chem. Soc . 113 : 113–126. DOI : 10.1021 / ja00001a019 .
- ^ Takano, S .; Iwabuchi, Y .; Огасавара, К. (1991). «Инверсия энантиоселективности в режиме кинетического разрешения асимметричной реакции эпоксидирования Кацуки-Шарплесса». Варенье. Chem. Soc. 113 (7): 2786–2787. DOI : 10.1021 / ja00007a082 .
- ^ Китано, Y .; Matsumoto, T .; Сато, Ф. (1988). «Высокоэффективное кинетическое разделение γ- и β-триметилсилильных вторичных аллильных спиртов с помощью асимметричного эпоксидирования без резкости». Тетраэдр . 44 (13): 4073–4086. DOI : 10.1016 / S0040-4020 (01) 86657-6 .
- ^ Мартин, V .; Woodard, S .; Кацуки, Т .; Yamada, Y .; Ikeda, M .; Шарплесс, КБ (1981). «Кинетическое разделение рацемических аллиловых спиртов путем энантиоселективного эпоксидирования. Путь к веществам абсолютной энантиомерной чистоты?». Варенье. Chem. Soc. 103 (20): 6237–6240. DOI : 10.1021 / ja00410a053 .
- ^ Росситер, B .; Кацуки, Т .; Шарплесс, КБ (1981). «Асимметричное эпоксидирование обеспечивает кратчайшие пути к четырем хиральным эпоксидным спиртам, которые являются ключевыми промежуточными продуктами в синтезе метимицина, эритромицина, лейкотриена C-1 и диспарлюра». Варенье. Chem. Soc. 103 (2): 464–465. DOI : 10.1021 / ja00392a038 .
- ^ Шарплесс, КБ ; Беренс, Швейцария; Кацуки, Т .; Ли, AWM; Мартин, VS; Takatani, M .; Viti, SM; Уокер, Ф.Дж.; Вудард, СС (1983). «Стерео- и региоселективные открытия хиральных 2,3-эпоксидных спиртов. Разнообразные пути к оптически чистым натуральным продуктам и лекарствам. Необычные кинетические разрешения» . Pure Appl. Chem. 55 (4): 589. DOI : 10,1351 / pac198855040589 .
- ^ Хенбест, HB; Уилсон, RAL (1957). «376. Аспекты стереохимии. Часть I. Стереоспецифичность образования эпоксидов из циклических аллиловых спиртов». Журнал химического общества (возобновленный) : 1958. DOI : 10.1039 / JR9570001958 .
- ^ Чемберлен, P .; Робертс, ML; Whitham, GH (1970). «Эпоксидирование аллиловых спиртов пероксикислотами. Попытки определить геометрию переходного состояния». Журнал химического общества B: физико - органической : 1374 DOI : 10.1039 / J29700001374 .
- ^ Weyerstahl, Питер; Маршалл-Вейершталь, Хельга; Пеннингер, Йозеф; Вальтер, Лутц (1987). «Терпены и производные терпена-22». Тетраэдр . 43 (22): 5287–5298. DOI : 10.1016 / S0040-4020 (01) 87705-X .
- ^ МакКиттрик, Брайан А .; Ганем, Брюс (1985). «Синстереоселективное эпоксидирование аллиловых эфиров с использованием CF3CO3H». Буквы тетраэдра . 26 (40): 4895–4898. DOI : 10.1016 / S0040-4039 (00) 94979-7 .
- ^ Ховейда, Амир Х .; Эванс, Дэвид А .; Фу, Грегори С. (1993). «Субстрат-управляемые химические реакции». Химические обзоры . 93 (4): 1307–1370. DOI : 10.1021 / cr00020a002 .
- ^ Houk, KN; Пэддон-Роу, Миннесота; Рондан, Н.Г .; Wu, YD; Браун, ФК; Спеллмейер, округ Колумбия; Metz, JT; Li, Y .; Loncharich, RJ Science , 1986 , 231 , 1108-1117.
- ^ Вальдемар, А .; Вирт, Т. Счета химических исследований , 1999 , 32.8 , 703-710.
- ^ Михелич, Эдвард Д. (1979). «Эпоксидирование, катализируемое ванадием. I. Новый образец селективности для ациклических аллильных спиртов». Буквы тетраэдра . 20 (49): 4729–4732. DOI : 10.1016 / S0040-4039 (01) 86695-8 .
- ^ Росситер, BE; Верховен, TR; Шарплесс, КБ (1979). «Стереоселективное эпоксидирование ациклических аллиловых спиртов. Исправление нашей предыдущей работы». Буквы тетраэдра . 20 (49): 4733–4736. DOI : 10.1016 / S0040-4039 (01) 86696-X .
- ^ Нарула, Ачаран С. (1982). «Стереоселективное введение хиральных центров в ацильных предшественниках: проба в переходное состояние для катализированного V5 + t-бутилгидропероксида (TBHP) эпоксидирования ациклических аллиловых спиртов и его синтетические последствия». Буквы тетраэдра . 23 (52): 5579–5582. DOI : 10.1016 / S0040-4039 (00) 85899-2 .
- ^ Cragg, GML; Микинс, GD (1965). «366. Стероиды неестественной конфигурации. Часть IX. Окисление 9α-люмистерола (пирокальциферола) и 9β-эргостерола (изопирокальциферола) пербензойной кислотой». J. Chem. Soc. : 2054–2063. DOI : 10.1039 / JR9650002054 .
- ^ Джонсон, MR; Киши, Ю. Tetrahedron Lett. , 1979 , 4347-4350.
- ^ Михелич, Эдвард Д .; Дэниэлс, Карен; Эйкхофф, Дэвид Дж. (1981). «Эпоксидирование, катализируемое ванадием. 2. Высокостереоселективное эпоксидирование ациклических гомоаллильных спиртов, предсказанное детальной моделью переходного состояния». Журнал Американского химического общества . 103 (25): 7690–7692. DOI : 10.1021 / ja00415a067 .
- ^ Ито, Такаши; Дзицукава, Коитиро; Канеда, Киётоми; Тераниши, Шичиро (1979). «Катализируемое ванадием эпоксидирование циклических аллильных спиртов. Стереоселективность и механизм стереоконтроля». Журнал Американского химического общества . 101 : 159–169. DOI : 10.1021 / ja00495a027 .
- ^ Шарплесс, КБ; Michaelson, RC J. Am. Chem. Soc. , 1973 , 95 (18)
Внешние ссылки [ править ]
- Асимметричная реакция эпоксидирования Шарплесса