| Caulobacter crescentus | |
|---|---|
 | |
| Научная классификация | |
| Королевство: | |
| Тип: | |
| Учебный класс: | |
| Заказ: | |
| Семья: | |
| Род: | |
| Разновидность: | C. crescentus |
| Биномиальное имя | |
| Caulobacter crescentus Пойндекстер 1964 | |
Caulobacter crescentus является грамотрицательной , олиготрофной бактерией широко распространен в пресноводных озерах и ручьях. Таксон более известен как Caulobacter vibrioides (Henrici and Johnson 1935). [1]
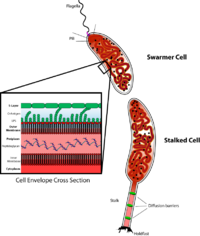
Caulobacter - важный модельный организм для изучения регуляции клеточного цикла , асимметричного деления клеток и клеточной дифференцировки . Дочерние клетки Caulobacter имеют две очень разные формы. Одна дочерняя - мобильная клетка-«ройщик», имеющая единственный жгутик на одном полюсе клетки, который обеспечивает плавательную подвижность для хемотаксиса.. Другая дочерняя клетка, называемая «стеблевая» клетка, имеет трубчатую структуру стебля, выступающую из одного полюса, на конце которого имеется липкий удерживающий материал, с помощью которого стеблевая клетка может прилипать к поверхностям. Клетки Swarmer дифференцируются в клетки стебля после короткого периода подвижности. Репликация хромосом и деление клеток происходит только на стадии стебельчатых клеток. Его название происходит от полумесяца, образованного белком серсентином.. C. crescentus - это взаимосвязанный организм, который необходимо изучать, поскольку он обитает в водной среде с низким содержанием питательных веществ. Их способности развиваться при низком уровне питательных веществ способствует диморфный цикл развития. У роевой клетки есть жгутик, который выступает из единственного полюса и не может инициировать репликацию ДНК, если не дифференцируется в стеблевую клетку. Процесс дифференцировки включает морфологический переход, характеризующийся выбросом жгутика и ростом ножки на том же полюсе. Стволовые клетки могут удлиняться и реплицировать свою ДНК, при этом вырастая жгутик на противоположном полюсе, давая начало клетке, предшествующей делению. Хотя точная функция стеблей все еще исследуется, вполне вероятно, что стебли участвуют в усвоении питательных веществ в условиях ограниченного количества питательных веществ. [2]Его использование в качестве модели было инициировано биологом Люси Шапиро . [3] [4]
Штаммы [ править ]
В лаборатории исследователи различают штамм CB15 C. crescentus (штамм, первоначально выделенный из пресноводного озера) и NA1000 (основной экспериментальный штамм). В штамме NA1000, который был получен из CB15 в 1970-х годах [5], стебельчатые и предделенные клетки могут быть физически отделены в лаборатории от новых роевых клеток, в то время как типы клеток из штамма CB15 не могут быть физически отделены. Затем изолированные роевые клетки можно выращивать как синхронизированную культуру клеток. Детальное изучение молекулярного развития этих клеток по мере их прохождения клеточного цикла позволило исследователям понять Caulobacter.очень подробно регуляция клеточного цикла. Благодаря этой способности к физической синхронизации штамм NA1000 стал преобладающим экспериментальным штаммом Caulobacter во всем мире. Дополнительные фенотипические различия между двумя штаммами впоследствии накопились из-за селективного давления на штамм NA1000 в лабораторных условиях. Генетическая основа фенотипических различий между двумя штаммами является результатом кодирования, регуляции и полиморфизма вставок / делеций в пяти хромосомных локусах. [6] C. crescentus является синонимом Caulobacter vibrioides . [1]
Геномика [ править ]
Caulobacter геном CB15 имеет 4,016,942 пар оснований в одной круговой хромосоме , кодирующей 3,767 генов. [7] Геном содержит несколько кластеров генов, кодирующих белки, необходимые для выживания в среде с низким содержанием питательных веществ. Включены те, которые участвуют в хемотаксисе, функции каналов внешней мембраны, деградации ароматических кольцевых соединений и расщеплении источников углерода растительного происхождения, в дополнение ко многим сигма-факторам экстрацитоплазматической функции, обеспечивая организму способность реагировать на широкий диапазон колебания окружающей среды. В 2010 году штамм Caulobacter NA1000 был секвенирован, и были выявлены все различия со штаммом CB15 «дикого типа». [6]
Роль стадии Swarmer Cell [ править ]
Caulobacter этап прошествовал клеток обеспечивает преимущество фитнес анкерных клетки на поверхность с образованием биопленок и или для использования источников питательных веществ. Как правило, виды бактерий, которые делятся быстрее всех, будут наиболее эффективно использовать ресурсы и эффективно занимать экологические ниши. Тем не менее, Caulobacterимеет стадию роевых клеток, что приводит к более медленному росту популяции. Каково компенсирующее преимущество этой стадии подвижных клеток в пригодности? Считается, что роевые клетки обеспечивают рассредоточение клеток, так что организм постоянно ищет новую среду. Это может быть особенно полезно в средах с жестким ограничением питательных веществ, когда доступные скудные ресурсы могут быть истощены очень быстро. Многие, возможно, большинство из дочерних клеток роя не найдут продуктивной среды, но стадия обязательного расселения должна повысить репродуктивную пригодность вида в целом.
Клеточный цикл [ править ]
Система регуляции клеточного цикла Caulobacter контролирует многие модульные подсистемы, которые организуют процесс роста и размножения клеток. Система управления, построенная с использованием схем биохимической и генетической логики, организует время запуска каждой из этих подсистем. Центральным элементом регуляции клеточного цикла является циклический генетический контур - двигатель клеточного цикла, - который сосредоточен вокруг последовательных взаимодействий пяти основных регуляторных белков: DnaA, GcrA, CtrA, SciP и CcrM, роли которых были разработаны в лабораториях. от Люси Шапиро и Harley МакАдамс . [8] [9] [10] Эти пять белков напрямую контролируют время экспрессии более 200 генов. Пять основных регуляторных белков синтезируются и затем выводятся из клетки один за другим в течение клеточного цикла. Несколько дополнительных клеточных сигнальных путей также важны для правильного функционирования этого двигателя клеточного цикла. Основная роль этих сигнальных путей заключается в обеспечении надежного производства и удаления белка CtrA из клетки в нужные моменты клеточного цикла.
Существенной особенностью клеточного цикла Caulobacter является то, что хромосома реплицируется один и только один раз за клеточный цикл. Это контрастирует с клеточным циклом E. coli, где одновременно могут происходить перекрывающиеся циклы репликации хромосом. Противоположные роли белков Caulobacter DnaA и CtrA важны для жесткого контроля репликации хромосомы Caulobacter . [11] Белок DnaA действует как источник репликации.для инициации репликации хромосомы. Белок CtrA, напротив, блокирует инициацию репликации, поэтому он должен быть удален из клетки до начала репликации хромосомы. Множественные дополнительные регуляторные пути, являющиеся неотъемлемой частью регуляции клеточного цикла и включающие как фосфо-сигнальные пути, так и регулируемый контроль протеолиза белка [12], гарантируют, что DnaA и CtrA присутствуют в клетке именно тогда, когда это необходимо.
Каждый процесс, активируемый белками двигателя клеточного цикла, включает в себя каскад многих реакций. Самый длинный каскад подсистем - репликация ДНК. В CaulobacterВ клетках репликация хромосомы включает около 2 миллионов реакций синтеза ДНК для каждого плеча хромосомы в течение 40–80 минут в зависимости от условий. Хотя среднее время для каждой индивидуальной реакции синтеза можно оценить по наблюдаемому среднему общему времени для репликации хромосомы, фактическое время реакции для каждой реакции широко варьируется в пределах средней скорости. Это приводит к значительному и неизбежному изменению времени от клетки к клетке для полной репликации хромосомы. Аналогичные случайные вариации происходят в скоростях развития каскадов реакций всех других подсистем. Итоговый эффект заключается в том, что время завершения клеточного цикла широко варьируется для разных клеток в популяции, даже если все они растут в одинаковых условиях окружающей среды. Регуляция клеточного цикла включает обратную связьсигналы, которые ускоряют прогрессию двигателя клеточного цикла, чтобы соответствовать прогрессу событий на уровне регуляторной подсистемы в каждой конкретной клетке. Эта организация системы управления с контроллером (двигатель клеточного цикла), управляющим сложной системой, с модуляцией сигналами обратной связи от управляемой системы, создает систему управления с обратной связью.
Скорость развития клеточного цикла дополнительно регулируется дополнительными сигналами, поступающими от клеточных сенсоров, которые отслеживают условия окружающей среды (например, уровни питательных веществ и уровень кислорода) или внутреннее состояние клетки (например, наличие повреждений ДНК). [13]
Эволюционная консервация системы контроля клеточного цикла [ править ]
Схема управления, которая направляет и контролирует развитие клеточного цикла Caulobacter, включает в себя всю клетку, работающую как интегрированную систему. Схема управления контролирует окружающую среду и внутреннее состояние клетки, включая топологию клетки, поскольку она управляет активацией подсистем клеточного цикла и асимметричным делением клеток Caulobacter crescentus . Белки системы контроля клеточного цикла Caulobacter и ее внутренняя организация совместно консервативны у многих видов альфа-протеобактерий, но существуют большие различия в функциональности регуляторного аппарата и периферической связи с другими клеточными подсистемами от вида к виду. [14] [15] CaulobacterСистема управления клеточным циклом была тщательно оптимизирована путем эволюционного отбора как целостная система для надежной работы перед лицом внутреннего стохастического шума и неопределенности окружающей среды.
Система управления бактериальной клеткой имеет иерархическую организацию. [16] Подсистема сигнализации и управления взаимодействует с окружающей средой с помощью сенсорных модулей, расположенных в основном на поверхности клетки. Логика генетической сети реагирует на сигналы, полученные из окружающей среды и от внутренних датчиков состояния клетки, чтобы адаптировать клетку к текущим условиям. Основная функция контроля верхнего уровня - гарантировать, что операции, участвующие в клеточном цикле, происходят в надлежащем временном порядке. В Caulobacter, это достигается с помощью генетической регуляторной цепи, состоящей из пяти главных регуляторов и ассоциированной фосфо-сигнальной сети. Сеть фосфосигнализации отслеживает состояние развития клеточного цикла и играет важную роль в выполнении асимметричного деления клеток. Система контроля клеточного цикла управляет временем и местом инициации репликации хромосом и цитокинеза, а также развитием полярных органелл.. В основе всех этих операций лежат механизмы производства белка и структурных компонентов, а также производства энергии. «Домашние» метаболические и катаболические подсистемы обеспечивают энергией и молекулярным сырьем для синтеза белка, строительства клеточной стенки и других операций клетки. Функции обслуживания двунаправленно связаны с системой управления клеточным циклом. Однако они могут адаптироваться, в некоторой степени независимо от логики контроля клеточного цикла, к изменению состава и уровней доступных источников питательных веществ.
Белки системы контроля клеточного цикла Caulobacter широко совместно консервативны среди альфа-протеобактерий, но конечная функция этой регуляторной системы широко варьируется у разных видов. Эти эволюционные изменения отражают огромные различия между отдельными видами в стратегиях приспособленности и экологических нишах. Например, Agrobacterium tumefaciens является патогеном растений, Brucella abortus - патогеном животных, а Sinorhizobium meliloti - почвенной бактерией, которая вторгается в клубеньки корня растений и становится симбионтом , фиксирующим азот, но большинство белков CaulobacterКонтроль клеточного цикла также обнаружен у этих видов. Специфическая связь между белковыми компонентами сети контроля клеточного цикла и последующим считыванием схемы различается от вида к виду. Закономерность состоит в том, что внутренняя функциональность сетевых схем сохраняется, но связь на «краях» регуляторного аппарата с белками, контролирующими специфические клеточные функции, сильно различается у разных видов.
Эволюция расположения стеблей в кладе Caulobacter [ править ]
Caulobacter crescentus является членом группы бактерий, которые обладают стеблевым строением, трубчатым продолжением тела клетки. Однако положение стебля не обязательно сохраняется на полюсе тела клетки у различных близкородственных видов. В частности, исследования показали, что не только положение стебля может меняться, но и количество может меняться у близкородственного рода Asticcacaulis . [17] [18] SpmX, полярно локализованный белок в Caulobacter crescentus, как было показано, манипулирует положением стебля у этих видов Asticcacaulis . [17] Предположительно, это происходит за счет увеличения функции после увеличения количества белка примерно с 400 аминокислот вCaulobacter crescentus более чем на 800 аминокислот у видов Asticcacaulis .
Caulobacter старение [ править ]
Caulobacter была первой асимметричной бактерией, у которой выявлено старение. Репродуктивное старение измеряли как уменьшение количества производимого потомства с течением времени. [19] [20] На основе экспериментальных исследований эволюции C. crescentus , Ackermann et al. [19] предположили, что старение, вероятно, является фундаментальным свойством всех клеточных организмов. Подобный феномен был с тех пор описан у бактерии Escherichia coli , которая дает начало морфологически подобным дочерним клеткам. [21]
Регулировка полярности клеток [ править ]
У C. crescentus клеточная полярность легко проявляется по сборке полярных органелл и по поляризации плоскости деления, что приводит к образованию стеблевого потомства, которое длиннее, чем потомство роя. Формирование новых клеточных полюсов при делении подразумевает, что полярность клеток должна быть восстановлена в потомстве с ножкой и обращена на обратную в потомстве роя. [22]
C. crescentus жизненный цикл регулируется регуляторами , такими как TipN , белок клеточного цикла. Йельского университетаданные убедительно подтверждают модель, в которой TipN регулирует ориентацию оси полярности, обеспечивая позиционный сигнал от предшествующего клеточного цикла. В этой модели TipN указывает место последнего подразделения, определяя новый полюс. Клетка использует эту позиционную информацию как источник внутриклеточной асимметрии, чтобы установить и поддерживать ориентацию оси полярности, которая является критической для полярного морфогенеза и деления. Рекрутирование TipN к возникающим полюсам в конце цикла деления переопределяет идентичность полюсов и сбрасывает правильную полярность в обеих будущих дочерних клетках (с изменением полярности в клетке Swarmer). [22]Регулируемый клеточным циклом синтез и удаление этих полярно локализованных структур предоставили богатую площадку для идентификации знаковых белков, важных для их правильной локализации. [23] TipN имеет две трансмембранные области в N-концевой области и большой C-концевой домен спиральной спирали. Гомологи TipN присутствуют и у других альфа-протеобактерий. TipN локализуется на новом полюсе в обеих дочерних клетках после деления и перемещается в сайт деления клетки в поздней предделительной клетке. Следовательно, обе дочерние клетки после деления имеют TipN на новом полюсе. [23]
Опорный белок TipN необходим для правильного размещения жгутика. [24] Мутанты без TipN совершают серьезные ошибки в развитии. Вместо того, чтобы образовывать один жгутик на правильном полюсе клетки, клетка образует несколько жгутиков в разных местах, даже на стебле. [22]
В процессе развития клетки многие такие белки работают вместе. На рис. 1 показано, как TipN взаимодействует с двумя другими полярными белками: маркером жгутика PodJ и маркером стебля DivJ. [25]
Ссылки [ править ]
- ^ а б Авраам, Вольф-Райнер; Карстен Стрёмпл; Хольгер Мейер; Сабина Линдхольст; Эдвард РБ Мур; Рупрехт Христос; Марк Ванканнейт; Би Джей Тиндали; Антонио Беннасар; Джон Смит; Майкл Тесар (1999). "Филогения и многофазная таксономия видов Caulobacter. Предложение Maricaulis gen. Nov. С Maricaulis maris (Poindexter) comb. Nov. В качестве типового вида и исправленное описание родов Brevundirnonas и Caulobacter" . Международный журнал систематической бактериологии . 49 (3): 1053–73. DOI : 10.1099 / 00207713-49-3-1053 . PMID 10425763 .
- ^ Осмис, Нора; Kuhn, Jeffrey R .; Джейкобс-Вагнер, Кристина (декабрь 2003 г.). «Бактериальный цитоскелет: промежуточная филаментоподобная функция в форме клетки». Cell . 115 (6): 705–13. DOI : 10.1016 / S0092-8674 (03) 00935-8 . PMID 14675535 . S2CID 14459851 .
- ^ Угорь, Криста (31 марта 2009). «Лучшая канадская премия присуждается ученому из Стэнфорда Люси Шапиро за открытие клеточной биологии в трех измерениях» . Деловой провод . Дата обращения 14 мая 2015 .
- ^ «2014 Люси Шапиро» . Премия Грингарда . 2014 . Дата обращения 14 мая 2015 .
- ^ Пойндекстер, JS (сентябрь 1964). «Биологические свойства и классификация группы Caulobacter» . Microbiol. Мол. Биол. Ред . 28 (3): 231–95. DOI : 10.1128 / mmbr.28.3.231-295.1964 . PMC 441226 . PMID 14220656 .
- ^ a b отмечает МЕНЯ; Кастро-Рохас CM; Teiling C; и другие. (Июль 2010 г.). «Генетические основы лабораторной адаптации Caulobacter crescentus» . J. Bacteriol . 192 (14): 3678–88. DOI : 10.1128 / JB.00255-10 . PMC 2897358 . PMID 20472802 .
- ^ Nierman, WC; Фельдблюм, ТВ; Лауб, MT; Паулсен, ИТ; Nelson, KE; Eisen, JA; Гейдельберг, JF; Аллея, MR; Охта, Н; Мэддок, младший; Потоцкая, I; Нельсон, WC; Ньютон, А; Стивенс, К; Phadke, ND; Эли, B; Дебой, RT; Додсон, Р.Дж.; Дуркин А.С.; Гвинн, ML; Хафт, DH; Колонай, JF; Смит, Дж; Крейвен, МБ; Khouri, H; Шетти, Дж; Берри, К; Аттербек, Т; Тран, К; Вольф, А; Ваматеван, Дж; Ермолаева, М; Белый, О; Зальцберг, SL; Venter, JC; Шапиро, Л; Фрейзер, CM (27 марта 2001 г.). «Полная последовательность генома Caulobacter crescentus» . Труды Национальной академии наук Соединенных Штатов Америки . 98 (7): 4136–41. Bibcode : 2001PNAS ... 98.4136N . DOI : 10.1073 / pnas.061029298. PMC 31192 . PMID 11259647 .
- ^ McAdams, HH; Шапиро, Л. (17 декабря 2009 г.). «Системный дизайн контроля бактериального клеточного цикла» . Письма FEBS . 583 (24): 3984–91. DOI : 10.1016 / j.febslet.2009.09.030 . PMC 2795017 . PMID 19766635 .
- ^ Кольер, J; Шапиро, Л. (август 2007 г.). «Пространственная сложность и контроль клеточного цикла бактерий» . Текущее мнение в области биотехнологии . 18 (4): 333–40. DOI : 10.1016 / j.copbio.2007.07.007 . PMC 2716793 . PMID 17709236 .
- ^ Тан, MH; Коздон, JB; Шен, X .; Шапиро, Л .; Макадамс, HH (2010). «Важнейший фактор транскрипции, SciP, повышает устойчивость регуляции клеточного цикла Caulobacter» . Труды Национальной академии наук . 107 (44): 18985–990. Bibcode : 2010PNAS..10718985T . DOI : 10.1073 / pnas.1014395107 . PMC 2973855 . PMID 20956288 .
- ^ Кольер, J; Мюррей, SR; Шапиро, Л. (25 января 2006 г.). «DnaA связывает репликацию ДНК и экспрессию двух основных регуляторов клеточного цикла» . Журнал EMBO . 25 (2): 346–56. DOI : 10.1038 / sj.emboj.7600927 . PMC 1383511 . PMID 16395331 .
- ^ Jenal, U (ноябрь 2009). «Роль протеолиза в клеточном цикле Caulobacter crescentus и развитии». Исследования в области микробиологии . 160 (9): 687–95. DOI : 10.1016 / j.resmic.2009.09.006 . PMID 19781638 .
- ^ Шен, X; Кольер, Дж; Dill, D; Шапиро, Л; Horowitz, M; Макадамс, Е. Х. (12 августа 2008 г.). «Архитектура и внутренняя надежность бактериальной системы контроля клеточного цикла» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (32): 11340–45. Bibcode : 2008PNAS..10511340S . DOI : 10.1073 / pnas.0805258105 . PMC 2516238 . PMID 18685108 .
- ^ McAdams, Harley H .; Шапиро, Люси (2011). «Архитектура и схема сохранения схемы управления всей ячейкой» . Журнал молекулярной биологии . 409 (1): 28–35. DOI : 10.1016 / j.jmb.2011.02.041 . PMC 3108490 . PMID 21371478 .
- ^ Брилли, Маттео; Фонди, Марко; Фани, Ренато; Менгони, Алессио; Ферри, Лоренцо; Баззикалупо, Марко; Бионди, Эмануэле Г. (2010). «Разнообразие и эволюция регуляции клеточного цикла у альфа-протеобактерий: сравнительный геномный анализ» . BMC Системная биология . 4 : 52. DOI : 10,1186 / 1752-0509-4-52 . PMC 2877005 . PMID 20426835 .
- ^ McAdams, HH; Шапиро, Л. (май 2011 г.). «Архитектура и образец сохранения схемы управления целыми клетками» . J Mol Biol . 409 (1): 28–35. DOI : 10.1016 / j.jmb.2011.02.041 . PMC 3108490 . PMID 21371478 .
- ^ а б Цзян, Чао; Браун, Памела Дж. Б.; Дюкре, Адриан; Brun1, Ив В. (27.02.2014). «Последовательная эволюция морфологии бактерий путем кооптации регулятора развития» . Природа . 506 (7489): 489–93. Bibcode : 2014Natur.506..489J . DOI : 10,1038 / природа12900 . ISSN 0028-0836 . PMC 4035126 . PMID 24463524 .
- ^ Цзян, Чао; Caccamo, Paul D .; Брун, Ив В. (апрель 2015 г.). «Механизмы бактериального морфогенеза: подходы эволюционной клеточной биологии открывают новые горизонты» . BioEssays . 37 (4): 413–25. DOI : 10.1002 / bies.201400098 . ISSN 1521-1878 . PMC 4368449 . PMID 25664446 .
- ^ a b Акерманн, Мартин; Стивен С. Стернс ; Урс Дженал (2003). «Старение у бактерии с асимметричным делением». Наука . 300 (5627): 1920. DOI : 10.1126 / science.1083532 . PMID 12817142 . S2CID 34770745 .
- ^ Аккерманн, Мартин; Александра Шауэрте; Стивен С. Стернс ; Урс Дженал (2007). «Экспериментальная эволюция старения в бактерии» . BMC Evolutionary Biology . 7 : 126. DOI : 10.1186 / 1471-2148-7-126 . PMC 2174458 . PMID 17662151 .
- ^ Стюарт, Эрик Дж .; Ричард Мэдден; Грегори Пол; Франсуа Таддеи (2005). «Старение и смерть в организме, который размножается морфологически симметричным делением» . PLOS Биология . 3 (2): e45. DOI : 10.1371 / journal.pbio.0030045 . PMC 546039 . PMID 15685293 .
- ^ a b c H, Лам; Wb, Шофилд; C, Джейкобс-Вагнер (10 марта 2006 г.). «Важнейший белок, необходимый для установления и сохранения полярности бактериальной клетки». Cell . 124 (5): 1011–23. DOI : 10.1016 / j.cell.2005.12.040 . PMID 16530047 . S2CID 14200442 .
- ^ a b Treuner-Lange, Анке; Согаард-Андерсен, Лотте (07.07.2014). «Регулирование полярности клеток у бактерий» . Журнал клеточной биологии . 206 (1): 7–17. DOI : 10,1083 / jcb.201403136 . ISSN 0021-9525 . PMC 4085708 . PMID 25002676 .
- ^ Huitema, Эдгар; Причард, Шон; Маттесон, Дэвид; Радхакришнан, Суниш Кумар; Виолье, Патрик Х. (10 марта 2006 г.). «Бактериальные белки шрамов рождения маркируют место сборки будущего жгутика» . Cell . 124 (5): 1025–37. DOI : 10.1016 / j.cell.2006.01.019 . ISSN 0092-8674 . PMID 16530048 . S2CID 15574493 .
- ^ Лоулер, Мелани Л .; Брун, Ив В. (2006-03-10). «Молекулярный маяк определяет асимметрию бактериальных клеток» . Cell . 124 (5): 891–93. DOI : 10.1016 / j.cell.2006.02.027 . ISSN 0092-8674 . PMID 16530036 .
Внешние ссылки [ править ]
| Викискладе есть медиафайлы по теме Caulobacter crescentus . |
- Caulobacter crescentus
- Бактерия делает самый прочный природный клей