| Синтез пиридина чичибабина | |
|---|---|
| Названный в честь | Алексей Чичибабин |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| ID онтологии RSC | RXNO: 0000526 |
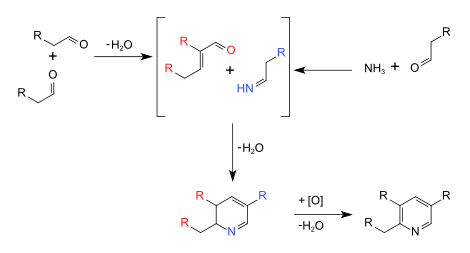
Чичибабин синтез пиридина ( / tʃ я tʃ я ˌ б eɪ б я н / ) представляет собой способ синтеза пиридина кольца. В общем виде реакй может быть описана как реакция конденсации с альдегидов , кетонов , & alpha ; , & beta; непредельные соединения карбонила , или любое сочетание указанных выше, в аммиаке или аммиак производных . [1] Об этом сообщил Алексей Чичибабин в 1924 году. [2] Ниже приводится общая форма общей реакции:
Механизм реакции [ править ]
Элементарные этапы механизма реакции могут быть классифицированы как реакции с более знакомым названием, включая синтез имина , альдольную конденсацию , катализируемую основанием , и инициирование стадии кольцевого синтеза, реакцию Михаэля .
Основные шаги реакции [ править ]
Подробный механизм реакции [ править ]
Показаны подробные изогнутые стрелки, выталкивающие электроны, формальные заряды и категоризованные стадии реакции. [3] [4]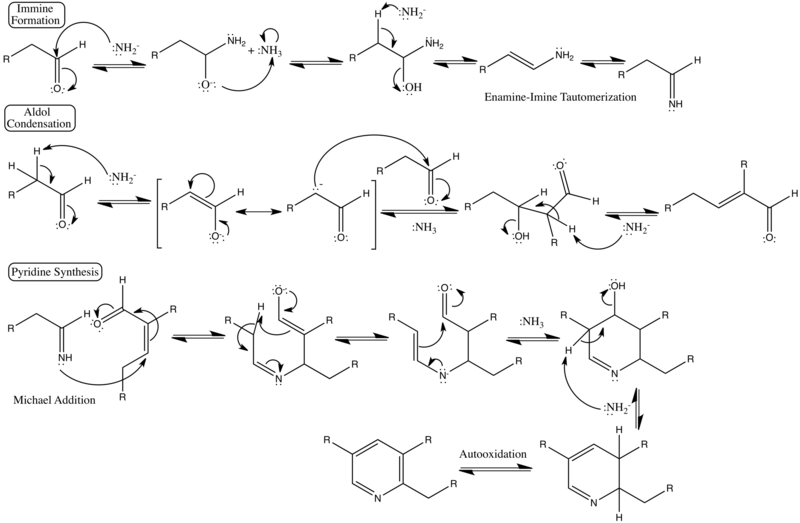
Синтетические приложения [ править ]
Алкилзамещенные пиридины широко используются во многих областях прикладной химии, включая полимерную и фармацевтическую промышленность. Например, 2-метилпиридин , 4-метилпиридин и 2-этил-5-метилпиридин широко используются в синтезе латексов , ионообменных матриц и фотографических материалов. [5]
Ограничения [ править ]
Одним из главных ограничений практического применения традиционного синтеза пиридина Чичибабина является его стабильно низкий выход продукта. За исключением двух экспериментов, сам Чичибабин не смог получить выход продукта, превышающий 20%, при использовании различных реагентов, растворителей и других экспериментальных условий. Это, в сочетании с высокой распространенностью побочных продуктов, которые потребовали бы множества стадий очистки для выделения чистого пиридинового продукта, делает неизмененные формы метода Чичибабина непригодными для прикладной химии. [1] [2]
Высокая доля побочных продуктов и низкий выход объясняются легко обратимым характером альдольной конденсации и карбонильной химией в целом. [1] Например, следующие побочные реакции могут привести к образованию побочных продуктов:
Шаги формирования Imine:
1. нуклеофильной атака аммиака в бета-, а не альфа-углерод будет препятствовать енаминовый / имину образования
2. нуклеофильная атака аммиака на енамин или имин
Стадия конденсации альдола
3. (В случае асимметричных кетонов ) отщепление нежелательного β-водорода
4. Атака енолат-ионами енамина или иминного углерода
5.Энолат-ионная атака непреднамеренного альдегид- или кетокарбонила
Стадия синтеза пиридина
6. Imine атака карбонила, а не γ-углерода.
7. Иминная атака на енамин или иминовый углерод.
В случае простых альдегидов , и особенно в случае α, β-ненасыщенных карбонильных соединений , полимеризация исходных материалов может происходить часто и, как было показано, значительно снижает выходы. [1]
Способы преодоления ограничений [ править ]
1. Защита карбонила увеличивает выход продукта [1]
2. Использование паральдегида в качестве источника постепенно доступного ацетальдегида [1]
3. Большой (> 3-кратный каталитический) избыток водного раствора аммиака с каталитическими количествами ацетата аммония [1] [4]
4. Проведение реакции в газовой фазе и пропускание ряда катализаторов, включая оксид алюминия (III) (выход 65% при 600 К), [5] цеолит (выход 98,9% при 500 К), [6] и многие другие. другие.
5. Повышенное давление и температура [1] [4]
Доказательства этого механизма in vivo [ править ]
В естественных условиях , дезаминирование в альфа-аминогруппу из аминокислот производит небольшое количество аммиака. Исследователи обнаружили, что включенный в белок аллизин (дезаминированный лизин) из эластиновых волокон задней связки крупного рогатого скота оказался сшитым пиридином. Структуры этих сшитых аминокислот имели 3,4,5- и 2,3,5-тризамещенные пиридиновые скелеты, в частности пиридинированный десмозин (DESP) и пиридиновый изодесмозин (IDP). [7]
Экстраполируя модель эластина in vitro в физиологических условиях, исследователи обнаружили, что отношения IDP к DESP очень близко соответствуют значениям, основанным как на расчетах теоретического синтеза пиридина чичибабином 3 моль аллизина и 1 моль аммиака, так и на указанных соотношениях. соотношения 2,3,5- к 3,4,5-тризамещенному пиридину в синтезе пиридина Чичибабина с участием фенилацетальдегида . [8] Они с относительной уверенностью пришли к выводу, что пиридиновые поперечные связи, обнаруженные в эластине, на самом деле являются результатом синтеза аммиака и аллизина in vivo чичибабином пиридином. [7]
См. Также [ править ]
- Реакция Чичибабина
- Синтез Гаттермана – Скиты
- Синтез пиридина Ганча
- Перегруппировка Чамисана-Денштедта
Ссылки [ править ]
- ^ a b c d e f g h Франк, RL; Семь, RP (1949). «Пиридины. IV. Исследование синтеза чичибабина». Журнал Американского химического общества . 71 (8): 2629–35. DOI : 10.1021 / ja01176a008 .
- ^ a b Чичибабин, А.Е. (1924). "Über Kondensation der Aldehyde mit Ammoniak zu Pyridinbasen" . Journal für Praktische Chemie . 107 (1–4): 122–8. DOI : 10.1002 / prac.19241070110 .
- Перейти ↑ Li, JJ (2009). «Синтез пиридина Чичибабина». Назовите Реакции . С. 107–9. DOI : 10.1007 / 978-3-642-01053-8_51 . ISBN 978-3-540-40203-9.
- ^ a b c Вайс, М. (1952). «Реакции уксусной кислоты и ацетата аммония. Улучшенный синтез пиридина чичибабина». Журнал Американского химического общества . 74 (1): 200–2. DOI : 10.1021 / ja01121a051 .
- ^ а б Сагитуллин РС; Шкиль, ГП; Носонова, И.И. Фербер, AA (1996). «Синтез пиридиновых оснований по методу Чичибабина (обзор)». Химия гетероциклических соединений . 32 (2): 127–40. DOI : 10.1007 / BF01165434 . S2CID 93717043 .
- ^ Кришна Мохан, KVV; Редди, КСК; Narender, N .; Кулькарни, SJ (2008). «Катализируемый цеолитами синтез 5-этил-2-метилпиридина под высоким давлением». Журнал молекулярного катализа A: Химический . 298 (1–2): 99–102. DOI : 10.1016 / j.molcata.2008.10.010 .
- ^ a b Umeda, H .; Takeuchi, M .; Суям, К. (2001). «Две новые эластиновые поперечные связи, имеющие пиридиновый скелет» . Журнал биологической химии . 276 (16): 12579–87. DOI : 10.1074 / jbc.M009744200 . PMID 11278561 .
- ^ Фарли, CP; Элиэль, EL (1956). «Реакции Чичибабина с фенилацетальдегидом. II». Журнал Американского химического общества . 78 (14): 3477–84. DOI : 10.1021 / ja01595a057 .