Гальваника
Гальванопокрытие — это общее название процессов, в ходе которых на твердую подложку наносится металлическое покрытие путем восстановления катионов этого металла с помощью постоянного электрического тока . Покрываемая часть действует как катод (отрицательный электрод ) электролитической ячейки ; электролит представляет собой раствор соли покрываемого металла; а анод (положительный электрод) обычно представляет собой блок этого металла или какого-либо инертного проводящего материала. Ток обеспечивается внешним источником питания.
Гальваника широко используется в промышленности и декоративно-прикладном искусстве для улучшения свойств поверхности объектов, таких как устойчивость к истиранию и коррозии , смазывающая способность , отражательная способность , электропроводность или внешний вид. Его также можно использовать для увеличения толщины малоразмерных или изношенных деталей или для изготовления металлических пластин сложной формы, процесс, называемый гальванопластикой . Он также используется для очистки металлов, таких как медь .
Термин «гальваническое покрытие» также может иногда использоваться для процессов, в которых используется электрический ток для достижения окисления анионов на твердой подложке, например, при образовании хлорида серебра на серебряной проволоке для изготовления электродов из серебра / хлорида серебра .
Электрополировка , процесс, в котором используется электрический ток для удаления катионов металлов с поверхности металлического предмета, можно рассматривать как противоположность гальванизации. [1]
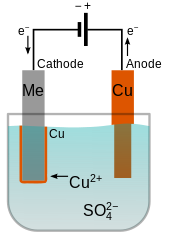
Электролит должен содержать положительные ионы (катионы) осаждаемого металла. Эти катионы восстанавливаются на катоде до металла в состоянии нулевой валентности. Например, электролитом для меднения может быть раствор сульфата меди(II) , который диссоциирует на катионы Cu 2+ и SO2−
4анионы. На катоде Cu 2+ восстанавливается до металлической меди, приобретая два электрона.
Когда анод изготовлен из металла покрытия, там может происходить обратная реакция, превращающая его в растворенные катионы. Например, медь окислилась бы на аноде до Cu 2+ , потеряв два электрона. В этом случае скорость растворения анода будет равна скорости покрытия катода, и, таким образом, ионы в электролитной ванне непрерывно восполняются анодом. Конечным результатом является эффективный перенос металла с анода на катод. [2]