
Йод оксиды являются химическими соединениями из кислорода и йода . У йода есть только два стабильных оксида, которые можно выделить в массе, тетроксид йода и пятиокись йода , но ряд других оксидов образуются в следовых количествах или предположительно существуют. Химия этих соединений сложна, лишь некоторые из них хорошо охарактеризованы. Многие из них были обнаружены в атмосфере и считаются особенно важными в морском пограничном слое. [1]
| Молекулярная формула | I 2 O | IO [3] | IO 2 | И 2 О 4 | И 2 О 5 | I 4 O 9 |
|---|---|---|---|---|---|---|
| Имя | оксид дииода | оксид йода | диоксид йода | четырехокись йода (тетроксид дийода) | Пятиокись йода (пятиокись дийода) | неоксид тетрайода |
| Структура | I 2 O | IO | IO 2 | (IO 2 ) 2 | O (IO 2 ) 2 | I (OIO 2 ) 3 |
| Молекулярная модель | 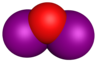 |  |  | 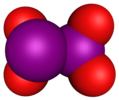 |  | |
| Реестр CAS | 39319-71-6 | 14696-98-1 | 13494-92-3 | 1024652-24-1 | 12029-98-0 | 66523-94-2 |
| Внешность | Неизвестный | пурпурный газ | желтое твердое вещество | желтое твердое вещество | белое кристаллическое твердое вещество | темно-желтое твердое вещество |
| Состояние окисления | +1 | +2 | +4 | +3 и +5 | +5 | +3 и +5 |
| Температура плавления | не изолируемый | не изолируемый | не изолируемый | разложить 100 ° С | разложить 300–350 ° С | разложить 75 ° С |
| Удельный вес | 4.2 | 4.8 | ||||
| Растворимость в воде | разложить в HIO 3 + I 2 | 187 г / 100 мл | разложить в HIO 3 + I 2 |
Моноксид дийода в значительной степени был предметом теоретических исследований [4], но есть некоторые свидетельства того, что он может быть получен аналогично монооксиду дихлора посредством реакции между HgO и I 2 . [5] Соединение крайне нестабильно, но может реагировать с алкенами с образованием галогенированных продуктов. [6]
Радикальный оксид йода (IO), диоксид йода (IO 2 ) и тетроксид йода ((IO 2 ) 2 ) - все они обладают значительным и взаимосвязанным химическим составом атмосферы. Они образуются, в очень небольших количествах, на морском пограничном слое по фотоокислении из дийодметан , который получают путем макроводорослью , таких как водоросли , или за счет окисления молекулярного йода, полученной за счет реакции газообразного озона и йодида присутствующих на seasurface. [7] [8] Несмотря на то, что они производятся в небольших количествах (обычно ниже ppt ), они считаются мощными озоноразрушающими веществами. [9] [10]
Diiodine пентоксид (I 2 O 5 ) представляет собой ангидрид из йодной кислоты и только стабильного ангидрида йода оксокислоты .
Ноноксид тетраиода (I 4 O 9 ) был получен путем газофазной реакции I 2 с O 3, но не был широко изучен. [11]
Йодат-анионы [ править ]
Оксиды йода также образуют отрицательно заряженные анионы , которые (связанные с дополнительными катионами) являются компонентами кислот или солей. К ним относятся йодаты и периодаты .
Их сопряженные кислоты :
| Степень окисления йода | −1 | +1 | +3 | +5 | +7 |
|---|---|---|---|---|---|
| Имя | Йодоводород * | Гипойодистая кислота | Йодистая кислота | Йодная кислота | Периодическая кислота |
| Формула | ЗДРАВСТВУЙ | HIO | HIO 2 | HIO 3 | HIO 4 или H 5 IO 6 |
• Степень окисления -1, йодистый водород, не является оксидом, но он включен в эту таблицу для полноты картины.
Периодаты включают два варианта: метапериодат IO.-
4и ортопериодат IO5-
6.
См. Также [ править ]
- Фтористый кислород
- Оксид хлора
- Оксид брома
Ссылки [ править ]
- ^ Кальцояннис, Николай; Самолет, Джон MC (2008). «Квантово-химические расчеты по выбору йодсодержащих веществ (IO, OIO, INO3, (IO) 2, I2O3, I2O4 и I2O5), важных в атмосфере». Физическая химия Химическая физика . 10 (13): 1723–33. Bibcode : 2008PCCP ... 10.1723K . DOI : 10.1039 / B715687C . PMID 18350176 .
- ^ Лида, DR, изд. (2005). CRC Справочник по химии и физике (86-е изд.). Бока-Ратон (Флорида): CRC Press. ISBN 0-8493-0486-5.
- ↑ Никитин, И.В. (31 августа 2008 г.). «Монооксиды галогена». Российские химические обзоры . 77 (8): 739–749. Bibcode : 2008RuCRv..77..739N . DOI : 10,1070 / RC2008v077n08ABEH003788 .
- ↑ Новак, Игорь (1998). «Теоретическое исследование I2O». Химия гетероатомов . 9 (4): 383–385. DOI : 10.1002 / (SICI) 1098-1071 (1998) 9: 4 <383 :: AID-HC6> 3.0.CO; 2-9 .
- ^ Форбс, Крейг П .; Гусен, Андре; Лауэ, Хью А.Х. (1974). «Гипойодитовая реакция: кинетическое исследование реакции 1,1-дифенилэтилена с оксидом ртути (II) и йодом». Журнал химического общества, Perkin Transactions 1 : 2350–2353. DOI : 10.1039 / P19740002350 .
- ^ Камби, Ричард С .; Хейворд, Родни С.; Линдси, Барри Дж .; Фан, Алиса ИТ; Ратледж, Питер С .; Вудгейт, Пол Д. (1976). «Реакции оксида йода с алкенами». Журнал Химического Общества, Perkin Сделка 1 (18): 1961. DOI : 10.1039 / P19760001961 .
- ^ Хоффманн, Торстен; О'Дауд, Колин Д.; Сайнфелд, Джон Х. (15 мая 2001 г.). «Гомогенное зародышеобразование оксида йода: объяснение прибрежного производства новых частиц» (PDF) . Письма о геофизических исследованиях . 28 (10): 1949–1952. Bibcode : 2001GeoRL..28.1949H . DOI : 10.1029 / 2000GL012399 .
- ^ Карпентер, Люси Дж .; MacDonald, Samantha M .; Шоу, Марвин Д .; Кумар, Рави; Сондерс, Рассел В .; Партипан, Раджендран; Уилсон, Джули; Самолет, Джон MC (13 января 2013 г.). «Уровни содержания йода в атмосфере под влиянием выбросов неорганического йода на поверхность моря» (PDF) . Природа Геонауки . 6 (2): 108–111. Bibcode : 2013NatGe ... 6..108C . DOI : 10.1038 / ngeo1687 .
- ^ Saiz-Lopez, A .; Фернандес, РП; Ordóñez, C .; Kinnison, DE; Гомес Мартин, JC; Lamarque, J.-F .; Тильмес, С. (10 декабря 2014 г.). «Химия йода в тропосфере и его влияние на озон» . Химия и физика атмосферы . 14 (23): 13119–13143. Bibcode : 2014ACP .... 1413119S . DOI : 10,5194 / ACP-14-13119-2014 .
- ^ Кокс, РА; Блосс, WJ; Джонс, Р.Л .; Роули, DM (1 июля 1999 г.). «OIO и атмосферный цикл йода» (PDF) . Письма о геофизических исследованиях . 26 (13): 1857–1860. Bibcode : 1999GeoRL..26.1857C . DOI : 10.1029 / 1999GL900439 .
- ^ Сандер, S .; Wren, JC; Викис, AC (декабрь 1985 г.). «Рамановские спектры I4O9, образованного реакцией иода с озоном». Журнал Рамановской спектроскопии . 16 (6): 424–426. Bibcode : 1985JRSp ... 16..424S . DOI : 10.1002 / jrs.1250160611 .