| Железный ответный элемент | |
|---|---|
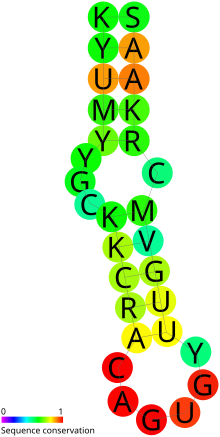 Прогнозируемая вторичная структура и сохранение последовательности IRE | |
| Идентификаторы | |
| Символ | IRE |
| Рфам | RF00037 |
| Прочие данные | |
| Тип РНК | Снг |
| Домен (ы) | Эукариоты |
| ТАК | ТАК: 0000233 |
| Структуры PDB | PDBe |
В молекулярной биологии элемент ответа на железо или элемент ответа на железо ( IRE ) представляет собой короткую консервативную стержневую петлю, которая связана с белками ответа на железо (IRP, также называемыми IRE-BP или IRBP). IRE находится в UTR (нетранслируемых областях) различных мРНК , продукты которых участвуют в метаболизме железа . Например, мРНК ферритина (запасного белка железа) содержит один IRE в своей 5 'UTR . Когда концентрация железа низкая, IRP связывают IRE в мРНК ферритина и вызывают снижение скорости трансляции. Напротив, привязка к нескольким IRE в3' UTR из рецептора трансферрина (участвуют в приобретении железа) приводит к увеличению стабильности мРНК.
Две ведущие теории описывают, как железо, вероятно, взаимодействует, влияя на посттрансляционный контроль транскрипции. Классическая теория предполагает, что IRP в отсутствие железа активно связываются с мРНК IRE. Когда присутствует железо, оно взаимодействует с белком, заставляя его высвобождать мРНК. Например, в условиях высокого содержания железа у человека IRP1 связывается с комплексом железо-сера [4Fe-4S] и принимает конформацию аконитазы, непригодную для связывания IRE. Напротив, IRP2 разлагается в условиях высокого содержания железа. [2] Существует различие в сходстве между разными IRE и разными IRP. [3]На некоторые IRE также может повлиять альтернативный сплайсинг генов. Согласно второй теории, за сайт связывания IRE конкурируют два белка - IRP и фактор инициации эукариот F4 (eIFF4). В отсутствие железа IRP связывается примерно в 10 раз сильнее, чем фактор инициации. Однако, когда железо взаимодействует с IRE, оно заставляет мРНК изменять свою форму, тем самым способствуя связыванию eIFF4. [4] Несколько исследований выявили неканонические IRE. [5] Также было показано, что IRP связывается с некоторыми IRE лучше, чем с другими. [6]
Верхняя спираль известных IRE показывает более сильную сохранность структуры по сравнению с нижней спиралью. Основания, составляющие спирали, различны. Выпуклый C в середине стебля - очень характерная особенность (хотя это было замечено как G в ферритиновом IRE для лобстера). [7] Апикальная петля известных IRE состоит из триплета AGA или AGU. Он зажат парным GC, и в верхней спирали дополнительно имеется выпуклая U, C или A. Кристаллическая структура и данные ЯМР показывают выпуклую букву U в нижней части ферритина IRE. [8] Это согласуется с предсказанной вторичной структурой. IRE во многих других мРНК не поддерживают эту выпуклую U. Следовательно, две модели RFAM [9] были созданы для IRE - один с выпуклой буквой U и один без.
Гены, которые, как известно, содержат IRE, включают FTH1 , [10] FTL , [11] TFRC , [12] ALAS2 , [13] Sdhb, [14] ACO2 , [15] Hao1, [16] SLC11A2 (кодирует DMT1), [3] NDUFS1, [17] SLC40A1 (кодирующий ферропортин) [18] CDC42BPA , [19] CDC14A , [20] EPAS1 . [21]Многие из этих генов играют четкую и прямую роль в метаболизме железа. Другие показывают менее очевидную связь. ACO2 кодирует изомеразу, катализирующую обратимую изомеризацию цитрата и изоцитрата . [22] EPAS1 кодирует фактор транскрипции, участвующий в сложных путях восприятия кислорода путем индукции регулируемых кислородом генов в условиях низкого содержания кислорода. [23] CDC42BPA кодирует киназу, играющую роль в реорганизации цитоскелета. [24] CDC14A кодирует фосфатазу с двойной специфичностью, участвующую в контроле клеточного цикла [25], а также взаимодействует с интерфазными центросомами. [26]
Было показано, что у человека 12 генов транскрибируются с канонической структурой IRE, но было показано, что несколько структур мРНК, которые не являются каноническими, взаимодействуют с IRP и на них влияет концентрация железа. Программное обеспечение и алгоритмы были разработаны для обнаружения большего количества генов, которые также реагируют на концентрацию железа. [27]
IRE встречается в широком таксономическом диапазоне - в основном у эукариот, но не у растений. [28]
См. Также [ править ]
- 5'UTR
- IRP
Ссылки [ править ]
- ^ Уильям Э. Уолден; Анна Ивановна Селезнева; Жером Дюпюи; Анне Вольбеда; Хуан К. Фонтесилла-Кэмпс; Элизабет К. Тейл и Карл Фольц (декабрь 2006 г.). «Структура двойного функционального регуляторного белка железа 1 в комплексе с IRE-РНК ферритина». Наука . 314 (5807): 1903–1908. DOI : 10.1126 / science.1133116 . PMID 17185597 . S2CID 26572367 .
- ^ Мартина У. Макенталер ; Бруно Гали и Маттиас В. Хентце (2008). «Системный гомеостаз железа и регуляторная сеть железо-чувствительных элементов / железо-регуляторных белков (IRE / IRP)». Ежегодный обзор питания . 28 : 197–213. DOI : 10.1146 / annurev.nutr.28.061807.155521 . PMID 18489257 .
- ^ а б Х. Гуншин ; CR Allerson ; М. Поликарпу-Шварц ; А. Рофтс ; Дж. Т. Роджерс ; Ф. Киши ; MW Hentze ; Т.А. Руо ; NC Andrews и MA Hediger (декабрь 2001 г.). «Железозависимая регуляция переносчика ионов двухвалентного металла» . Письма FEBS . 509 (2): 309–316. DOI : 10.1016 / s0014-5793 (01) 03189-1 . PMID 11741608 .
- ^ Ма, Цзя; Халдар, Суранджана; Хан, Матин А .; Шарма, Сохани Дас; Меррик, Уильям С .; Theil, Elizabeth C .; Госс, Дикси Дж. (29 мая 2012 г.). «Fe2 + связывает реагирующий на железо элемент-РНК, избирательно изменяя аффинность связывания с белками и регулируя репрессию и активацию мРНК» . Труды Национальной академии наук . 109 (22): 8417–8422. DOI : 10.1073 / pnas.1120045109 . ISSN 0027-8424 . PMC 3365203 . PMID 22586079 .
- ^ Campillos, M .; Случаи, I .; Hentze, MW; Санчес, М. (01.07.2010). «SIREs: поиск элементов, реагирующих на железо» . Исследования нуклеиновых кислот . 38 (веб-сервер): W360 – W367. DOI : 10.1093 / NAR / gkq371 . ISSN 0305-1048 . PMC 2896125 . PMID 20460462 .
- ^ Хан, Массачусетс; Ma, J .; Уолден, МЫ; Меррик, WC; Theil, EC; Госс, диджей (02.06.2014). «Быстрая кинетика железо-чувствительного элемента (IRE) РНК / регуляторный белок железа 1 и комплексы IRE-РНК / eIF4F по-разному реагируют на ионы металлов» . Исследования нуклеиновых кислот . 42 (10): 6567–6577. DOI : 10.1093 / NAR / gku248 . ISSN 0305-1048 . PMC 4041422 . PMID 24728987 .
- ^ Т.С. Хуанг ; О. Мелефорс ; М. И. Линд и К. Содерхолл (январь 1999 г.). «Атипичный железо-чувствительный элемент (IRE) в мРНК ферритина раков и железо-регуляторный белок 1 (IRP1) -подобный белок из гепатопанкреаса рака». Биохимия и молекулярная биология насекомых . 29 (1): 1–9. DOI : 10.1016 / S0965-1748 (98) 00097-6 . PMID 10070739 .
- ^ KJ Addess ; JP Basilion ; Р. Д. Клаузнер ; Т.А. Руо и А. Парди (ноябрь 1997 г.). «Структура и динамика РНК элемента, ответственного за железо: значение для связывания РНК белками, регулирующими связывание железа». Журнал молекулярной биологии . 274 (1): 72–83. DOI : 10.1006 / jmbi.1997.1377 . PMID 9398517 .
- Перейти ↑ Stevens SG, Gardner PP, Brown C (сентябрь 2011 г.). «Две ковариационные модели для элементов, чувствительных к железу» . Биология РНК . 8 (5): 792–801. DOI : 10,4161 / rna.8.5.16037 . PMID 21881407 .
- ^ MW Hentze ; SW Caughman ; Т.А. Руо ; JG Barriocanal ; А. Дансис ; Дж. Б. Харфорд и Р. Д. Клауснер (декабрь 1987 г.). «Идентификация чувствительного к железу элемента для регуляции трансляции мРНК ферритина человека» . Наука . 238 (4833): 1570–1573. DOI : 10.1126 / science.3685996 . PMID 3685996 .
- ^ Н. Азиз и HN Манро (декабрь 1987). «Железо регулирует трансляцию мРНК ферритина через сегмент его 5'-нетранслируемой области» . Труды Национальной академии наук Соединенных Штатов Америки . 84 (23): 8478–8482. DOI : 10,1073 / пнас.84.23.8478 . PMC 299567 . PMID 3479802 .
- ^ DM Koeller ; JL Кейси ; MW Hentze ; Э.М. Герхардт ; Л.Н. Чан ; Р. Д. Клауснер и Дж. Б. Харфорд (май 1989 г.). «Цитозольный белок связывается со структурными элементами в регуляторной области железа мРНК рецептора трансферрина» . Труды Национальной академии наук Соединенных Штатов Америки . 86 (10): 3574–3578. DOI : 10.1073 / pnas.86.10.3574 . PMC 287180 . PMID 2498873 .
- ↑ Т. Дандекар ; Р. Стрипеке ; Н.К. Серый ; Б. Гуссен ; А. Констебль ; Е.П. Йоханссон и М.В. Хентце (июль 1991 г.). «Идентификация нового чувствительного к железу элемента в мРНК дельта-аминолевулиновой кислоты синтазы эритроидов мышей и человека» . Журнал EMBO . 10 (7): 1903–1909. DOI : 10.1002 / j.1460-2075.1991.tb07716.x . PMC 452865 . PMID 2050126 .
- ^ С. А. Колер ; Б. Р. Хендерсон и Л. К. Кун (декабрь 1995 г.). «МРНК сукцинатдегидрогеназы b Drosophila melanogaster имеет функциональный железо-чувствительный элемент в его 5'-нетранслируемой области» . Журнал биологической химии . 270 (51): 30781–30786. DOI : 10.1074 / jbc.270.51.30781 . PMID 8530520 .
- ^ Н.К. Грей ; К. Пантопулос ; Т. Дандекар ; BA Ackrell и MW Hentze (май 1996 г.). «Трансляционная регуляция ферментов цикла лимонной кислоты млекопитающих и дрозофилы через железо-чувствительные элементы» . Труды Национальной академии наук Соединенных Штатов Америки . 93 (10): 4925–4930. DOI : 10.1073 / pnas.93.10.4925 . PMC 39381 . PMID 8643505 .
- ^ С. А. Колер ; Э. Менотти и Л. К. Кун (январь 1999 г.). «Молекулярное клонирование гликолатоксидазы мыши. Высокая эволюционная консервация и наличие последовательности, подобной чувствительному к железу элементу, в мРНК» . Журнал биологической химии . 274 (4): 2401–2407. DOI : 10.1074 / jbc.274.4.2401 . PMID 9891009 .
- ^ Э. Линь ; Дж. Х. Грациано и Г. А. Фрейер (июль 2001 г.). «Регулирование 75-кДа субъединицы митохондриального комплекса I железом» . Журнал биологической химии . 276 (29): 27685–27692. DOI : 10.1074 / jbc.M100941200 . PMID 11313346 .
- ^ Афина Лимбусаки ; Элиза Пигнатти ; Джулиана Монтози ; Чинция Гарути ; Дэвид Дж. Хайле и Антонелло Пьетранджело (ноябрь 2003 г.). «Роль чувствительного к железу элемента в контроле экспрессии гена ferroportin1 / IREG1 / MTP1». Журнал гепатологии . 39 (5): 710–715. DOI : 10.1016 / S0168-8278 (03) 00408-2 . PMID 14568251 .
- ^ Радек Смейла ; Иржи Петрак и Яна Чмейлова (март 2006 г.). «Новый элемент, реагирующий на железо в 3'UTR MRCKalpha человека». Сообщения о биохимических и биофизических исследованиях . 341 (1): 158–166. DOI : 10.1016 / j.bbrc.2005.12.155 . PMID 16412980 .
- ^ Майка Санчес ; Бруно Гали ; Томас Дандекар ; Питер Бенгерт ; Евгений Вайнштейн ; Йенс Столте ; Мартина У. Мукенталер и Маттиас У. Хентце (август 2006 г.). «Регуляция железа и клеточный цикл: идентификация чувствительного к железу элемента в 3'-нетранслируемой области мРНК 14A цикла деления клеток человека с помощью усовершенствованной стратегии скрининга на основе микрочипов» . Журнал биологической химии . 281 (32): 22865–22874. DOI : 10.1074 / jbc.M603876200 . PMID 16760464 .
- ^ Майка Санчес ; Бруно Гали ; Мартина У. Мукенталер и Маттиас У. Хентце (май 2007 г.). «Белки, регулирующие железо, ограничивают индуцируемую гипоксией экспрессию фактора-2альфа при дефиците железа». Структурная и молекулярная биология природы . 14 (5): 420–426. DOI : 10.1038 / nsmb1222 . PMID 17417656 . S2CID 37819604 .
- ^ MJ Gruer ; PJ Artymiuk & JR Guest (январь 1997 г.). «Семейство аконитаз: три структурных вариации на общую тему». Направления биохимических наук . 22 (1): 3–6. DOI : 10.1016 / S0968-0004 (96) 10069-4 . PMID 9020582 .
- ^ Амар Дж. Маджмундар ; Вайхай Дж. Вонг и М. Селеста Саймон (октябрь 2010 г.). «Факторы, индуцируемые гипоксией и реакция на гипоксический стресс» . Молекулярная клетка . 40 (2): 294–309. DOI : 10.1016 / j.molcel.2010.09.022 . PMC 3143508 . PMID 20965423 .
- ^ T. Leung ; XQ Chen ; I. Tan ; Э. Мансер и Л. Лим (январь 1998 г.). «Связанная с миотонической дистрофией киназа Cdc42-связывающая киназа действует как эффектор Cdc42, способствуя реорганизации цитоскелета» . Молекулярная и клеточная биология . 18 (1): 130–140. DOI : 10.1128 / mcb.18.1.130 . PMC 121465 . PMID 9418861 .
- ^ J. Bembenek & H. Ю. (декабрь 2001). «Регулирование комплекса, стимулирующего анафазу, с помощью фосфатазы с двойной специфичностью Cdc14a человека» . Журнал биологической химии . 276 (51): 48237–48242. DOI : 10.1074 / jbc.M108126200 . PMID 11598127 .
- ^ Нильс Мэйланд ; Клаудиа Лукас ; Бретт К. Кайзер ; Питер К. Джексон ; Иржи Бартек и Иржи Лукас (апрель 2002 г.). «Дерегулированная человеческая фосфатаза Cdc14A нарушает разделение центросом и сегрегацию хромосом». Природа клеточной биологии . 4 (4): 317–322. DOI : 10.1038 / ncb777 . PMID 11901424 . S2CID 28955777 .
- ^ Кампильос, Моника; Случаи, Ильдефонсо; Hentze, Matthias W .; Санчес, Майка (01.07.2010). «SIREs: поиск элементов, реагирующих на железо» . Исследования нуклеиновых кислот . 38 (выпуск веб-сервера): W360 – W367. DOI : 10.1093 / NAR / gkq371 . ISSN 0305-1048 . PMC 2896125 . PMID 20460462 .
- ^ R. Leipuviene & EC Theil (ноябрь 2007). «Семейство структур РНК, реагирующих на железо, регулируемых изменениями клеточного железа и кислорода». Клеточные и молекулярные науки о жизни . 64 (22): 2945–2955. DOI : 10.1007 / s00018-007-7198-4 . PMID 17849083 . S2CID 30770865 .
Внешние ссылки [ править ]
- Страница для ответного элемента железа - Модель I в Rfam
- Страница для железного ответного элемента - Модель II в Rfam
- Страница Transterm для Iron Responsive Element
- Файлы геномных интервалов с прогнозами IRE, сделанными с использованием моделей RFAM на геноме человека hg18
- Сервер прогнозирования отзывчивых элементов Iron
