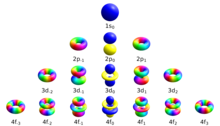Эта статья требует дополнительных ссылок для проверки . ( май 2016 г. ) ( Узнайте, как и когда удалить это сообщение-шаблон ) |
Магнитное квантовое число (символ м л ) является одним из четырех квантовых чисел в атомной физике . Набор: главное квантовое число , азимутальное квантовое число , магнитное квантовое число и спиновое квантовое число . Вместе они описывают уникальное квантовое состояние в качестве электрона . Магнитное квантовое число отличает орбитали, доступные в подоболочке , и используется для вычисления азимутального компонента ориентации орбитали в пространстве. Электроны в определенной подоболочке (например, s, p, d или f) определяются значениями ℓ(0, 1, 2 или 3). Значение m l может находиться в диапазоне от - ℓ до + ℓ , включая ноль. Таким образом, подоболочки s, p, d и f содержат 1, 3, 5 и 7 орбиталей каждая со значениями m в диапазонах 0, ± 1, ± 2, ± 3 соответственно. Каждая из этих орбиталей может вместить до двух электронов (с противоположными спинами), составляющих основу периодической таблицы .
Вывод [ править ]
Есть набор квантовых чисел, связанных с энергетическими состояниями атома. Четыре квантовых чисел , , и [ сомнительное ] указать полное и уникальное квантовое состояние одного электрона в атоме называется его волновым или орбитальными . Уравнение Шредингера для волновой функции атома с одним электроном является разделимым уравнением в частных производных . (Это не относится к атому гелия или другим атомам с взаимно взаимодействующими электронами, для решения которых требуются более сложные методы [1] ) Это означает, что волновая функция, выраженная в сферических координатах, может быть разбита на произведение трех функций: радиуса, широты (или полярного) угла и азимута: [2]
Дифференциальное уравнение для решается в виде . Поскольку значения азимутального угла, отличающиеся на 2 (360 градусов в радианах ), представляют одно и то же положение в пространстве, а общая величина не увеличивается с произвольно большим, как это было бы для действительной экспоненты, коэффициент должен быть квантован до целых кратных , производя мнимый экспоненту : . [3] Эти целые числа являются магнитными квантовыми числами. Та же самая константа появляется в уравнении ширины, где большие значения 2 имеют тенденцию к уменьшению величины , а значения больше, чемазимутальное квантовое число не позволяет решить проблему .
| Связь между квантовыми числами | |||
|---|---|---|---|
| Орбитальный | Значения | Количество значений для [4] | Электронов на подоболочку |
| s | 1 | 2 | |
| п | 3 | 6 | |
| d | 5 | 10 | |
| ж | 7 | 14 | |
| грамм | 9 | 18 | |
Как компонент углового момента [ править ]
Ось, используемая для полярных координат в этом анализе, выбрана произвольно. Квантовое число относится к проекции углового момента в этом произвольно выбранном направлении, обычно называемом -направлением или осью квантования . , величина углового момента в -направлении определяется по формуле: [4]
- .
Это компонент полного орбитального углового момента атомного электрона , величина которого связана с азимутальным квантовым числом его подоболочки уравнением:
- ,
где - приведенная постоянная Планка . Обратите внимание , что это для и аппроксимирует для максимума . Невозможно одновременно измерить угловой момент электрона по всем трем осям. Эти свойства были впервые продемонстрированы в опыте Штерна-Герлах , с Отто Стерномом и Walther Gerlach . [5]
Энергия любой волны - это ее частота, умноженная на постоянную Планка. Волна отображает пакеты энергии, похожие на частицы, называемые квантами . Формула для квантового числа каждого квантового состояния использует приведенную постоянную Планка, которая допускает только определенные, дискретные или квантованные уровни энергии. [4]
Эффект в магнитных полях [ править ]
Квантовое число в общих чертах относится к направлению вектора углового момента . Магнитное квантовое число влияет на энергию электрона, только если он находится в магнитном поле, потому что в его отсутствие все сферические гармоники, соответствующие различным произвольным значениям , эквивалентны. Магнитное квантовое число определяет энергетический сдвиг атомной орбитали из-за внешнего магнитного поля ( эффект Зеемана ) - отсюда и название магнитного квантового числа. Однако реальный магнитный дипольный момент электрона на атомной орбитали возникает не только из углового момента электрона, но и из его спина, выраженного в спиновое квантовое число .
Поскольку каждый электрон имеет магнитный момент в магнитном поле, он будет подвергаться действию крутящего момента, который стремится сделать вектор параллельным полю, явление, известное как ларморовская прецессия .
См. Также [ править ]
- Квантовое число
- Азимутальное квантовое число
- Главное квантовое число
- Спиновое квантовое число
- Квантовое число полного углового момента
- Электронная оболочка
- Основы квантовой механики
- Атом Бора
- Уравнение Шредингера
Ссылки [ править ]
- ^ "Атом гелия" . 2010-07-20.
- ^ «Уравнение Шредингера водорода» . hyperphysics.phy-astr.gsu.edu .
- ^ «Уравнение Шредингера водорода» . hyperphysics.phy-astr.gsu.edu .
- ^ a b c Герцберг, Герхард (1950). Молекулярные спектры и молекулярная структура (2-е изд.). Компания D van Nostrand. С. 17–18.
- ^ «Спектроскопия: квантовое число углового момента» . Британская энциклопедия.