Материнский эффект является ситуация , когда фенотип организма определяется не только окружающей среды , она испытывает и его генотип , но и окружающей среды и генотипа матери. В генетике материнские эффекты возникают, когда организм демонстрирует фенотип, ожидаемый от генотипа матери, независимо от его собственного генотипа, часто из-за того, что мать поставляет информационную РНК или белки.к яйцу. Материнские эффекты также могут быть вызваны материнской средой, независимой от генотипа, иногда контролирующей размер, пол или поведение потомства. Эти адаптивные материнские эффекты приводят к фенотипам потомства, которые повышают их физическую форму. Кроме того, вводится концепция фенотипической пластичности , важная эволюционная концепция. Было высказано предположение, что материнские эффекты важны для эволюции адаптивных реакций на неоднородность окружающей среды.
В генетике [ править ]
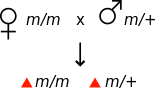
В генетике материнский эффект возникает, когда фенотип организма определяется генотипом его матери. [1] Например, если мутация является рецессивной по материнскому эффекту , то самка, гомозиготная по мутации, может казаться фенотипически нормальной, однако ее потомство будет демонстрировать мутантный фенотип, даже если они гетерозиготны по мутации.
| Материнский эффект | |||
|---|---|---|---|
| Все потомки демонстрируют фенотип дикого типа. | Все потомки демонстрируют мутантный фенотип | ||
Материнские эффекты часто возникают из-за того, что мать поставляет определенную мРНК или белок в ооцит, поэтому материнский геном определяет, является ли молекула функциональной. Материнская поставка мРНК раннему эмбриону важна, так как у многих организмов эмбрион изначально транскрипционно неактивен. [2] Из-за характера наследования мутаций, вызывающих материнский эффект, для их выявления требуются специальные генетические исследования. Обычно они включают изучение фенотипа организмов на одно поколение позже, чем при обычном (зиготическом) скрининге, поскольку их матери будут потенциально гомозиготными в отношении возникающих мутаций с материнским эффектом. [3] [4]
В раннем эмбриогенезе дрозофилы [ править ]
Дрозофилы ооциты развиваются в камере яйца в тесной связи с набором клеток , называемых трофоцитами . И ооцит, и кормящие клетки происходят от одной стволовой клетки зародышевой линии , однако цитокинез в этих клеточных делениях является неполным , и цитоплазма кормящих клеток и ооцита соединена структурами, известными как кольцевые каналы . [5] Только ооцит подвергается мейозу и вносит ДНК в следующее поколение.
Было обнаружено множество мутантов Drosophila с материнским эффектом , которые влияют на ранние стадии эмбриогенеза, такие как определение оси , включая бикоид , дорсальный , гуркен и оскар . [6] [7] [8] Например, эмбрионы от гомозиготных бикоидных матерей не могут образовывать структуры головы и грудной клетки .
После того, как ген, нарушенный в бикоидном мутанте, был идентифицирован, было показано, что бикоидная мРНК транскрибируется в питающих клетках, а затем перемещается в ооцит. [9] Другие мутанты с материнским эффектом воздействуют либо на продукты, которые аналогичным образом продуцируются в клетках-медсестрах и действуют в ооците, либо на части транспортных механизмов, необходимых для этого перемещения. [10] Поскольку эти гены экспрессируются в (материнских) питательных клетках, а не в ооците или оплодотворенном эмбрионе, материнский генотип определяет, могут ли они функционировать.
Гены материнского эффекта [11] экспрессируются во время оогенеза матерью (экспрессируются до оплодотворения) и развивают передне-заднюю и дорсально-вентральную полярность яйца. Передний конец яйца становится головой; задний конец становится хвостом. дорсальная сторона находится сверху; вентральная сторона находится внизу. Продукты генов материнского эффекта, называемые материнскими мРНК, вырабатываются питательными клетками и фоллитическими клетками и откладываются в яйцеклетках (ооцитах). В начале процесса развития в ооцитах формируются градиенты мРНК по передне-задней и дорсально-вентральной осям.
Идентифицировано около тридцати материнских генов, участвующих в формировании паттерна. В частности, продукты четырех генов материнского эффекта имеют решающее значение для формирования передне-задней оси. Продукт двух генов материнского эффекта, bicoid и hunchback, регулирует формирование передней структуры, в то время как другая пара nanos и caudal определяет белок, который регулирует формирование задней части эмбриона.
Транскрипт всех четырех генов - бикоидного, горбатого, каудального и наноразмерного - синтезируются медсестрами и фолликульными клетками и переносятся в ооциты.
У птиц [ править ]
У птиц матери могут передавать в яйцах гормоны, которые влияют на рост и поведение потомства. Эксперименты на домашних канарейках показали, что яйца, содержащие больше андрогенов желтка, превращаются в цыплят, которые демонстрируют большее социальное доминирование. Подобные вариации в уровнях андрогенов в желтке наблюдались у таких видов птиц, как американская лысуха , хотя механизм воздействия еще не установлен. [12]
У людей [ править ]
В 2015 году теоретик ожирения Эдвард Арчер опубликовал «Эпидемия детского ожирения как результат негенетической эволюции: гипотеза материнских ресурсов» и серию работ о влиянии матери на ожирение и здоровье человека. [13] [14] [15] [16] В этой работе Арчер утверждал, что кумулятивные материнские эффекты в результате негенетической эволюции метаболизма питательных веществ по материнской линии ответственны за глобальную распространенность ожирения и сахарного диабета 2 типа . Арчер предположил, что снижение материнского метаболического контроля изменяет бета-клетки поджелудочной железы плода , адипоциты (жировые клетки) и миоциты. (мышечных клеток), тем самым вызывая устойчивое конкурентное преимущество адипоцитов в приобретении и секвестре питательной энергии.
Материнские эффекты окружающей среды [ править ]
Окружающая среда или состояние матери также могут в некоторых ситуациях влиять на фенотип ее потомства, независимо от генотипа потомства.
Гены отцовского эффекта [ править ]
Напротив, отцовский эффект возникает, когда фенотип является результатом генотипа отца, а не генотипа индивидуума. [17] Гены, ответственные за эти эффекты, являются компонентами сперматозоидов , которые участвуют в оплодотворении и раннем развитии. [18] Примером отцовского гена является ms (3) скрытый у дрозофилы . Самцы с мутантным аллелем этого гена производят сперматозоиды, способные оплодотворять яйцеклетку, но яйца, оплодотворенные незаметно, не развиваются нормально. Однако самки с этой мутацией производят яйца, которые при оплодотворении развиваются нормально. [19]
Адаптивные материнские эффекты [ править ]
Адаптивные материнские эффекты вызывают фенотипические изменения у потомства, которые приводят к повышению приспособленности. [20] Эти изменения возникают из-за того, что матери чувствуют сигналы окружающей среды, которые работают на снижение приспособленности потомства, а затем реагируют на них таким образом, чтобы затем «подготавливать» потомство к будущей окружающей среде. Ключевой характеристикой фенотипов с «адаптивными материнскими эффектами» является их пластичность. Фенотипическая пластичность дает организмам способность реагировать на различные среды, изменяя свой фенотип. С этими «измененными» фенотипами, повышающими приспособленность, становится важным посмотреть на вероятность того, что адаптивные материнские эффекты будут развиваться и станут значительной фенотипической адаптацией к окружающей среде.
Определение адаптивных материнских эффектов [ править ]
Когда на черты влияет либо материнская среда, либо материнский фенотип, говорят, что на них влияют материнские эффекты. Материнские эффекты воздействуют на изменение фенотипов потомства через другие пути помимо ДНК. [21] Адаптивные материнские эффекты - это когда эти материнские влияния приводят к фенотипическому изменению, которое увеличивает приспособленность потомства. [22] В общем, адаптивные материнские эффекты - это механизм, позволяющий справиться с факторами, снижающими приспособленность потомства; [23] они также зависят от окружающей среды.
Иногда бывает трудно отличить материнский эффект от адаптивного. Примите во внимание следующее: у цыганской моли, выращенной на листве черного дуба, а не каштанового, потомство развивалось быстрее. [24] Это материнский, а не адаптивный материнский эффект. Чтобы обеспечить адаптивный материнский эффект, окружающая среда матери должна была привести к изменению пищевых привычек или поведения потомства. [24]Таким образом, ключевое различие между ними заключается в том, что адаптивные материнские эффекты зависят от окружающей среды. Возникающие фенотипы являются ответом на то, что мать ощущает среду, которая снижает приспособленность ее потомства. Принимая во внимание эту среду, она затем может изменять фенотипы, чтобы на самом деле улучшить приспособленность потомства. Материнские эффекты не являются ответом на сигнал окружающей среды, и, кроме того, они могут повысить приспособленность потомства, но не могут.
При рассмотрении вероятности развития этих «измененных» фенотипов учитывается множество факторов и сигналов. Адаптивные материнские эффекты развиваются только тогда, когда потомство может столкнуться с множеством потенциальных сред; когда мать может «предсказать» среду, в которой родится ее потомство; и когда мать может влиять на фенотип своего потомства, тем самым повышая его физическую форму. [24] Суммирование всех этих факторов может привести к тому, что эти «измененные» черты станут благоприятными для эволюции.
Фенотипические изменения, возникающие в результате адаптивных материнских эффектов, являются результатом ощущения матери, что определенный аспект окружающей среды может снизить выживаемость ее потомства. Улавливая сигнал, мать «передает» информацию развивающемуся потомству и, следовательно, вызывает адаптивные материнские эффекты. Это, как правило, приводит к тому, что потомство становится более приспособленным, поскольку оно «подготовлено» к окружающей среде, в которой они, вероятно, окажутся. [23] Эти сигналы могут включать в себя реакцию на хищников, среду обитания, высокую плотность населения и доступность пищи [25] [26] [27]
Увеличение размера североамериканских красных белок - отличный пример адаптивного материнского эффекта, порождающего фенотип, который привел к повышению приспособленности. Адаптивный материнский эффект был вызван тем, что матери почувствовали высокую плотность населения и связали ее с низкой доступностью пищи на человека. Ее потомство было в среднем крупнее других белок того же вида; они тоже росли быстрее. В конечном итоге белки, родившиеся в этот период высокой плотности населения, показали повышенную выживаемость (и, следовательно, приспособленность) в течение своей первой зимы. [25]
Фенотипическая пластичность [ править ]
При анализе типов изменений, которые могут произойти с фенотипом, мы можем увидеть изменения, которые являются поведенческими, морфологическими или физиологическими. Характерной чертой фенотипа, возникающего в результате адаптивных материнских эффектов, является пластичность этого фенотипа. Фенотипическая пластичность позволяет организмам приспосабливать свой фенотип к различным условиям окружающей среды, тем самым повышая их приспособленность к изменяющимся условиям окружающей среды. [23] В конечном итоге это ключевой атрибут способности организма и популяции адаптироваться к краткосрочным изменениям окружающей среды. [28] [29]
Фенотипическую пластичность можно увидеть у многих организмов, один из видов, который иллюстрирует эту концепцию, - это жук-семенной жук Stator limbatus . Этот семенной жук размножается на разных растениях-хозяевах, два из которых наиболее распространены - Cercidium floridum и Acacia greggii . Когда C. floridum является растением-хозяином, проводится селекция на яйца большого размера; когда A. greggii является растением-хозяином, есть выбор для яиц меньшего размера. В эксперименте было замечено, что когда жук, который обычно откладывал яйца на A. greggii, был помещен на C. floridum , выживаемость отложенных яиц была ниже по сравнению с яйцами, произведенными жуком, который был кондиционирован и оставался наХозяин C. florium . В конечном итоге эти эксперименты показали пластичность размеров яиц у жука, а также влияние материнской среды на выживаемость потомства. [26]
Дополнительные примеры адаптивных материнских эффектов [ править ]
У многих насекомых:
- Такие сигналы, как быстрое охлаждение или уменьшение дневного света, могут привести к тому, что потомство войдет в состояние покоя. Таким образом, они лучше выдерживают температуру охлаждения и сохраняют энергию. [30]
- Когда родители вынуждены откладывать яйца в среде с низким содержанием питательных веществ, потомство будет обеспечено большим количеством ресурсов, таких как более питательные вещества, за счет увеличения размера яиц. [26]
- Такие признаки, как плохая среда обитания или теснота, могут привести к появлению потомства с крыльями. Крылья позволяют потомству перемещаться из плохой среды в ту, которая обеспечит лучшие ресурсы. [30]
Питание матери и окружающая среда влияют на эпигенетические эффекты [ править ]
С адаптивными материнскими эффектами связаны эпигенетические эффекты. Эпигенетика - это исследование длительных изменений экспрессии генов, которые вызываются модификациями хроматина, а не изменениями в последовательности ДНК, как это видно при мутации ДНК. Это «изменение» относится к метилированию ДНК , ацетилированию гистонов или взаимодействию некодирующих РНК.с ДНК. Метилирование ДНК - это добавление метильных групп к ДНК. Когда ДНК у млекопитающих метилирована, транскрипция гена в этом месте отключается или полностью отключается. На индукцию метилирования ДНК сильно влияет материнская среда. Некоторые материнские среды могут приводить к более высокому метилированию ДНК потомства, в то время как другие - к более низкому метилированию. [22] [ необходима цитата ] Тот факт, что на метилирование может влиять материнская среда, делает его похожим на адаптивные материнские эффекты. Дальнейшее сходство видно из того факта, что метилирование часто может повысить приспособленность потомства. Кроме того, эпигенетика может относиться к модификациям гистонов или некодирующих РНК, которые создают своего рода клеточную память.. Клеточная память относится к способности клетки передавать негенетическую информацию своей дочерней клетке во время репликации. Например, после дифференцировки клетка печени выполняет другие функции, чем клетка мозга; клеточная память позволяет этим клеткам «помнить», какие функции они должны выполнять после репликации. Некоторые из этих эпигенетических изменений могут передаваться будущим поколениям, в то время как другие обратимы в течение жизни конкретного человека. Это может объяснить, почему люди с идентичной ДНК могут различаться по своей предрасположенности к определенным хроническим заболеваниям.
В настоящее время исследователи изучают корреляцию между питанием матери во время беременности и ее влиянием на восприимчивость потомства к хроническим заболеваниям в более позднем возрасте. Гипотеза программирования плода подчеркивает идею о том, что стимулы окружающей среды в критические периоды развития плода могут оказывать пожизненное воздействие на структуру тела и здоровье и в некотором смысле подготавливают потомство к среде, в которой они родятся. Считается, что многие из этих вариаций связаны с эпигенетическими механизмами, вызванными материнской средой, такими как стресс, диета, гестационный диабет и воздействие табака и алкоголя. Считается, что эти факторы способствуют развитию ожирения и сердечно-сосудистых заболеваний, дефектов нервной трубки, рака, диабета и т. Д. [31] Исследования для определения этих эпигенетических механизмов обычно проводятся с помощью лабораторных исследований на грызунах и эпидемиологических исследований на людях.
Важность для населения в целом [ править ]
Этот раздел требует дополнительных ссылок для проверки . ( Сентябрь 2017 г. ) ( Узнайте, как и когда удалить этот шаблон сообщения ) |
Знание об эпигенетических изменениях, вызванных рационом матери, важно не только для ученых, но и для широкой публики. Возможно, наиболее очевидное значение для влияния питания матери находится в области медицины. В Соединенных Штатах и во всем мире многие неинфекционные заболевания, такие как рак, ожирение и болезни сердца, достигли масштабов эпидемии. В области медицины работают над методами выявления этих заболеваний, некоторые из которых, как было обнаружено, в значительной степени обусловлены эпигенетическими изменениями, вызванными влиянием питания матери. Как только геномные маркеры этих заболеваний будут идентифицированы, можно будет приступить к исследованиям для выявления раннего начала этих заболеваний и, возможно, обратить вспять эпигенетические эффекты материнского питания на более поздних этапах жизни.Обращение эпигенетических эффектов будет использовать фармацевтическую область в попытке создать лекарства, которые нацелены на конкретные гены и геномные изменения. Создание лекарств для лечения этих неинфекционных заболеваний может быть использовано для лечения людей, уже страдающих этими заболеваниями. Общие знания о механизмах, лежащих в основе эпигенетических эффектов питания матери, также полезны с точки зрения осведомленности. Широкая общественность может осознавать риски определенного пищевого поведения во время беременности, пытаясь обуздать негативные последствия, которые могут возникнуть у потомства в более позднем возрасте. Эпигенетические знания могут привести к более здоровому образу жизни миллиардов людей во всем мире.Создание лекарств для лечения этих неинфекционных заболеваний может быть использовано для лечения людей, уже страдающих этими заболеваниями. Общие знания о механизмах, лежащих в основе эпигенетических эффектов питания матери, также полезны с точки зрения осведомленности. Широкая общественность может осознавать риски определенного пищевого поведения во время беременности, пытаясь обуздать негативные последствия, которые могут возникнуть у потомства в более позднем возрасте. Эпигенетические знания могут привести к более здоровому образу жизни миллиардов людей во всем мире.Создание лекарств для лечения этих неинфекционных заболеваний может быть использовано для лечения людей, уже страдающих этими заболеваниями. Общие знания о механизмах, лежащих в основе эпигенетических эффектов питания матери, также полезны с точки зрения осведомленности. Широкая общественность может осознавать риски определенного пищевого поведения во время беременности, пытаясь обуздать негативные последствия, которые могут возникнуть у потомства в более позднем возрасте. Эпигенетические знания могут привести к более здоровому образу жизни миллиардов людей во всем мире.Широкая общественность может осознавать риски определенного пищевого поведения во время беременности, пытаясь обуздать негативные последствия, которые могут возникнуть у потомства в более позднем возрасте. Эпигенетические знания могут привести к более здоровому образу жизни миллиардов людей во всем мире.Широкая общественность может осознавать риски определенного пищевого поведения во время беременности, пытаясь обуздать негативные последствия, которые могут возникнуть у потомства в более позднем возрасте. Эпигенетические знания могут привести к более здоровому образу жизни миллиардов людей во всем мире.
Влияние материнской диеты на другие виды, кроме человека, также имеет значение. Многие долгосрочные последствия глобального изменения климата неизвестны. Знание эпигенетических механизмов может помочь ученым лучше прогнозировать влияние изменения структур сообществ на виды, которые имеют важное экологическое, экономическое и / или культурное значение во всем мире. Поскольку во многих экосистемах изменятся структуры видов, изменится и доступность питательных веществ, что в конечном итоге повлияет на доступный выбор пищи для воспроизводящих самок. Влияние питания матери можно также использовать для улучшения методов ведения сельского хозяйства и аквакультуры. Селекционеры могут использовать научные данные для создания более устойчивых практик, экономя деньги как для себя, так и для потребителей.
Питание матери и окружающая среда эпигенетически влияют на восприимчивость к заболеваниям взрослых [ править ]
[ править ]
Считается, что гипергликемия во время беременности вызывает эпигенетические изменения в гене лептина новорожденных, что приводит к потенциально повышенному риску ожирения и сердечных заболеваний. Лептининогда называют «гормоном сытости», потому что он вырабатывается жировыми клетками для подавления чувства голода. Изучая как модели на животных, так и обсервационные исследования на людях, было высказано предположение, что выброс лептина в перинатальном периоде играет решающую роль в повышении долгосрочного риска ожирения. Перинатальный период начинается на 22 неделе беременности и заканчивается через неделю после рождения. [34] Метилирование ДНК около локуса лептина было исследовано, чтобы определить, существует ли корреляция между материнской гликемией и уровнями лептина у новорожденных. Результаты показали, что гликемия обратно пропорциональна состоянию метилирования гена LEP, который контролирует выработку гормона лептина. Следовательно, более высокие уровни гликемии у матерей соответствовали более низким уровням метилирования в гене LEP у их детей. С этим более низким состоянием метилирования,ген LEP транскрибируется чаще, тем самым вызывая более высокий уровень лептина в крови.[32] Эти более высокие уровни лептина в крови в перинатальный период были связаны с ожирением во взрослом возрасте, возможно, из-за того, что более высокий «нормальный» уровень лептина был установлен во время беременности. Поскольку ожирение является одним из основных факторов сердечно-сосудистых заболеваний, этот выброс лептина коррелирует не только с ожирением, но и с сердечными заболеваниями.
[ править ]
Считается, что диета с высоким содержанием жиров в утробе матери вызывает метаболический синдром. Метаболический синдром - это набор симптомов, включая ожирение и инсулинорезистентность, которые, по-видимому, связаны. Этот синдром часто связан с диабетом II типа, а также с гипертонией и атеросклерозом. Используя модели мышей, исследователи показали, что диета с высоким содержанием жиров в утробе матери вызывает модификации адипонектина.и гены лептина, которые изменяют экспрессию генов; эти изменения способствуют метаболическому синдрому. Гены адипонектина регулируют метаболизм глюкозы, а также расщепление жирных кислот; однако точные механизмы не совсем понятны. На моделях как на людях, так и на мышах было показано, что адипонектин добавляет сенсибилизирующие к инсулину и противовоспалительные свойства различным типам тканей, в частности, мышцам и тканям печени. Также было показано, что адипонектин увеличивает скорость транспорта и окисления жирных кислот у мышей, что вызывает усиление метаболизма жирных кислот. [33] При диете с высоким содержанием жиров во время беременности наблюдалось усиление метилирования промотора гена адипонектина, сопровождающееся уменьшением ацетилирования. Эти изменения, вероятно, ингибируют транскрипцию генов адипонектина, потому что увеличение метилирования и снижение ацетилирования обычно подавляют транскрипцию. Кроме того, наблюдалось усиление метилирования промотора лептина, что снижает выработку гена лептина. Следовательно, было меньше адипонектина, помогающего клеткам усваивать глюкозу и расщеплять жир, а также меньше лептина, вызывающего чувство сытости. Снижение этих гормонов вызвало увеличение жировой массы, непереносимость глюкозы, гипертриглицеридемию, аномальные уровни адипонектина и лептина и гипертонию на протяжении всей жизни животного. Тем не мение,эффект исчез после трех последующих поколений при нормальном питании. Это исследование подчеркивает тот факт, что эти эпигенетические метки могут быть изменены в течение одного поколения и даже могут быть полностью устранены с течением времени.[34] Это исследование выявило связь между диетами с высоким содержанием жиров, адипонектином и лептином у мышей. Напротив, было проведено несколько исследований на людях, чтобы показать специфические эффекты диеты с высоким содержанием жиров в утробе матери на человека. Однако было показано, что снижение уровня адипонектина у людей связано с ожирением, инсулинорезистентностью, диабетом II типа и ишемической болезнью сердца. Предполагается, что механизм, аналогичный описанному у мышей, также может способствовать метаболическому синдрому у людей. [33]
[ править ]
Кроме того, диета с высоким содержанием жиров вызывает хроническое воспаление слабой степени в плаценте, жировой ткани, печени, головном мозге и сосудистой системе. Воспаление - важный аспект естественной системы защиты организма после травмы, травмы или болезни. Во время воспалительной реакции возникает ряд физиологических реакций, таких как усиление кровотока, усиление клеточного метаболизма и вазодилатация, которые помогают лечить раненую или инфицированную область. Однако хроническое воспаление слабой степени связано с долгосрочными последствиями, такими как сердечно-сосудистые заболевания, почечная недостаточность, старение, диабет и т. Д. Это хроническое воспаление слабой степени обычно наблюдается у лиц с ожирением, соблюдающих диету с высоким содержанием жиров. В модели на мышах избыточные цитокиныбыли обнаружены у мышей, получавших диету с высоким содержанием жиров. Цитокины помогают передавать сигналы клеткам во время иммунных ответов, в частности направляя клетки к участкам воспаления, инфекции или травмы. МРНК провоспалительных цитокинов индуцировалась в плаценте матерей, соблюдающих диету с высоким содержанием жиров. Диеты с высоким содержанием жиров также вызывали изменения в микробиотическом составе, что приводило к гипервоспалительным реакциям толстой кишки у потомства. Этот гипервоспалительный ответ может привести к воспалительным заболеваниям кишечника, таким как болезнь Крона или язвенный колит.[35] Как упоминалось ранее, диета с высоким содержанием жиров в утробе матери способствует ожирению; однако некоторые провоспалительные факторы, такие как IL-6 и MCP-1, также связаны с отложением жира в организме. Было высказано предположение, что ацетилирование гистонов тесно связано с воспалением, поскольку было показано, что добавление ингибиторов гистондеацетилазы снижает экспрессию провоспалительных медиаторов в глиальных клетках . Это уменьшение воспаления привело к улучшению функции и выживаемости нервных клеток. Это воспаление также часто связано с ожирением, сердечно-сосудистыми заболеваниями, ожирением печени., поражение головного мозга, а также преэклампсия и преждевременные роды. Хотя было показано, что диета с высоким содержанием жиров вызывает воспаление, которое способствует всем этим хроническим заболеваниям; неясно, как это воспаление действует как посредник между диетой и хроническим заболеванием. [35]
[ править ]
Исследование, проведенное после голландской голодной зимы 1944-1945 годов, показало, что недостаточное питание на ранних стадиях беременности связано с гипометилированием гена инсулиноподобного фактора роста II (IGF2) даже по прошествии шести десятилетий. У этих людей уровень метилирования был значительно ниже, чем у их братьев или сестер того же пола, которые не были зачаты во время голода. Было проведено сравнение с детьми, зачатыми до голода, так что их матери были лишены питательных веществ на более поздних стадиях беременности; у этих детей были нормальные паттерны метилирования. IGF2 означает инсулиноподобный фактор роста II; этот ген играет ключевую роль в росте и развитии человека. Ген IGF2 также отпечатан по материнской линииэто означает, что ген матери заглушен. Ген матери обычно метилирован в дифференциально метилированной области (DMR); однако при гипометилировании ген экспрессируется биаллельно. Таким образом, люди с более низким уровнем метилирования, вероятно, потеряли часть эффекта импринтинга. Аналогичные результаты были продемонстрированы в генах Nr3c1 и Ppara у потомства крыс, получавших до начала беременности диету с дефицитом изокалорийного белка. Это также означает, что недоедание было причиной эпигенетических изменений. Удивительно, но не было корреляции между состояниями метилирования и массой тела при рождении. Это показало, что вес при рождении не может быть адекватным способом определения статуса питания во время беременности.В этом исследовании подчеркивалось, что эпигенетические эффекты различаются в зависимости от времени воздействия и что ранние стадии развития млекопитающих являются решающими периодами для установления эпигенетических меток. У тех, кто подвергся воздействию на ранних сроках беременности, метилирование снизилось, тогда как у тех, кто подвергся воздействию в конце беременности, уровень метилирования был относительно нормальным.[36] У потомков и потомков матерей с гипометилированием чаще развивались сердечно-сосудистые заболевания. Эпигенетические изменения, происходящие во время эмбриогенеза и раннего развития плода, имеют более сильные физиологические и метаболические эффекты, поскольку они передаются через большее количество митотических делений. Другими словами, эпигенетические изменения, которые происходят раньше, с большей вероятностью сохранятся в большем количестве клеток. [36]
[ править ]
В другом исследовании исследователи обнаружили, что перинатальное ограничение питательных веществ, приводящее к задержке внутриутробного развития (ЗВУР), способствует развитию сахарного диабета 2 типа.(DM2). ЗВУР относится к плохому росту ребенка в утробе матери. В поджелудочной железе IUGR вызывает снижение экспрессии промотора гена, кодирующего критический фактор транскрипции для функции и развития бета-клеток. Бета-клетки поджелудочной железы ответственны за выработку инсулина; снижение активности бета-клеток связано с СД2 в зрелом возрасте. В скелетных мышцах IUGR вызывал снижение экспрессии гена Glut-4. Ген Glut-4 контролирует производство транспортера Glut-4; этот транспортер особенно чувствителен к инсулину. Таким образом, когда уровень инсулина повышается, больше переносчиков глют-4 доставляется к клеточной мембране, чтобы увеличить поглощение глюкозы клеткой. Это изменение вызвано модификациями гистонов в клетках скелетных мышц, которые снижают эффективность системы транспорта глюкозы в мышцу.Поскольку основные переносчики глюкозы не работают на оптимальной мощности, у этих людей больше шансов развиться.инсулинорезистентность при использовании богатой калориями диетой в более позднем возрасте, что способствует развитию СД2. [37]
[ править ]
Дальнейшие исследования изучали эпигенетические изменения, возникающие в результате диеты с высоким содержанием белка / низким содержанием углеводов во время беременности. Эта диета вызвала эпигенетические изменения, которые были связаны с более высоким кровяным давлением, более высоким уровнем кортизола и усиленной реакцией оси гипоталамус-гипофиз-надпочечники (HPA) на стресс. Повышенное метилирование 11β-гидроксистероиддегидрогеназы типа 2 (HSD2), глюкокортикоидного рецептора (GR) и H19 ICR положительно коррелировало с ожирением и кровяным давлением во взрослом возрасте. Глюкокортикоиды играют жизненно важную роль в развитии и созревании тканей, а также влияют на метаболизм. Доступ глюкокортикоидов к GR регулируется HSD1 и HSD2. H19 - это импринтированный ген длядлинная кодирующая РНК (днРНК) , которая оказывает ограничивающее влияние на массу тела и пролиферацию клеток. Следовательно, более высокие скорости метилирования в H19 ICR подавляют транскрипцию и не позволяют днРНК регулировать массу тела. Матери, которые сообщили о более высоком потреблении мяса / рыбы и овощей и более низком потреблении хлеба / картофеля на поздних сроках беременности, имели более высокий средний уровень метилирования в GR и HSD2. Однако одна общая проблема этих типов исследований заключается в том, что многие эпигенетические модификации имеют паттерны метилирования ДНК тканевой и клеточной специфичности. Таким образом, паттерны эпигенетической модификации доступных тканей, таких как периферическая кровь, могут не отражать эпигенетические паттерны ткани, вовлеченной в конкретное заболевание. [38]
[ править ]
Убедительные данные на крысах подтверждают вывод о том, что воздействие эстрогена у новорожденных играет роль в развитии рака простаты . Используя модель ксенотрансплантата простаты плода человека, исследователи изучили эффекты раннего воздействия эстрогена с вторичным лечением эстрогеном и тестостероном и без него. Модель ксенотрансплантатапредставляет собой трансплантат ткани, пересаженный между организмами разных видов. В этом случае человеческая ткань была трансплантирована крысам; следовательно, нет необходимости экстраполировать с грызунов на людей. Гистопатологические поражения, пролиферация и уровни сывороточных гормонов измерялись в различные моменты времени после ксенотрансплантации. На 200-й день ксенотрансплантат, подвергнутый двум обработкам эстрогеном, показал наиболее серьезные изменения. Кроме того, исследователи изучили ключевые гены, участвующие в росте предстательной железы и стромы, прогрессировании клеточного цикла, апоптозе, рецепторах гормонов и супрессорах опухолей, используя специальный массив ПЦР. Анализ метилирования ДНК показал различия в метилировании сайтов CpG стромального компартмента после лечения эстрогеном.Эти вариации в метилировании, вероятно, являются причиной изменений в клеточных событиях пути рака простаты KEGG, которые ингибируют апоптоз и увеличивают прогрессирование клеточного цикла, что способствует развитию рака.[39]
Добавка может обратить вспять эпигенетические изменения [ править ]
Внутриутробное или неонатальное воздействие бисфенола А (BPA) , химического вещества, используемого при производстве поликарбонатного пластика, коррелирует с более высокой массой тела, раком груди, раком простаты и нарушением репродуктивной функции. В модели на мышах у мышей, получавших диету с BPA, с большей вероятностью была желтая шерсть, соответствующая их более низкому состоянию метилирования в промоторных областях ретротранспозона перед геном Агути. Ген агути отвечает за определение того, будет ли шерсть животного полосатой (агути) или твердой (не агути). Однако добавление доноров метильных групп, таких как фолиевая кислота или фитоэстроген, устраняет эффект гипометилирования. Это демонстрирует, что эпигенетические изменения можно обратить вспять с помощью диеты и пищевых добавок. [40]
Влияние питания матери и экология [ править ]
Этот раздел требует дополнительных ссылок для проверки . ( Сентябрь 2017 г. ) ( Узнайте, как и когда удалить этот шаблон сообщения ) |
Эффекты питания матери наблюдаются не только у людей, но и во многих таксонах животного мира. Эти эффекты питания матери могут привести к экологическим изменениям в более широком масштабе среди населения и от поколения к поколению. Пластичность, связанная с этими эпигенетическими изменениями из-за питания матери, представляет собой среду, в которой будет рождено потомство. Во многих случаях эпигенетические эффекты материнской диеты на потомков во время развития генетически подготовят потомство к лучшей адаптации к окружающей среде, с которой они впервые столкнутся. Эпигенетические эффекты материнской диеты можно увидеть у многих видов, использующих различные экологические сигналы и эпигенетические механизмы для обеспечения адаптивного преимущества будущим поколениям.
В области экологии есть много примеров влияния питания матери. К сожалению, эпигенетические механизмы, лежащие в основе этих фенотипических изменений, редко исследуются. В будущем ученым-экологам, а также ученым-эпигенетам и геномистам будет выгодно работать вместе, чтобы заполнить пробелы в области экологии, чтобы получить полную картину экологических сигналов и эпигенетических изменений, вызывающих фенотипическое разнообразие.
Родительское питание влияет на иммунитет потомства [ править ]
Вид пиралидной моли , Plodia interpunctella, обычно обнаруживаемый в местах хранения пищевых продуктов, оказывает влияние на питание матери и отца на потомство. Эпигенетические изменения в потомстве моли влияют на выработку фенолоксидазы, фермента, участвующего в меланизации и коррелирующего с устойчивостью к определенным патогенам у многих видов беспозвоночных. В этом исследовании родительские бабочки содержались в среде с высоким или низким содержанием пищи в течение их репродуктивного периода. Бабочки, которые содержались в среде с плохим питанием, давали потомство с меньшим содержанием фенолоксидазы и, таким образом, имели более слабую иммунную систему, чем бабочки, которые размножались в среде с высоким содержанием пищи. Это считается адаптивным, потому что потомство развивается, получая сигналы об ограниченных возможностях питания. Эти подсказки позволяют мотыльку по-разному распределять энергию,уменьшение энергии, выделяемой для иммунной системы, и выделение большего количества энергии на рост и размножение, чтобы улучшить физическую форму и обеспечить безопасность будущих поколений. Одним из объяснений этого эффекта может быть импринтинг, экспрессия только одного родительского гена над другим, но дальнейшие исследования еще предстоит провести.[41]
Опосредованные родителями диетические эпигенетические эффекты на иммунитет имеют более широкое значение для диких организмов. Изменения в иммунитете всего населения могут сделать население более восприимчивым к нарушениям окружающей среды, таким как занесение патогена. Следовательно, эти трансгенерационные эпигенетические эффекты могут влиять на динамику популяции, снижая стабильность популяций, которые населяют среду, отличную от родительской, для которой потомство эпигенетически модифицируется.
Питание матери влияет на скорость роста потомства [ править ]
Доступность пищи также влияет на эпигенетические механизмы, управляющие скоростью роста цихлид Simochromis pleurospilus , вынашивающих ротовую полость . Когда доступность питательных веществ высока, воспроизводящиеся самки будут производить много мелких яиц по сравнению с меньшим количеством более крупных яиц в бедных питательными веществами средах. Размер яиц часто коррелирует с размером тела личинок рыб при вылуплении: из более мелких яиц вылупляются личинки меньшего размера. В случае цихлид мелкие личинки растут быстрее, чем их более крупные яичные собратья. Это связано с повышенной экспрессией GHR, рецептора гормона роста. Повышенные уровни транскрипции генов GHR увеличивают рецепторы, доступные для связывания с гормоном роста, GH, что приводит к увеличению скорости роста более мелких рыб. Рыба большего размера с меньшей вероятностью будет съедена хищниками, поэтому для обеспечения выживания выгодно быстро расти на ранних этапах жизни. Механизм, с помощью которого регулируется транскрипция GHR, неизвестен, но это может быть связано с гормонами в желтке, производимыми матерью, или просто с количеством самого желтка. Это может привести к метилированию ДНК или модификациям гистонов, которые контролируют уровни генной транскрипции. [42]
С экологической точки зрения это пример того, как мать использует свое окружение и определяет наилучший метод увеличения выживаемости потомства, не предпринимая для этого сознательных усилий. Экология обычно определяется способностью организма конкурировать за получение питательных веществ и успешное воспроизводство. Если мать может собрать обильное количество ресурсов, она будет иметь более высокую плодовитость и производить потомство, способное быстро расти, чтобы избежать нападения хищников. Матери, которые не могут получить столько питательных веществ, произведут меньше потомства, но потомство будет больше в надежде, что их большой размер поможет обеспечить выживание до полового созревания. В отличие от примера с молью, материнские эффекты, обеспечиваемые потомству цихлид, не подготавливают цихлид к среде, в которой они будут рождаться;это потому, что цихлиды, вынашивающие ротовую полость, обеспечивают родительскую заботу о своем потомстве, обеспечивая стабильную среду для развития потомства. Потомство с более высокими темпами роста может стать независимым быстрее, чем его медленно растущие сверстники, что снижает количество энергии, расходуемой родителями в период родительской заботы.
Аналогичное явление происходит в морского ежа , зелёный морской ёж . Матери ежей в богатой питательными веществами среде производят большое количество мелких яиц. Потомство от этих маленьких яиц растет быстрее, чем от крупных яиц от матерей с низким содержанием питательных веществ. Опять же, он полезен для личинок морского ежа, известных как планула., чтобы быстро расти, чтобы сократить продолжительность их личиночной фазы, и превращаться в молодь, чтобы снизить риск хищничества. Личинки морского ежа могут развиваться в один из двух фенотипов в зависимости от их материнского и личиночного питания. Личинки, которые растут быстрыми темпами благодаря высокому питанию, могут тратить больше своей энергии на развитие ювенильного фенотипа. Личинки, которые растут медленнее при низком питании, тратят больше энергии на рост шиповидных придатков, чтобы защитить себя от хищников, пытаясь увеличить выживаемость в молодую фазу. Определение этих фенотипов основано на питании как матери, так и молоди. Эпигенетические механизмы этих фенотипических изменений неизвестны.но считается, что может существовать порог питания, который вызывает эпигенетические изменения, влияющие на развитие и, в конечном счете, на фенотип личинок.[43]
См. Также [ править ]
- Материнский эффект доминантный эмбриональный арест
- Ксения (растения)
- Экстрануклеарное наследование
Ссылки [ править ]
- ^ Гриффитс AJ (1999). Введение в генетический анализ . Нью-Йорк: WH Freeman. ISBN 978-0-7167-3771-1.[ требуется страница ]
- ^ Schier AF (апрель 2007). «Материнско-зиготический переход: смерть и рождение РНК». Наука . 316 (5823): 406–7. Bibcode : 2007Sci ... 316..406S . DOI : 10.1126 / science.1140693 . PMID 17446392 . S2CID 36999389 .
- ↑ Jorgensen EM, Mango SE (май 2002 г.). «Искусство и дизайн генетических экранов: Caenorhabditis elegans ». Nat. Преподобный Жене . 3 (5): 356–69. DOI : 10.1038 / nrg794 . PMID 11988761 . S2CID 152517 .
- ↑ St Johnston D (март 2002 г.). «Искусство и дизайн генетических экранов: Drosophila melanogaster ». Nat. Преподобный Жене . 3 (3): 176–88. DOI : 10.1038 / nrg751 . PMID 11972155 . S2CID 6093235 .
- ^ Bastock R, St Johnston D (декабрь 2008). « Оогенез дрозофилы ». Curr. Биол . 18 (23): R1082–7. DOI : 10.1016 / j.cub.2008.09.011 . PMID 19081037 . S2CID 14924601 .
- ^ Nüsslein-Фольхард С, Lohs-Schardin М, шлифовальные станки К, Кремер С (январь 1980). «Дорсо-вентральный сдвиг эмбриональных зачатков у нового мутанта Drosophila с материнским эффектом ». Природа . 283 (5746): 474–6. Bibcode : 1980Natur.283..474N . DOI : 10.1038 / 283474a0 . PMID 6766208 . S2CID 4320963 .
- ^ Шупбы T, Wieschaus E (февраль 1986). «Автономия зародышевой линии мутаций материнского эффекта, изменяющих структуру эмбрионального тела дрозофилы ». Dev. Биол . 113 (2): 443–8. DOI : 10.1016 / 0012-1606 (86) 90179-X . PMID 3081391 .
- ^ Nüsslein-Фольхард C, Frohnhöfer HG, Lehmann R (декабрь 1987). «Определение переднезадней полярности у дрозофилы ». Наука . 238 (4834): 1675–81. Bibcode : 1987Sci ... 238.1675N . DOI : 10.1126 / science.3686007 . PMID 3686007 .
- ^ Берлет Т., Бурри М., Тома Г. и др. (Июнь 1988 г.). «Роль локализации бикоидной РНК в организации переднего паттерна эмбриона дрозофилы » . EMBO J . 7 (6): 1749–56. DOI : 10.1002 / j.1460-2075.1988.tb03004.x . PMC 457163 . PMID 2901954 .
- ^ Эфрусси А, Сент - Джонстон D (январь 2004 г.). «Увидеть - значит поверить: градиент морфогена Bicoid созревает». Cell . 116 (2): 143–52. DOI : 10.1016 / S0092-8674 (04) 00037-6 . PMID 14744427 . S2CID 1977542 .
- ^ Pranav K, Mina U (2013). Науки о жизни: основы и практика (3-е изд.). Нью-Дели: Академия следопытов. ISBN 9788190642774. OCLC 857764171 .
- ^ Рид WL, Clark ME (июль 2011). «Помимо материнских эффектов у птиц: реакция эмбриона на окружающую среду» . Интегративная и сравнительная биология . 51 (1): 73–80. DOI : 10.1093 / ICB / icr032 . PMID 21624931 .
- ↑ Archer E (январь 2015). «Эпидемия детского ожирения в результате негенетической эволюции: гипотеза материнских ресурсов» . Труды клиники Мэйо . 90 (1): 77–92. DOI : 10.1016 / j.mayocp.2014.08.006 . PMC 4289440 . PMID 25440888 .
- ↑ Archer E (апрель 2015 г.). «В ответ - материнские, отцовские и общественные усилия необходимы, чтобы« вылечить »детское ожирение» . Труды клиники Мэйо . 90 (4): 555–7. DOI : 10.1016 / j.mayocp.2015.01.020 . PMC 4527549 . PMID 25841259 .
- ↑ Archer E (май 2015 г.). «В ответ - Эпигенетика и детское ожирение» . Труды клиники Мэйо . 90 (5): 693–5. DOI : 10.1016 / j.mayocp.2015.02.013 . PMID 25939942 .
- ^ Арчер E (2015-02-28). «Мать всех проблем». Новый ученый . 225 (3010): 32–33. Bibcode : 2015NewSc.225 ... 32A . DOI : 10.1016 / S0262-4079 (15) 60404-3 .
- ^ Ясуда GK, Schubiger G, Wakimoto BT (май 1995). «Генетическая характеристика ms (3) K81, отцовского гена Drosophila melanogaster» . Генетика . 140 (1): 219–29. PMC 1206549 . PMID 7635287 .
- ↑ Fitch KR, Yasuda GK, Owens KN, Wakimoto BT (1998). «1 Отцовские эффекты у дрозофилы: последствия для механизмов раннего развития». Отцовские эффекты у Drosophila: значение для механизмов раннего развития . Актуальные темы биологии развития. 38 . С. 1–34. DOI : 10.1016 / S0070-2153 (08) 60243-4 . ISBN 9780121531386. PMID 9399075 .
- ↑ Fitch KR, Wakimoto BT (май 1998 г.). «Отцовский эффект гена ms (3) sneaky необходим для активации сперматозоидов и инициации эмбриогенеза у Drosophila melanogaster». Биология развития . 197 (2): 270–82. DOI : 10,1006 / dbio.1997.8852 . PMID 9630751 .
- ^ Ван Cann Дж, Koskela Е, Mappes Т, Симс А, Вт ПК (сентябрь 2019). «Фитнес-эффекты разных поколений в ранней среде обитания диких грызунов» . Журнал экологии животных . 88 (9): 1355–1365. DOI : 10.1111 / 1365-2656.13039 . PMID 31162628 .
- Перейти ↑ Adkins-Regan E, Banerjee SB, Correa SM, Schweitzer C (сентябрь 2013 г.). «Материнские эффекты у перепелов и зебровых зябликов: поведение и гормоны». Общая и сравнительная эндокринология . 190 : 34–41. DOI : 10.1016 / j.ygcen.2013.03.002 . PMID 23499787 .
- ^ Leftwich PT, Nash WJ, Друг Л., Chapman T (февраль 2019). «Вклад материнских эффектов в выбор рациона средиземноморских плодовых мух» . Эволюция; Международный журнал органической эволюции . 73 (2): 278–292. DOI : 10.1111 / evo.13664 . PMC 6492002 . PMID 30592536 .
- ^ a b c Галлоуэй Л.Ф. (апрель 2005 г.). «Материнские эффекты обеспечивают фенотипическую адаптацию к местным условиям окружающей среды» . Новый фитолог . 166 (1): 93–9. DOI : 10.1111 / j.1469-8137.2004.01314.x . PMID 15760354 .
- ^ а б в Спитцер Б.В. (2004). «Материнские эффекты у мягких щитовок Saissetia coffeae (Hemiptera: Coccidae)». Эволюция . 58 (11): 2452–61. DOI : 10.1554 / 03-642 . JSTOR 3449399 . PMID 15612288 . S2CID 198152929 .
- ^ a b Данцер Б., Ньюман А.Е., Бунстра Р., Пальме Р., Бутин С., Хамфрис М.М., МакАдам А.Г. (июнь 2013 г.). «Плотность запускает материнские гормоны, которые увеличивают адаптивный рост потомства у диких млекопитающих» . Наука . 340 (6137): 1215–7. Bibcode : 2013Sci ... 340.1215D . DOI : 10.1126 / science.1235765 . PMID 23599265 . S2CID 206548036 .
- ^ a b c Fox CW, Thakar MS, Mousseau TA (1997). «Пластичность размера яйца у жука-жука: адаптивный материнский эффект». Американский натуралист . 149 (1): 149–63. DOI : 10.1086 / 285983 . JSTOR 2463535 .
- ^ Ван Buskirk J (февраль 2002). «Фенотипическая лабильность и эволюция хищнической пластичности головастиков». Эволюция; Международный журнал органической эволюции . 56 (2): 361–70. DOI : 10,1554 / 0014-3820 (2002) 056 [0361: PLATEO] 2.0.CO; 2 . JSTOR 3061574 . PMID 11926504 .
- ^ Nussey DH, Wilson AJ, Brommer JE (2007). «Эволюционная экология индивидуальной фенотипической пластичности в диких популяциях» . Журнал эволюционной биологии . 20 (3): 831–44. DOI : 10.1111 / j.1420-9101.2007.01300.x . PMID 17465894 . S2CID 18056412 .
- Перейти ↑ Garland T, Kelly SA (2006). «Фенотипическая пластичность и экспериментальная эволюция» . Журнал экспериментальной биологии . 209 (Pt 12): 2344–61. DOI : 10,1242 / jeb.02244 . PMID 16731811 .
- ^ a b Муссо Т.А., Fox CW (1998). «Адаптивное значение материнских эффектов». Тенденции в экологии и эволюции . 13 (10): 403–7. DOI : 10.1016 / S0169-5347 (98) 01472-4 . PMID 21238360 .
- ^ Баруа S, Junaid MA (2015). «Образ жизни, беременность и эпигенетические эффекты». Эпигеномика . 7 (1): 85–102. DOI : 10.2217 / epi.14.71 . PMID 25687469 .
- ^ Аллард С, Desgagné В, Патенод Дж, Лакруа М, Guillemette л, Баттист МС, Дойон М, Менар Дж, Ardilouze ДЛ, Перрон Р, Бучард л, Ивер М. Ф. (2015). «Менделирующая рандомизация подтверждает наличие причинной связи между гипергликемией матери и эпигенетической регуляцией гена лептина у новорожденных» . Эпигенетика . 10 (4): 342–51. DOI : 10.1080 / 15592294.2015.1029700 . PMC 4622547 . PMID 25800063 .
- ^ а б Чандран М., Филлипс С.А., Чьяралди Т., Генри Р.Р. (2003). «Адипонектин: больше, чем просто еще один гормон жировых клеток?» . Уход за диабетом . 26 (8): 2442–50. DOI : 10.2337 / diacare.26.8.2442 . PMID 12882876 .
- ^ Masuyama Н, Мицуи Т, Nobumoto Е, Хирамацу Y (2015). «Эффекты воздействия диеты с высоким содержанием жиров в утробе матери на ожирение и диабетогенные признаки посредством эпигенетических изменений в экспрессии генов адипонектина и лептина для нескольких поколений у самок мышей» . Эндокринология . 156 (7): 2482–91. DOI : 10.1210 / en.2014-2020 . PMID 25853666 .
- ^ Чжоу D, Пан YX (2015). «Патофизиологические основы ухудшения здоровья за пределами поколений: роль материнской диеты с высоким содержанием жиров и хронического воспаления низкой степени». Журнал пищевой биохимии . 26 (1): 1–8. DOI : 10.1016 / j.jnutbio.2014.06.011 . PMID 25440222 .
- ^ а б Хейманс Б.Т., Тоби Э.В., Штейн А.Д., Путтер Х., Блау Г.Дж., Сассер Э.С., Слагбум ПЭ, Лумей Л. «Стойкие эпигенетические различия, связанные с пренатальным воздействием голода у людей» . Труды Национальной академии наук Соединенных Штатов Америки . 105 (44): 17046–9. Bibcode : 2008PNAS..10517046H . DOI : 10.1073 / pnas.0806560105 . PMC 2579375 . PMID 18955703 .
- ^ Лопес-Джарамилло Р, Гомес-Arbeláez D, Сотомэйор-Рубио А, Мантилла-Гарсиа Д, Лопес-Лопес J (2015). «Материнское недоедание и кардиометаболические заболевания: латиноамериканская перспектива» . BMC Medicine . 13 : 41. DOI : 10,1186 / s12916-015-0293-8 . PMC 4346113 . PMID 25858591 .
- ^ Дрейк AJ, McPherson RC, Годфри KM, Купер C, Lillycrop KA, Hanson MA, Meehan RR, Seckl JR, Reynolds RM (2012). «Несбалансированная диета матери во время беременности связана с эпигенетическими изменениями в генах, контролирующих действие глюкокортикоидов и рост плода». Клиническая эндокринология . 77 (6): 808–15. DOI : 10.1111 / j.1365-2265.2012.04453.x . PMID 22642564 . S2CID 28199749 .
- ^ Saffarini CM, McDonnell-Clark EV, Амин A, Хас SM, Boekelheide K (2015). «Воздействие эстрогена в процессе развития изменяет дифференциацию и эпигенетическое программирование в модели ксенотрансплантата простаты плода человека» . PLOS ONE . 10 (3): e0122290. Bibcode : 2015PLoSO..1022290S . DOI : 10.1371 / journal.pone.0122290 . PMC 4370592 . PMID 25799167 .
- ^ Dolinoy DC, Huang D, Jirtle RL (2007). «Материнские пищевые добавки противодействуют гипометилированию ДНК, вызванному бисфенолом А, на раннем этапе развития» . Труды Национальной академии наук Соединенных Штатов Америки . 104 (32): 13056–61. Bibcode : 2007PNAS..10413056D . DOI : 10.1073 / pnas.0703739104 . PMC 1941790 . PMID 17670942 .
- ^ Варгас G, Мишо JP, Nechols JR, Морено CA (2014). «Возрастные материнские эффекты взаимодействуют с питанием личинок и влияют на жизненный цикл Coleomegilla maculata» . Экологическая энтомология . 39 (1): 39–46. DOI : 10.1111 / een.12065 . S2CID 54585960 .
- ^ Triggs AM, Нелл RJ (2012). «Родительский рацион оказывает сильное влияние на иммунитет потомства» . Функциональная экология . 26 (6): 1409–17. DOI : 10.1111 / j.1365-2435.2012.02051.x .
- ^ Bertram DF, Strathmann RR (1998). «Влияние питания матерей и личинок на рост и форму планктотрофных личинок» . Экология . 79 (1): 315–27. DOI : 10,1890 / 0012-9658 (1998) 079 [0315: EOMALN] 2.0.CO; 2 . JSTOR 176885 . S2CID 85923751 .