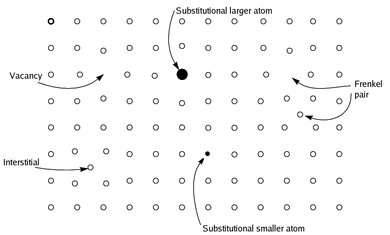
Нестехиометрические соединения - это химические соединения , почти всегда твердые неорганические соединения , имеющие элементный состав, пропорции которого не могут быть представлены соотношением малых натуральных чисел ; Чаще всего в таких материалах отсутствует небольшой процент атомов или слишком много атомов упаковано в идеальную решетку. [ не проверено в теле ]
В отличие от более ранних определений, современное понимание нестехиометрических соединений рассматривает их как гомогенные, а не как смеси стехиометрических химических соединений . [ не проверено в теле ] Поскольку твердые тела в целом электрически нейтральны, дефект компенсируется изменением заряда других атомов в твердом теле, либо изменением их степени окисления, либо заменой их атомами разных элементов с другим обвинять. Многие оксиды и сульфиды металлов имеют нестехиометрические примеры; например, стехиометрический оксид железа (II), который встречается редко, имеет формулу FeO, тогда как более распространенный материал нестехиометрический, с формулой Fe 0,95О. Тип равновесных дефектов в нестехиометрических соединениях может меняться с сопутствующим изменением объемных свойств материала. [1] Нестехиометрические соединения также проявляют особые электрические или химические свойства из-за дефектов; например, когда атомы отсутствуют, электроны могут двигаться через твердое тело быстрее. [ не проверено в организме ] Нестехиометрические соединения находят применение в керамических и сверхпроводящих материалах, а также в конструкции электрохимических (например, аккумуляторных ) систем.
Возникновение [ править ]
Этот раздел нуждается в расширении за счет более общей информации, источников, о масштабах возникновения этого явления. Вы можете помочь, добавив к нему . ( Июль 2015 г. ) |
Оксиды железа [ править ]
Нестехиометрия является широко распространенной для металлических оксидов , особенно , когда металл не находится в своем самом высоком состоянии окисления . [2] : 642–644 Например, хотя вюстит ( закись железа ) имеет идеальную ( стехиометрическую ) формулу FeO, фактическая стехиометрия ближе к Fe 0,95 O. Нестехиометрия отражает легкость окисления Fe 2+ до Fe 3+, эффективно заменяя небольшую часть Fe 2+ на две трети их количества Fe 3+ . Таким образом, на каждые три «недостающих» иона Fe 2+ в кристалле приходится два Fe3+ иона для балансировки заряда. Состав нестехиометрического соединения обычно изменяется непрерывно в узком диапазоне. Таким образом, формула для вюстита записывается как Fe 1-x O, где x - небольшое число (0,05 в предыдущем примере), представляющее отклонение от «идеальной» формулы. [3] Нестехиометрия особенно важна для твердых трехмерных полимеров, которые допускают ошибки. В некоторой степени энтропия заставляет все твердые тела быть нестехиометрическими. Но для практических целей этот термин описывает материалы, нестехиометрия которых поддается измерению, обычно не менее 1% от идеального состава.
Сульфиды железа [ править ]

Моносульфиды переходных металлов часто нестехиометричны. Наиболее известным, вероятно, является номинально сульфид железа (II) (минерал пирротин ) с составом Fe 1− x S ( x = от 0 до 0,2). Редкий стехиометрический концевой элемент FeS известен как минерал троилит . Пирротин примечателен тем, что имеет множество политипов , то есть кристаллических форм, различающихся по симметрии ( моноклинная или гексагональная ) и составу (Fe 7 S 8 , Fe 9 S 10 , Fe 11 S 12.и другие). В этих материалах всегда присутствует дефицит железа из-за наличия дефектов решетки, а именно вакансий железа. Несмотря на эти дефекты, состав обычно выражается как отношение больших чисел, а симметрия кристаллов относительно высока. Это означает, что вакансии железа не разбросаны по кристаллу случайным образом, а образуют определенные регулярные конфигурации. Эти вакансии сильно влияют на магнитные свойства пирротина: магнетизм увеличивается с увеличением концентрации вакансий и отсутствует для стехиометрического FeS. [4]
Гидриды палладия [ править ]
Гидрид палладия - нестехиометрический материал примерного состава PdH x (0,02 < x <0,58). Это твердое тело проводит водород за счет подвижности атомов водорода внутри твердого тела.
Оксиды вольфрама [ править ]
Иногда бывает трудно определить, является ли материал нестехиометрическим или формула лучше всего представлена большими числами. Оксиды вольфрама иллюстрируют эту ситуацию. Исходя из идеализированного материала триоксида вольфрама , можно создать ряд родственных материалов, в которых немного не хватает кислорода. Эти кислородно-дефицитные частицы могут быть описаны как WO 3− x , но на самом деле они являются стехиометрическими формами с большими элементарными ячейками с формулами W n O 3 n −2 , где n = 20, 24, 25, 40. Таким образом, последний вид можно описать стехиометрической формулой W 40 O 118, тогда как нестехиометрическое описание WO 2.95 предполагает более хаотичное распределение оксидных вакансий. [ необходима цитата ]
Другие случаи [ править ]
При высоких температурах (1000 ° C) сульфиды титана представляют собой ряд нестехиометрических соединений. [2] : 679
Координация полимер прусские синий , номинально Fe 7 (CN) 18 и их аналоги хорошо известны , чтобы сформировать в нестехиометрических пропорциях. [5] : 114 Нестехиометрические фазы проявляют полезные свойства в отношении их способности связывать ионы цезия и таллия . [ необходима цитата ]
Приложения [ править ]
Окислительный катализ [ править ]
Многие полезные соединения образуются в результате реакций углеводородов с кислородом , превращение которых катализируется оксидами металлов. Процесс осуществляется посредством переноса «решеточного» кислорода на углеводородную подложку, этап, на котором временно образуется вакансия (или дефект). На следующем этапе недостающий кислород восполняется за счет O 2 . Такие катализаторы основаны на способности оксида металла образовывать нестехиометрические фазы. [6] Аналогичная последовательность событий описывает другие виды реакций переноса атома, включая гидрирование и гидродесульфуризацию.катализируется твердыми катализаторами. Эти соображения также подчеркивают тот факт, что стехиометрия определяется внутренней частью кристаллов: поверхности кристаллов часто не соответствуют стехиометрии объема. Сложные структуры на поверхностях описываются термином «реконструкция поверхности».
Ионная проводимость [ править ]
На миграцию атомов внутри твердого тела сильно влияют дефекты, связанные с нестехиометрией. Эти дефектные участки обеспечивают пути для миграции атомов и ионов через плотный ансамбль атомов, образующих кристаллы. Кислородные датчики и твердотельные батареи - два приложения, в которых используются вакансии оксидов. Одним из примеров является датчик на основе CeO 2 в автомобильных выхлопных системах. При низких парциальных давлениях O 2 датчик позволяет вводить большее количество воздуха для более полного сгорания. [6]
Сверхпроводимость [ править ]
Многие сверхпроводники нестехиометричны. Например, оксид иттрия-бария-меди , возможно, наиболее заметный высокотемпературный сверхпроводник , представляет собой нестехиометрическое твердое тело с формулой Y x Ba 2 Cu 3 O 7− x . Критическая температура сверхпроводника зависит от точного значения x . Для стехиометрического компонента x = 0, но это значение может достигать 1. [6]
История [ править ]
В основном благодаря работам Николая Семеновича Курнакова и его учеников было показано, что противодействие Бертолле закону Пруста имеет достоинства для многих твердых соединений. Курнаков разделил нестехиометрические соединения на бертоллиды и дальтониды в зависимости от того, демонстрируют ли их свойства монотонное поведение по составу или нет. Термин бертоллид был принят IUPAC в 1960 году. [7] Имена взяты от Клода Луи Бертолле и Джона Далтона.соответственно, которые в XIX веке отстаивали конкурирующие теории состава веществ. Хотя Дальтон по большей части «выигрывал», позже было признано, что закон определенных пропорций имеет важные исключения. [8]
См. Также [ править ]
- F-центр
- Дефект вакансии
Ссылки [ править ]
- ^ Geng, Hua Y .; и другие. (2012). «Аномалии в нестехиометрическом диоксиде урана, вызванные псевдофазовым переходом точечных дефектов». Phys. Rev. B . 85 (14): 144111. arXiv : 1204.4607 . DOI : 10.1103 / PhysRevB.85.144111 .
- ^ a b Н. Н. Гринвуд и А. Эрншоу, 2012, «Химия элементов», 2-е изд., Амстердам, Нью-Хэмпшир, Нидерланды: Elsevier, ISBN 0080501095 , см. [1] , по состоянию на 8 июля 2015 г. [Номера страниц отмечены надстрочным индексом , в соответствии.]
- ^ Лесли Э. Смарт (2005). Химия твердого тела: Введение, 3-е издание . CRC Press. п. 214. ISBN 978-0-7487-7516-3.
- Перейти ↑ Hubert Lloyd Barnes (1997). Геохимия гидротермальных рудных месторождений . Джон Уайли и сыновья. С. 382–390. ISBN 978-0-471-57144-5.
- ^ Металлоорганические и органические молекулярные магниты Питер Дэй, Королевское химическое общество Алана Э. Андерхилла , 2007, ISBN 1847551394 , ISBN 9781847551399
- ^ a b c Аткинс, П. В.; Овертон, Т.Л .; Рурк, JP; Веллер, М.Т .; Армстронг, Ф.А., 2010, Неорганическая химия Шрайвера и Аткинса, 5-е изд., Стр. 65, 75, 99f, 268, 271, 277, 287, 356, 409, Оксфорд, OXF, GBR: Oxford University Press, ISBN 0199236178 , см. [2] , по состоянию на 8 июля 2015 г.
- ^ Трифториды редкоземельных элементов, часть 2 Arxius de les Seccions de Ciències Дмитрий Н. Хитаров, Борис Павлович Соболев, Ирина В. Алексеева , Institut d'Estudis Catalans, 2000, p75ff. ISBN 847283610X , ISBN 9788472836105
- ^ Генри Маршалл Лестер (1971). Исторические основы химии . Courier Dover Publications. п. 153. ISBN. 9780486610535.
Дальнейшее чтение [ править ]
- Ф. Альберт Коттон , Джеффри Уилкинсон, Карлос А. Мурильо и Манфред Бохманн, 1999, Advanced Inorganic Chemistry, 6-е изд., Стр. 202, 271, 316, 777, 888, 897 и 1145, Нью-Йорк, Нью-Йорк, США: Wiley-Interscience, ISBN 0471199575 , см. [3] , по состоянию на 8 июля 2015 г.
- Роланд Уорд, 1963, Нестехиометрические соединения , Серия « Успехи химии », Vol. 39, Вашингтон, округ Колумбия, США: Американское химическое общество, ISBN 9780841222076 , DOI 10.1021 / ba-1964-0039, см. [4] , по состоянию на 8 июля 2015 г.
- Дж. С. Андерсон, 1963, "Текущие проблемы нестехиометрии (гл. 1)" в нестехиометрических соединениях (Роланд Уорд, ред.), Стр. 1–22, Серия достижений в химии , Vol. 39, Вашингтон, округ Колумбия, США: Американское химическое общество, ISBN 9780841222076 , DOI 10.1021 / ba-1964-0039.ch001, см. [5] , по состоянию на 8 июля 2015 г.