 | |
| Имена | |
|---|---|
| Название ИЮПАК Ортонитрат | |
| Идентификаторы | |
| |
3D модель ( JSmol ) | |
PubChem CID |
|
| |
| |
| Характеристики | |
| НЕТ3- 4 | |
| Молярная масса | 78,006 |
| Конъюгированная кислота | Ортоназотная кислота |
Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки на инфобоксы | |
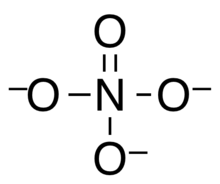
Ортонитрат представляет собой тетраэдрический оксоанион азота с формулой NO3-
4. Впервые он был идентифицирован в 1977 году [1] и в настоящее время известен только в двух соединениях: ортонитрате натрия (Na 3 NO 4 ) и ортонитрате калия (K 3 NO 4 ). Соответствующая оксокислота, ортонитриновая кислота (H 3 NO 4 ), является гипотетической и никогда не наблюдалась. Ортонитрат натрия и калия можно получить сплавлением нитрата и оксида металла при высоких температурах [2] и в идеале высоких давлениях (несколько ГПа ). [3]
- NaNO 3 + Na 2 O → Na 3 NO 4 (300 ° C в течение 3 дней) [4]
Полученные ортонитраты представляют собой белые твердые вещества, чрезвычайно чувствительные к влаге и CO 2 , разлагающиеся в течение нескольких минут до гидроксида натрия, карбоната натрия и нитрата натрия при контакте с воздухом. [1]
- Na 3 NO 4 + CO 2 → NaNO 3 + Na 2 CO 3
- Na 3 NO 4 + H 2 O → NaNO 3 + 2NaOH
Ортонитрат-ион является тетраэдрическим с длиной связи N – O 139 пм, что неожиданно коротко, что указывает на то, что полярные взаимодействия укорачивают связь. [4] Эта короткая длина связи аналогична оксоанионам, содержащим элементы третьего ряда, такие как PO 4 3- и SO 4 2- , для которых связывание pπ-dπ ранее было предложено в качестве объяснения короткой длины связи. Поскольку 3d-орбитали азота имеют слишком большую энергию, чтобы участвовать в случае ортонитрата, короткая связь N – O в ортонитрате указывает на то, что связь pπ-dπ, вероятно, не является наиболее важным объяснением длин связей этих более тяжелых анионов тоже. [2] ( См. Статью о гипервалентности для обсуждения моделей склеивания )
Другие оксоанионы азота [ править ]
Ссылки [ править ]
- ^ a b Янсен, Мартин (август 1977 г.). «Обнаружение ортонитрата методом вибрационной спектроскопии: Na 3 NO 4 ». Angewandte Chemie International Edition на английском языке . 16 (8): 534–535. DOI : 10.1002 / anie.197705341 .
- ^ a b Янсен, Мартин (1979-08-31). «Кристаллическая структура Na 3 NO 4 ». Angewandte Chemie International Edition на английском языке . 18 (9): 698–699. DOI : 10.1002 / anie.197906982 .
- ^ Кесада Кабрера, р .; Sella, A .; Bailey, E .; Leynaud, O .; Макмиллан, П. Ф. (апрель 2011 г.). «Синтез под высоким давлением и структурное поведение ортонитрата натрия Na 3 NO 4 » (PDF) . Журнал химии твердого тела . 184 (4): 915–920. Bibcode : 2011JSSCh.184..915Q . DOI : 10.1016 / j.jssc.2011.02.013 .
- ^ a b Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.