| Аннулирование Робинсона | |
|---|---|
| Названный в честь | Роберт Робинсон |
| Тип реакции | Реакция образования кольца |
| Идентификаторы | |
| Портал органической химии | Робинзон-аннуляция |
| Идентификатор онтологии RSC | RXNO: 0000380 |
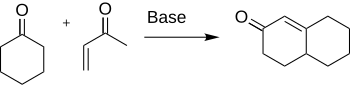
Кольчатость Робинсон является химическая реакция используется в органической химии для образования кольца. Он был открыт Робертом Робинсоном в 1935 году как метод создания шестичленного кольца путем образования трех новых углерод-углеродных связей. [1] В методе используются кетон и метилвинилкетон для образования α, β-ненасыщенного кетона в циклогексановом кольце путем присоединения по Михаэлю с последующей альдольной конденсацией . Эта процедура является одним из ключевых методов формирования систем с конденсированным кольцом.
Образование циклогексенона и его производных важно в химии для их применения для синтеза многих природных продуктов и других интересных органических соединений, таких как антибиотики и стероиды . [2] В частности, синтез кортизона завершается за счет использования аннуляции Робинсона. [3]
Первоначальная статья об аннулировании Робинсона была опубликована Уильямом Рэпсоном и Робертом Робинсоном, в то время как Рэпсон учился в Оксфорде у профессора Робинсона. До их работы синтез циклогексенона не производился из α, β-ненасыщенного кетонового компонента. Первоначальные подходы связывали метилвинилкетон с нафтолом с получением нафтолоксида, но этой процедуры было недостаточно для образования желаемого циклогексенона. Это объяснялось неподходящими условиями реакции. [1]
Робинсон и Рэпсон в 1935 году обнаружили, что взаимодействие между циклогексаноном и α, β-ненасыщенным кетоном дает желаемый циклогексенон. Это остается одним из ключевых методов построения шестичленных кольцевых соединений. Поскольку он так широко используется, существует множество аспектов реакции, которые были исследованы, такие как варианты субстратов и условий реакции, которые обсуждаются в разделе «Объем и варианты». [4] Роберт Робинсон получил Нобелевскую премию по химии в 1947 году за свой вклад в изучение алкалоидов. [5]
Механизм реакции [ править ]
Первоначальная процедура аннулирования Робинсона начинается с нуклеофильной атаки кетона в реакции Майкла на винилкетон с образованием промежуточного аддукта Майкла. Последующее замыкание кольца альдольного типа приводит к кетоспирту, за которым затем следует дегидратация с образованием продукта аннулирования.
В реакции Михаэля кетон депротонируется основанием с образованием енолятного нуклеофила, который атакует акцептор электронов (красный). Этот акцептор обычно представляет собой α, β-ненасыщенный кетон, хотя альдегиды , производные кислоты и подобные соединения также могут работать (см. Объем). В показанном здесь примере региоселективность продиктована образованием термодинамического енолята. Альтернативно, региоселективность часто контролируют с помощью β-дикетона или β-кетоэфира в качестве енолятного компонента, поскольку в значительной степени благоприятствует депротонирование на атоме углерода, фланкированном карбонильными группами. Внутримолекулярная альдольная конденсациязатем происходит так, что устанавливается шестичленное кольцо. В конечном продукте три атома углерода α, β-ненасыщенной системы и углерод α его карбонильной группы образуют четырехуглеродный мостик недавно установленного кольца.
Чтобы избежать реакции между исходным енолятом и циклогексеноновым продуктом, исходный аддукт Михаэля часто сначала выделяют, а затем циклизуют с получением желаемого окталона на отдельной стадии. [6]
Стереохимия [ править ]
Завершены исследования образования гидроксикетонов в схеме реакции аннулирования Робинсона. Транс-соединение является предпочтительным из-за антиперипланарных эффектов конечной альдольной конденсации в кинетически контролируемых реакциях. Также было обнаружено, что циклизация может протекать в синклинальной ориентации. На рисунке ниже показаны три возможных стереохимических пути, предполагающих переходное состояние стула. [7]
Было высказано предположение, что различие в образовании этих переходных состояний и их соответствующих продуктов связано с взаимодействиями растворителей. Сканио обнаружил, что замена растворителя реакции с диоксана на ДМСО дает другую стереохимию на стадии D, описанной выше. Это говорит о том, что присутствие протонных или апротонных растворителей приводит к различным переходным состояниям. [8]
Механистическая классификация [ править ]
Аннуляция Робинсона - один из ярких примеров более широкого класса химических превращений, называемых тандемными реакциями Михаэля-альдола, которые последовательно объединяют реакцию присоединения Майкла и альдольную реакцию в одну реакцию. Как и в случае с аннелированием Робинсона, добавление Майкла обычно сначала происходит для связывания двух реагентов вместе, затем альдольная реакция протекает внутримолекулярно с образованием кольцевой системы в продукте. Обычно образуются пяти- или шестичленные кольца.
Объем и варианты [ править ]
Условия реакции [ править ]
Хотя аннулирование Робинсона обычно проводят в основных условиях, реакции проводят в различных условиях. Хиткок и Эллис сообщают о результатах, аналогичных результатам, полученным при использовании метода основного катализатора с использованием серной кислоты . [2] Реакция Михаэля может происходить в нейтральных условиях через енамин . Основание Манниха могут быть нагреты в присутствии кетона с получением аддукта Михаэля. [6] Сообщалось об успешном приготовлении соединений с использованием методов аннулирования Робинсона. [9]
Акцептор Майкла [ править ]
Типичным акцептором Михаэля является α, β-ненасыщенный кетон, хотя альдегиды и производные кислоты также работают. Кроме того, Bergmann et al. сообщает, что доноры, такие как нитрилы , нитросоединения, сульфоны и некоторые углеводороды, могут быть использованы в качестве акцепторов. [10] В целом, акцепторы Михаэля обычно представляют собой активированные олефины, такие как олефины, показанные ниже, где EWG относится к группе акцепторов электронов, такой как циано, кето или сложный эфир, как показано.
Вихтерле реакция [ править ]
Реакция Вихтерла является вариантом кольчатости Robinson , который заменяет метилвинилкетон с 1,3-дихлор - цис -2-бутны. Это дает пример использования акцептора Михаэля, отличного от типичного α, β-ненасыщенного кетона. 1,3- дихлорцис- 2-бутен используется, чтобы избежать нежелательной полимеризации или конденсации во время добавления Михаэля. [11]
Аннулирование Хаузера [ править ]
Последовательность реакций в соответствующем аннелировании Хаузера представляет собой добавление по Михаэлю с последующей конденсацией Дикмана и, наконец, отщепление. Конденсация Дикмана представляет собой аналогичную внутримолекулярную химическую реакцию с замыканием цикла диэфиров с основанием с образованием β-кетоэфиров. Донор Хаузера представляет собой ароматический сульфон или метиленсульфоксид с группой сложного эфира карбоновой кислоты в орто-положении. Акцептор Хаузера - акцептор Михаэля . В исходной публикации Хаузера этил 2-карбоксибензилфенилсульфоксид реагирует с пент-3-ен-2-оном с LDA в качестве основания в THF при -78 ° C. [12]
Асимметричное аннулирование Робинсона [ править ]
Асимметричный синтез продуктов аннулирования Робинсона чаще всего включает использование пролинового катализатора . Исследования сообщают об использовании L-пролина, а также нескольких других хиральных аминов для использования в качестве катализаторов на обеих стадиях реакции аннулирования Робинсона. [13] Преимущества использования оптически активного пролинового катализа заключаются в том, что они являются стереоселективными с энантиомерным избытком 60–70%. [14]
Ван и др. сообщили об однореакторном синтезе хиральных тиохроменов с помощью такой органокаталитической аннуляции Робинсона. [15]
Приложения к синтезу [ править ]
Кетон Виланд-Мишер является кольчатость продукт Робинсон 2-метил-циклогексан-1,3-дион и метилвинилкетона. Это соединение используется в синтезе многих стероидов, обладающих важными биологическими свойствами, и его можно энантиочистить с помощью пролинового катализа. [14]
F. Dean Toste и соавторы [16] использовали аннулирование Робинсона в общем синтезе (+) - фавцеттимина, тетрациклического алкалоида Lycopodium , который потенциально может применяться для ингибирования ацетилхолинэстеразы .
Энантиоселективный путь к платенсимицину [ править ]
Ученые из Merck недавно открыли новый свинцовый антибиотик с потенциальным медицинским применением под названием платенсимицин, как показано на рисунке рядом.
Первоначальный синтез дал рацемическую форму соединения с использованием реакции внутримолекулярной этерификации спиртовых мотивов и двойной связи. Ямамото сообщает об использовании альтернативного внутримолекулярного аннулирования Робинсона для обеспечения прямого энантиоселективного синтеза тетрациклического ядра платенсимицина. Сообщалось, что ключевой этап аннулирования Робинсона выполнялся в одном сосуде с использованием L-пролина для хирального контроля. Условия реакции можно увидеть ниже. [17]
Ссылки [ править ]
- ^ a b Рэпсон, Уильям Сейдж; Робинсон, Роберт (1935). «307. Эксперименты по синтезу веществ, относящихся к стеролам. Часть II. Новый общий метод синтеза замещенных циклогексенонов». Журнал химического общества (возобновленный) : 1285 DOI : 10.1039 / JR9350001285 .
- ^ a b Heathcock, Clayton H .; Эллис, Джон Э .; Макмерри, Джон Э .; Копполино, Энтони (1971). "Кислотно-катализируемые аннелирования Робинсона". Буквы тетраэдра . 12 (52): 4995–96. DOI : 10.1016 / s0040-4039 (01) 97609-9 .
- ^ Ачесон, РМ; Робинсон, Роберт (1952). «198. Опыты по синтезу кортизона. Часть I. Некоторые производные циклопентенона». Журнал химического общества (возобновленный) : 1127 DOI : 10.1039 / JR9520001127 .
- Перейти ↑ Ho, Tse-Lok (1992). Тандемные органические реакции . Нью-Йорк: Вили. ISBN 978-0-471-57022-6.
- ^ МакМурри, Джон (2008). Органическая химия (7-е изд.). Бельмонт, Калифорния: Томсон Брукс / Коул. ISBN 978-0-495-11258-7.
- ^ a b Гоули, Роберт Э. (1976). «Аннелирование Робинсона и связанные с ним реакции». Синтез . 1976 (12): 777–794. DOI : 10,1055 / с-1976-24200 .
- ^ Nussbaumer, Cornelius (1990). "Стереохимия анелляции Робинсона: исследования способа образования промежуточных гидроксикетонов". Helvetica Chimica Acta . 73 (6): 1621–1636. DOI : 10.1002 / hlca.19900730607 .
- ^ Сканио, Чарльз СП; Старрет, Ричмонд М. (1971). «Замечательно стереоселективная реакция аннулирования Робинсона». Журнал Американского химического общества . 93 (6): 1539–1540. DOI : 10.1021 / ja00735a059 .
- ^ Buchschacher, Пол; А. Фюрст; Дж. Гуцвиллер (1985). «(S) -8a-Метил-3,4,8,8a-Тетрагидро-1,6 (2H, 7H) - Нафталендион» (PDF) . Органический синтез . 63 : 37. DOI : 10,15227 / orgsyn.063.0037 . Архивировано из оригинального (PDF) 24 апреля 2012 года.
- ^ Адамс, Роджер (1959). Органические реакции . Нью-Йорк: John Wiley & Sons, Inc., стр. 179–555. ISBN 978-0471007593.
- ^ Ван, Zerong (2009). «Реакция Вихтерле». Комплексное органическое название реакций и реагентов . Хобокен, Нью-Джерси: Джон Вили. DOI : 10.1002 / 9780470638859.conrr669 . ISBN 978-0-470-63885-9.
- ^ Хаузер, Франк М .; Ри, Ричард П. (1978). «Новые синтетические методы региоселективного аннелирования ароматических колец: 1-гидрокси-2,3-дизамещенных нафталинов и 1,4-дигидрокси-2,3-дизамещенных нафталинов». Журнал органической химии . 43 (1): 178–180. DOI : 10.1021 / jo00395a048 .
- ^ Эдер, Ульрих; Зауэр, Герхард; Вихерт, Рудольф (1971). "Новый тип асимметричной циклизации оптически активных стероидных частичных структур CD". Angewandte Chemie International Edition на английском языке . 10 (7): 496–497. DOI : 10.1002 / anie.197104961 .
- ^ а б Буй, Томми; Барбас, Карлос Ф (2000). «Катализируемая пролином асимметричная реакция аннулирования Робинсона». Буквы тетраэдра . 41 (36): 6951–6954. DOI : 10.1016 / s0040-4039 (00) 01180-1 .
- ^ Wang, W .; Li, H .; Wang, J .; Zu, L., J. Am. Chem. Soc. 2006; 128, 10354.
- ^ Linghu, X .; Кенеди-Смит, JJ; Тосте, ФД (2007). «Полный синтез (+) - фавцеттимина». Энгью. Chem. Int. Эд . 46 (40): 7671–3. DOI : 10.1002 / anie.200702695 . PMID 17729226 .
- ^ Ли, Пинфань; Пайетт, Джошуа Н.; Ямамото, Хисаши (2007). «Энантиоселективный путь к платенсимицину: подход внутримолекулярного аннулирования Робинсона» . Журнал Американского химического общества . 129 (31): 9534–9535. DOI : 10.1021 / ja073547n . PMC 2553032 . PMID 17630748 .