Alphavirus - это род РНК-вирусов , единственный род семейства Togaviridae . Альфавирусы принадлежат к группе IV по классификации Балтимора от вирусов , с положительным чувственным, одноцепочечной РНК генома. Существует 31 альфавирус, который поражает различных позвоночных, таких как люди, грызуны, рыбы, птицы и более крупные млекопитающие, такие как лошади, а также беспозвоночные . Альфавирусы, которые могут инфицировать как позвоночных, так и членистоногих, называются альфавирусами с двумя хозяевами, в то время как специфические для насекомых альфавирусы, такие как вирус Эйлата и вирус Яда-яда, ограничиваются их компетентным переносчиком членистоногих. [1]Передача между видами и отдельными людьми происходит в основном через комаров, что делает альфавирусы членом коллекции арбовирусов или вирусов, переносимых членистоногими . Частицы альфавируса имеют оболочку, диаметр 70 нм, имеют тенденцию быть сферическими (хотя и слегка плеоморфными ) и имеют изометрический нуклеокапсид 40 нм . [2]
Геном [ править ]
| Alpha_E1_glycop | |||||||||
|---|---|---|---|---|---|---|---|---|---|
Кристаллическая структура гомотримера слитого гликопротеина E1 вируса леса Семлики | |||||||||
| Идентификаторы | |||||||||
| Символ | Alpha_E1_glycop | ||||||||
| Pfam | PF01589 | ||||||||
| ИнтерПро | IPR002548 | ||||||||
| SCOP2 | 1рер / СФЕРА / СУПФАМ | ||||||||
| TCDB | 1.G | ||||||||
| OPM суперсемейство | 109 | ||||||||
| Белок OPM | 1рер | ||||||||
| |||||||||
| Alpha_E2_glycop | |||||||||
|---|---|---|---|---|---|---|---|---|---|
Картирование гликопротеина E2 альфавирусов | |||||||||
| Идентификаторы | |||||||||
| Символ | Alpha_E2_glycop | ||||||||
| Pfam | PF00943 | ||||||||
| ИнтерПро | IPR000936 | ||||||||
| TCDB | 1.G | ||||||||
| OPM суперсемейство | 109 | ||||||||
| Белок OPM | 2yew | ||||||||
| |||||||||
| Alpha_E3_glycop | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||
| Символ | Alpha_E3_glycop | ||||||||
| Pfam | PF01563 | ||||||||
| ИнтерПро | IPR002533 | ||||||||
| TCDB | 1.G | ||||||||
| OPM суперсемейство | 109 | ||||||||
| |||||||||
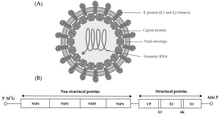
Альфавирусы - это небольшие сферические вирусы с оболочкой, в геноме которых содержится одна цепь позитивно-смысловой РНК. Общая длина генома колеблется от 11 000 до 12 000 нуклеотидов и имеет 5 'шапку и 3' поли-A-хвост . Четыре гена неструктурных белков кодируются в 5'-двух третях генома, тогда как три структурных белка транслируются из субгеномной мРНК, коллинеарной с 3'-одной третью генома.
В геноме есть две открытые рамки считывания (ORF): неструктурная и структурная. Первый является неструктурным и кодирует белки (nsP1 – nsP4), необходимые для транскрипции и репликации вирусной РНК. Второй кодирует три структурных белков: ядро нуклеокапсида белок С, а оболочки белков P62 и E1, которые ассоциируются в качестве гетеродимера . Заякоренные в вирусной мембране поверхностные гликопротеины отвечают за распознавание рецепторов и проникновение в клетки- мишени посредством слияния мембран .
Структурные белки [ править ]
Протеолитическое созревание P62 в Е2 и Е3 приводит к изменению вирусной поверхности. Вместе гликопротеиновые «шипы» E1, E2, а иногда и E3 образуют димер E1 / E2 или тример E1 / E2 / E3, где E2 простирается от центра к вершинам, E1 заполняет пространство между вершинами, а E3, если присутствует, то находится на дистальном конце шипа. [3] При воздействии на вирус кислотности эндосомы E1 диссоциирует от E2 с образованием гомотримера E1 , который необходим на стадии слияния для управления клеточными и вирусными мембранами.вместе. Альфавирусный гликопротеин E1 представляет собой вирусный слитый белок класса II, который структурно отличается от слитых белков класса I, обнаруженных в вирусе гриппа и ВИЧ. Структура вируса Semliki Forest показала структуру, которая аналогична флавивирусного гликопротеин Е, с тремя структурными доменами в одной и то же первичной последовательности расположения. [4] Гликопротеин E2 взаимодействует с нуклеокапсидом через его цитоплазматический домен, а его эктодомен отвечает за связывание с клеточным рецептором.. Большинство альфавирусов теряют периферический белок E3, но у вирусов Семлики он остается связанным с вирусной поверхностью.
Неструктурные белки [ править ]
Четыре неструктурных белка (nsP1–4), которые продуцируются как единый полипротеин, составляют механизм репликации вируса. [5] Процессинг полипротеина происходит строго регулируемым образом, с расщеплением на стыке P2 / 3, влияющим на использование матрицы РНК во время репликации генома. Это место расположено у основания узкой расселины и труднодоступно. После расщепления nsP3 создает кольцевую структуру, которая окружает nsP2. Эти два белка имеют обширный интерфейс.
Мутации в nsP2, которые продуцируют нецитопатические вирусы или чувствительные к температуре фенотипы, группируются в области интерфейса P2 / P3. Мутации P3 напротив расположения нецитопатических мутаций nsP2 предотвращают эффективное расщепление P2 / 3. Это, в свою очередь, влияет на инфекционность РНК, изменяя уровни продукции вирусной РНК.
Вирусология [ править ]
Вирус имеет диаметр 60–70 нанометров . Он имеет оболочку, сферическую форму и имеет геном РНК с положительной цепью размером ~ 12 килобаз. Геном кодирует два полипротеина. Первый полипротеин состоит из четырех неструктурных единиц: от N-конца к C-концу - nsP1, nsP2, nsP3 и nsP4. Второй - структурный полипротеин, состоящий из пяти единиц экспрессии: от N-конца до C-конца - Capsid, E3, E2, 6K и E1. Субгеномная РНК с положительной цепью - 26S РНК - реплицируется из промежуточной РНК с отрицательной цепью. Это служит шаблоном для синтеза вирусных структурных белков. Большинство альфавирусов имеют консервативные домены, участвующие в регуляции синтеза вирусной РНК.
Нуклеокапсид диаметром 40 нанометров содержит 240 копий белка капсида и имеет симметрию икосаэдра T = 4. Вирусные гликопротеины E1 и E2 встроены в липидный бислой. Одиночные молекулы E1 и E2 объединяются с образованием гетеродимеров. Гетеродимеры E1 – E2 образуют взаимно однозначные контакты между белком E2 и мономерами нуклеокапсида. Белки E1 и E2 опосредуют контакт между вирусом и клеткой-хозяином.
Идентифицировано несколько рецепторов. К ним относятся запретитин , фосфатидилсерин , гликозаминогликаны и β-субъединица АТФ-синтазы .
Репликация происходит в цитоплазме, и вирионы созревают, прорастая через плазматическую мембрану, где ассимилируются кодируемые вирусом поверхностные гликопротеины E2 и E1.
Эти два гликопротеина являются мишенями для многочисленных серологических реакций и тестов, включая нейтрализацию и ингибирование гемагглютинации. Альфавирусы проявляют различную степень антигенной перекрестной реактивности в этих реакциях, и это составляет основу семи антигенных комплексов, 30 видов и многих подтипов и разновидностей. Белок E2 является местом расположения большинства нейтрализующих эпитопов, тогда как белок E1 содержит более консервативные, перекрестно-реактивные эпитопы.
Эволюция [ править ]
Изучение этого таксона предполагает, что эта группа вирусов имела морское происхождение - в частности, Южный океан - и что впоследствии они распространились как в Старый, так и в Новый Свет. [6]
В этом роде есть три подгруппы: подгруппа вирусов леса Семлики (вирусы леса Семлики, О'нионг-ньонг и вирусы реки Росс); подгруппа вируса энцефалита восточных лошадей (вирусы энцефалита восточных лошадей и венесуэльского энцефалита лошадей) и подгруппа вируса Синдбис. [7] Вирус Синдбис, географически ограниченный Старым Светом, более тесно связан с подгруппой восточного конского энцефалита, которая представляет собой вирусы Нового Света, чем с подгруппой вируса леса Семлики, которая также встречается в Старом Свете.
Таксономия [ править ]
Группа: оцРНК (+)
- Семья: Togaviridae
- Род: Alphavirus
- Вирус ауры
- Вирус леса Барма
- Вирус Бебару
- Вирус Кабассу
- Вирус чикунгунья
- Вирус восточного конского энцефалита
- Эйлат вирус
- Вирус Эверглейдс
- Вирус Форт Морган
- Вирус Гета
- Вирус Highlands J
- Вирус мадариага
- Вирус Маяро
- Вирус Мидделбурга
- Вирус Моссо дас Педрас
- Вирус мукамбо
- Вирус ндуму
- О'ньонг-ньонг вирус
- Вирус Pixuna
- Вирус Рио-Негро
- Вирус реки Росс
- Вирус болезни поджелудочной железы лосося
- Вирус леса Семлики
- Синдбис вирус
- Вирус южного морского слона
- Тонат вирус
- Вирус троакары
- Уна вирус
- Вирус венесуэльского конского энцефалита
- Вирус западного конского энцефалита
- Вирус Whataroa
[8]
Семь комплексов:
- Комплекс вирусов леса Барма
- Вирус леса Барма
- Комплекс восточного конского энцефалита
- Вирус восточного конского энцефалита (семь антигенных типов)
- Вирусный комплекс Мидделбурга
- Вирус Мидделбурга
- Вирусный комплекс ндуму
- Вирус ндуму
- Лесной вирусный комплекс Семлики
- Вирус Бебару
- Вирус чикунгунья
- Вирус Гета
- Вирус Маяро
- Подтип: вирус Una
- Вирус O'nyong'nyong
- Подтип: вирус игбо-ора
- Вирус реки Росс
- Подтип: вирус Сагияма
- Вирус леса Семлики
- Подтип: Вирус Me Tri
- Венесуэльский конский энцефалит
- Вирус Кабассу
- Вирус Эверглейдс
- Вирус Моссо дас Педрас
- Вирус мукамбо
- Вирус Парамана
- Вирус Pixuna
- Вирус Рио-Негро
- Вирус троакары
- Подтип: вирус моста Биджу
- Вирус венесуэльского конского энцефалита
- Комплекс западного конского энцефалита
- Вирус ауры
- Вирус Бабанки
- Кызылагач вирус
- Синдбис вирус
- Вирус Окельбо
- Вирус Whataroa
- Рекомбинанты в этом комплексе
- Вирус Багги Крик
- Вирус Форт Морган
- Вирус Highlands J
- Вирус западного конского энцефалита
- Неклассифицированный
- Эйлат вирус
- Mwinilunga альфавирусный
- Вирус болезни поджелудочной железы лосося
- Вирус сонной болезни радужной форели
- Вирус южного морского слона
- Тонат вирус
- Вирус кааингуа [9]
Примечания [ править ]
Вирус леса Бармах связан с вирусом леса Семлики. Вирус Мидделбурга, хотя и классифицируется как отдельный комплекс, может быть членом группы вирусов леса Семлики.
Похоже, что этот род произошел в Старом Свете от вируса растений, переносимых насекомыми. [10]
Вирус Синдбис, возможно, возник в Южной Америке. [11] Вирусы конского энцефалита и вирус Синдбис связаны между собой.
Вирусы Старого и Нового Света, по-видимому, разошлись между 2000 и 3000 лет назад. [12] Расхождение между вирусом венесуэльского энцефалита лошадей и вирусом восточного конского энцефалита, по-видимому, произошло около 1400 лет назад. [13]
Рыба, поражающая кладу, кажется базальной по отношению к другим видам.
Вирус южного морского слона, по-видимому, связан с кладой Синбис.
Патогенез и иммунный ответ [ править ]
| Вирус | Болезнь человека | Резервуар позвоночных | Распределение |
|---|---|---|---|
| Вирус леса Барма |
| Люди | Австралия |
| Вирус чикунгунья | Сыпь, артрит | Приматы, люди | Африка, Латинская Америка, Индия , Юго-Восточная Азия |
| Вирус восточного конского энцефалита | Энцефалит | Птицы | Америка |
| Вирус Маяро | Сыпь, артрит | Приматы, люди | Южная Америка |
| Вирус O'nyong'nyong | Сыпь, артрит | Приматы , люди | Африка |
| Вирус реки Росс | Сыпь, артрит | Млекопитающие, люди | Австралия, южная часть Тихого океана |
| Вирус леса Семлики | Сыпь, артрит | Птицы | Африка |
| Синдбис вирус | Сыпь, артрит | Птицы | Европа , Африка , Австралия |
| Тонат вирус | Энцефалит | Люди | Южная Америка |
| Уна вирус | Сыпь, артрит | Приматы, люди | Южная Америка |
| Вирус венесуэльского конского энцефалита | Энцефалит | Грызуны , лошади | Америка |
| Вирус западного конского энцефалита | Энцефалит | Птицы, млекопитающие | Северная Америка |
По всему миру распространено множество альфавирусов, способных вызывать болезни человека. Наиболее часто наблюдаемыми симптомами являются инфекционный артрит , энцефалит , сыпь и лихорадка . Более крупные млекопитающие, такие как люди и лошади, обычно являются тупиковыми хозяевами или играют незначительную роль в передаче вируса; однако в случае венесуэльского энцефалита лошадей вирус в основном усиливается у лошадей. В большинстве других случаев вирус сохраняется в природе у комаров, грызунов и птиц.
Альфавирусные инфекции распространяются насекомыми-переносчиками, такими как комары. Как только человека укусил инфицированный комар, вирус может попасть в кровоток, вызывая виремию . Альфавирус также может попасть в ЦНС, где он может расти и размножаться в нейронах. Это может привести к энцефалиту , который может быть смертельным.
Когда человек инфицирован этим конкретным вирусом, его иммунная система может играть роль в удалении вирусных частиц. Альфавирусы способны вызывать выработку интерферонов . Также задействованы антитела и Т-клетки. Нейтрализующие антитела также играют важную роль в предотвращении дальнейшего заражения и распространения.
Диагностика, профилактика и контроль [ править ]
Диагноз ставится на основании клинических образцов, из которых вирус можно легко выделить и идентифицировать. В настоящее время нет вакцин против альфавируса. Предпочтительными профилактическими мерами являются борьба с переносчиками репеллентов, защитная одежда, уничтожение мест размножения и опрыскивание.
Исследование [ править ]
Альфавирусы представляют интерес для генной терапии исследователи, в частности , вирус Росс - Ривер, Синдбис вирус , вирус Semliki Forest и венесуэльский лошадиный энцефалит вирус все были использованы для разработки вирусных векторов для доставки генов. Особый интерес представляют химерные вирусы, которые могут образовываться с альфавирусными оболочками и ретровирусными капсидами. Такие химеры называют псевдотипными вирусами. Псевдотипы ретровирусов или лентивирусов с альфавирусной оболочкой способны интегрироватьсягены, которые они несут в обширном диапазоне потенциальных клеток-хозяев, которые распознаются и инфицированы альфавирусными белками оболочки E2 и E1. Стабильная интеграция вирусных генов обеспечивается ретровирусными внутренностями этих векторов. Существуют ограничения на использование альфавирусов в области генной терапии.однако из-за их отсутствия нацеливания путем введения вариабельных доменов антител в неконсервативную петлю в структуре E2 были нацелены на определенные популяции клеток. Кроме того, использование целых альфавирусов для генной терапии имеет ограниченную эффективность как потому, что несколько внутренних альфавирусных белков участвуют в индукции апоптоза при инфекции, так и потому, что альфавирусный капсид опосредует только временное введение мРНК в клетки-хозяева. Ни одно из этих ограничений не распространяется на псевдотипы альфавирусной оболочки ретровирусов или лентивирусов. Однако экспрессия оболочек вируса Синдбис может приводить к апоптозу, и их введение в клетки-хозяева при заражении ретровирусами, псевдотипами оболочек вируса Синдбис, также может приводить к гибели клеток.Токсичность вирусных оболочек Синдбис может быть причиной очень низких производственных титров, получаемых от упаковывающих клеток, сконструированных для получения псевдотипов Синдбис. Еще одно направление исследований с участием альфавирусов - вакцинация. Альфавирусы склонны создаватьвекторы репликона, которые эффективно индуцируют гуморальный и Т-клеточный иммунные ответы. Таким образом, их можно использовать для вакцинации против вирусных, бактериальных, простейших и опухолевых антигенов.
История [ править ]
Первоначально семейство Togaviridae включало то, что сейчас называется Flaviviruses , в пределах рода Alphavirus . Флавивирусы были сформированы в отдельное семейство, когда были отмечены существенные различия с альфавирусами в связи с развитием секвенирования. [14] Вирус краснухи ранее был включен в семейство Togaviridae в свой собственный род Rubivirus , но теперь классифицируется в собственном семействе Matonaviridae . [15] Alphavirus сейчас единственный род в семье.
- 1930 - Вирус западного конского энцефалита впервые выделен в Соединенных Штатах (первый когда-либо выделенный альфавирус).
- 1933 - В США впервые выделен вирус восточного конского энцефалита .
- 1938 г. - изолирован венесуэльский конский энцефалит .
- 1941 г. - в США наблюдается эпидемия западного конского энцефалита . От него страдают 300 000 лошадей и 3 336 человек.
- 1941 - Норман Грегг замечает большое количество детей с катарактой после вспышки краснухи. Этот и другие дефекты затем классифицируются как синдром врожденной краснухи .
- 1942 г. - вирус леса Семлики выделен в Булияме, графство Бвамба, Уганда .
- 1952 - Вирус Синдбис изолирован в медицинском районе Синдбис, в 40 милях (64 км) к северу от Каира, Египет .
- 1959 - Вирус реки Росс выделен от комаров Aedes vigilax (ныне известных как Ochlerotatus vigilax ) [16], которые были пойманы в ловушку на реке Росс в Австралии.
- 1963 - Вирус Росс-Ривер, вызывающий эпидемический полиартрит (чаще всего наблюдаемый в Австралии), выделен Доэрти и его коллегами. [17]
- 1971 г. - Последняя эпидемия венесуэльского энцефалита лошадей наблюдается у лошадей в южном Техасе . [18]
- 1986 - Вирус леса Барма определен как вызывающий заболевание человека в Австралии. [19]
- 2001 - Ученые решали кристаллическую структуру из гликопротеина оболочки от вируса Semliki Forest .
- 2005–2006 гг. - крупная эпидемия вируса чикунгунья на острове Реюньон и прилегающих островах в Индийском океане [20]
- 2006 г. - крупная эпидемия вируса чикунгунья в Индии, зарегистрировано более 1,5 миллиона случаев [21]
См. Также [ править ]
- Альфавирусная инфекция
Источники [ править ]
- «Арбовирусы» . Вирусология-онлайн .
- «Источники ICTV» . ICTV . Архивировано из оригинального 12 февраля 2006 года.
- Альфавирусные векторы: от производства белка до генной терапии, С. Смерду и П. Лильестром, Генная терапия и регулирование, том 1, № 1, 2000 г., стр. 33–63
- Райнер Дж.О., Дрыга С.А., Камруд К.И. (2002). «Альфавирусные векторы и вакцинация». Обзоры в медицинской вирусологии . 12 (5): 279–96. DOI : 10.1002 / rmv.360 . PMID 12211042 .
- https://web.archive.org/web/20070302184833/http://ep.physoc.org/cgi/content/full/90/1/45
- https://www.ncbi.nlm.nih.gov/books/NBK7633/
Ссылки [ править ]
- ^ Elrefaey AM, Abdelnabi R, Росалес Росас AL, Ван L, S Басу, Delang L (31 августа 2020). «Понимание механизмов, лежащих в основе ограничения вирусов, специфичных для насекомых» . Вирусы . 12 (9): 964. DOI : 10,3390 / v12090964 .
- ^ Chen R, Mukhopadhyay S, Merits A, Bolling B, Nasar F, Coffey LL, et al. (Июнь 2018). "Профиль таксономии вирусов ICTV: Togaviridae" . Журнал общей вирусологии . 99 (6): 761–762. DOI : 10,1099 / jgv.0.001072 . PMID 29745869 .
- ^ Vénien-Bryan C, Фуллер SD (февраль 1994). «Организация колосового комплекса вируса леса Семлики». J. Mol. Биол . 236 (2): 572–83. DOI : 10.1006 / jmbi.1994.1166 . PMID 8107141 .
- ^ Лескар Дж, Руссель А, Вена МВт, Navaza Дж, Фуллер С.Д., Wengler G, G Wengler, Rey Ф. (апрель 2001 г.). «Оболочка гликопротеина слияния вируса леса Семлики: икосаэдрическая сборка, подготовленная для фузогенной активации при эндосомном pH». Cell . 105 (1): 137–48. DOI : 10.1016 / S0092-8674 (01) 00303-8 . PMID 11301009 .
- ^ Шин Г., Йост С.А., Миллер М.Т., Элрод Э.Дж., Гракуи А., Маркотриджиано Дж. (2012) Структурные и функциональные представления о переработке и патогенезе полипротеинов альфавируса. Proc Natl Acad Sci USA
- ^ Forrester NL, Паласиос G, Tesh RB, Savji N, Гусман H, Шерман M, Weaver SC, Липкин WI (декабрь 2011). «Филогения в масштабе генома рода Alphavirus предполагает морское происхождение» . J Virol . 86 (5): 2729–38. DOI : 10,1128 / JVI.05591-11 . PMC 3302268 . PMID 22190718 .
- Перейти ↑ Levinson RS, Strauss JH, Strauss EG (1990). «Полная последовательность геномной РНК вируса О'ньонг-ньонг и ее использование при построении филогенетических деревьев альфавирусов». Вирусология . 175 (1): 110–123. DOI : 10.1016 / 0042-6822 (90) 90191-S .
- ^ "Отчет ICTV Togaviridae" .
- ^ Tschá М.К., Suzukawa А.А., Gräf Т, Piancini Л.Д., да Силва А.М., Faoro Н, и др. (2019). «Идентификация нового альфавируса, связанного с комплексами энцефалита, циркулирующих в южной Бразилии» . Новые микробы и инфекции . 8 (1): 920–933. DOI : 10.1080 / 22221751.2019.1632152 . PMID 31237479 .
- ^ Пауэрс AM, Brault AC, Shirako Y, Strauss EG, Kang W, Strauss JH, Weaver SC (ноябрь 2001). «Эволюционные связи и систематика альфавирусов» . J. Virol . 75 (21): 10118–31. DOI : 10,1128 / JVI.75.21.10118-10131.2001 . PMC 114586 . PMID 11581380 .
- ^ Lundström JO, Пфеффер M (ноябрь 2010). «Филогеографическая структура и история эволюции вируса Синдбис». Vector Borne Zoonotic Dis . 10 (9): 889–907. DOI : 10.1089 / vbz.2009.0069 . PMID 20420530 .
- ^ Weaver SC, Hagenbaugh A, Bellew LA, Netesov SV, Volchkov VE, Chang GJ, Clarke DK, Gousset L, Scott TW, Trent DW (ноябрь 1993). «Сравнение нуклеотидных последовательностей вирусов восточного и западного энцефаломиелита лошадей с таковыми из других альфавирусов и родственных РНК-вирусов». Вирусология . 197 (1): 375–90. DOI : 10.1006 / viro.1993.1599 . PMID 8105605 .
- ↑ Weaver SC, Rico-Hesse R, Scott TW (1992). «Генетическое разнообразие и медленные темпы эволюции альфавирусов Нового Света». Curr. Вершина. Microbiol. Иммунол . 176 : 99–117. PMID 1318187 .
- ^ "Togaviridae" . stanford.edu.
- ^ "Список Таксономии ICTV" . Дата обращения 5 мая 2020 .
- ^ "Aedes vigilax" . Программа эпиднадзора за арбовирусами и мониторинга переносчиков инфекции в Новом Южном Уэльсе . Программа наблюдения за арбовирусами и комаров в Новом Южном Уэльсе . Проверено 5 июня 2010 года .
Обратите внимание, что «Ochlerotatus vigilax» до 2000 года был известен как «Aedes vigilax».
- ^ Doherty RL, Карли JG, Best JC (май 1972). «Изоляция вируса реки Росс от человека». Медицинский журнал Австралии . 1 (21): 1083–4. PMID 5040017 .
- ^ Calisher СН (январь 1994). «Важные с медицинской точки зрения арбовирусы США и Канады» . Обзоры клинической микробиологии . 7 (1): 89–116. DOI : 10.1128 / CMR.7.1.89 . PMC 358307 . PMID 8118792 .
- ^ Боутон CR, Hawkes RA, Naim HM (февраль 1988). «Болезнь, вызванная вирусом, похожим на лес Барма в Новом Южном Уэльсе». Медицинский журнал Австралии . 148 (3): 146–7. PMID 2828896 .
- ^ Tsetsarkin K, S Хиггс, McGee CE, De Lamballerie X, Charrel RN, Vanlandingham DL (2006). «Инфекционные клоны вируса Чикунгунья (изолят La Réunion) для исследований компетентности переносчиков». Переносимые переносчики и зоонозы . 6 (4): 325–37. DOI : 10.1089 / vbz.2006.6.325 . PMID 17187566 .
- ^ Lahariya C, Pradhan SK (декабрь 2006). «Появление вируса чикунгунья на Индийском субконтиненте через 32 года: обзор». Журнал переносимых болезней . 43 (4): 151–60. PMID 17175699 .
Внешние ссылки [ править ]
- Отчет ICTV Togaviridae
- Viralzone : Alphavirus
- Ресурс базы данных и анализа вирусных патогенов (ViPR): Togaviridae