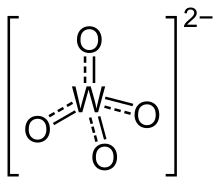
В химии, A вольфрамата представляет собой соединение , которое содержит oxoanion из вольфрама или является смешанный оксид , содержащий вольфрам. Самый простой ион вольфрамата - WO2-
4, «ортовольфрамат». [1] Многие другие вольфраматы принадлежат к большой группе многоатомных ионов, которые называются полиоксометаллатами («ПОМ») и конкретно называются изополиоксометаллатами, поскольку они содержат, наряду с кислородом и, возможно, водородом, только один другой элемент. Практически все полезные вольфрамовые руды относятся к вольфраматам. [2]
Структуры [ править ]
Ортовольфраматы содержат тетраэдрические центры W (VI) с короткими расстояниями W – O 1,79 Å . По структуре они напоминают сульфаты. В полиоксовольфраматах преобладает шестикоординатный октаэдрический вольфрам. В этих соединениях расстояния W – O удлинены. [1]
Некоторые примеры ионов вольфрама: [3]
- HWO-
4(водовольфрамат) [3] - полимерный W
2О2-
7ионы различной структуры в Na 2 W 2 O 7 , Li 2 W 2 O 7 и Ag 2 W 2 O 7 [4] - [W 7 O 24 ] 6- (паравольфрамат A) [3]
- [W 10 O 32 ] 4- (вольфрамат Y) [5]
- [H 2 W 12 O 42 ] 10– (паравольфрамат B) [3]
- α- [H 2 W 12 O 40 ] 6- (метавольфрамат) [5]
- β- [H 2 W 12 O 40 ] 6- (вольфрамат X) [5]
Список вольфраматов см. В категории вольфраматов.
Происшествие [ править ]
Вольфраматы встречаются в природе с молибдатами . Шеелит , минерал вольфрамат кальция, часто содержит небольшое количество молибдата. Вольфрамит - это вольфрамат марганца и железа, и все они являются ценными источниками вольфрама. Пауэллит - это минеральная форма молибдата кальция, содержащая небольшое количество вольфрамата.
Реакции [ править ]
Растворы вольфраматов, как и растворы молибдатов , дают растворы сложного вольфрамата (V, VI) интенсивного синего цвета, аналогичные молибденовой синеве при восстановлении большинством органических материалов. [1]
В отличие от хромата вольфрамат не является хорошим окислителем , но, как и хромат, растворы вольфрамата конденсируются с образованием изополивольфраматов при подкислении.
Ссылки [ править ]
- ^ a b c Эгон Виберг, Арнольд Фредерик Холлеман (2001). Неорганическая химия . Эльзевир. ISBN 0-12-352651-5.
- ^ Ласснер, Эрик; Шуберт, Вольф-Дитер; Людериц, Эберхард; Вольф, Ханс Уве (2005). «Вольфрам, вольфрамовые сплавы и соединения вольфрама». Энциклопедия промышленной химии Ульмана . Вайнхайм: Wiley-VCH. DOI : 10.1002 / 14356007.a27_229 .
- ^ а б в г Гринвуд, Норман Н .; Эрншоу, Алан (1997). Химия элементов (2-е изд.). Баттерворт-Хайнеманн . ISBN 978-0-08-037941-8.
- ^ Уэллс А.Ф. (1984) Структурная неорганическая химия 5-е издание Oxford Science Publications ISBN 0-19-855370-6
- ^ a b c Джон А. МакКлеверти, Н.Г. Коннелли, Номенклатура неорганической химии II: рекомендации 2000 г., Комиссия Международного союза чистой и прикладной химии по номенклатуре неорганической химии, опубликовано Королевским химическим обществом, 2001 г., ISBN 0-85404- 487-6