Аффинная хроматография - это метод отделения биомолекулы от смеси, основанный на высокоспецифическом макромолекулярном связывающем взаимодействии между биомолекулой и другим веществом. Конкретный тип связывающего взаимодействия зависит от интересующей биомолекулы; Взаимодействие связывания антигена и антитела , фермента и субстрата , рецептора и лиганда или белка и нуклеиновой кислоты [1] часто используется для выделения различных биомолекул. Аффинная хроматография полезна благодаря своей высокой селективности и разрешающей способности.разделения, [2] [3] по сравнению с другими хроматографическими методами.
Принцип [ править ]
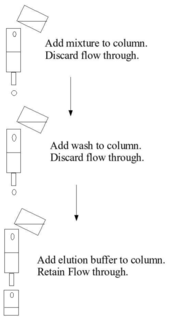
Аффинная хроматография использует преимущества специфических взаимодействий связывания между представляющим интерес аналитом (обычно растворенным в подвижной фазе ) и партнером связывания или лигандом (иммобилизованным на неподвижной фазе ). В типичном эксперименте по аффинной хроматографии лиганд присоединен к твердой нерастворимой матрице - обычно полимеру, такому как агароза или полиакриламид, - химически модифицированному для введения реакционноспособных функциональных групп, с которыми лиганд может реагировать, образуя стабильные ковалентные связи. [4] Стационарную фазу сначала загружают в колонку, в которую вводят подвижную фазу. Молекулы, которые связываются с лигандом, останутся связанными с неподвижной фазой. Затем применяется промывочный буфер для удаления нецелевых биомолекул путем нарушения их более слабого взаимодействия с неподвижной фазой, в то время как представляющие интерес биомолекулы остаются связанными. Затем биомолекулы-мишени могут быть удалены путем применения так называемого буфера для элюирования, который нарушает взаимодействия между связанными биомолекулами-мишенями и лигандом. Таким образом, целевая молекула восстанавливается в элюирующем растворе. [5]
Аффинная хроматография не требует знания молекулярной массы, заряда, гидрофобности или других физических свойств интересующего аналита, хотя знание его связывающих свойств полезно при разработке протокола разделения. [5] Типы связывающих взаимодействий, обычно используемые в процедурах аффинной хроматографии, приведены в таблице ниже.
Типичные биологические взаимодействия, используемые в аффинной хроматографии [6]
| Старший Нет | Типы лигандов | Целевая молекула |
|---|---|---|
| 1 | Аналог субстрата | Ферменты |
| 2 | Антитела | Антиген |
| 3 | Лектин | Полисахарид |
| 4 | Нуклеиновая кислота | Дополнительная базовая последовательность |
| 5 | Гормон | Рецептор |
| 6 | Авидин | Биотин / биотин-конъюгированная молекула |
| 7 | Кальмодулин | Партнер связывания кальмодулина |
| 8 | Глутатион | Слитый белок GST |
| 9 | Белки А и G | Иммуноглобулины |
| 10 | Ионы металлов | Слитый белок с поли-гистидином |
Наборы пакетов и столбцов [ править ]
Связывание с твердой фазой может быть достигнуто с помощью колоночной хроматографии, при которой твердая среда набивается на колонку, исходная смесь проходит через колонку для осаждения, промывочный буфер проходит через колонку, а буфер для элюирования затем наносится на колонку и собирается . Эти действия обычно выполняются при атмосферном давлении. В качестве альтернативы связывание может быть достигнуто с использованием периодической обработки, например, путем добавления исходной смеси к твердой фазе в сосуде, перемешивания, разделения твердой фазы, удаления жидкой фазы, промывки, повторного центрифугирования, добавления буфера для элюирования, повторное центрифугирование и удаление элюата.
Иногда используется гибридный метод, при котором связывание осуществляется периодическим методом, но твердая фаза со связанной молекулой-мишенью набивается на колонку, а промывание и элюирование осуществляются на колонке.
Лиганды, используемые в аффинной хроматографии, получают как из органических, так и из неорганических источников. Примерами биологических источников являются сывороточные белки, лектины и антитела. Неорганические источники в виде дебильных веществ, хелатов металлов и триазиновых красителей. [7]
Также был разработан третий метод, абсорбция расширенным слоем, который сочетает в себе преимущества двух методов, упомянутых выше. Частицы твердой фазы помещаются в колонну, где жидкая фаза закачивается снизу и выходит наверху. Плотность частиц гарантирует, что твердая фаза не покинет колонну с жидкой фазой.
Аффинные колонки можно элюировать путем изменения концентраций солей, pH, pI, заряда и ионной силы напрямую или с помощью градиента для разделения интересующих частиц.
Совсем недавно были разработаны установки, в которых последовательно используется более одной колонки. Преимущество по сравнению с установками с одной колонкой состоит в том, что полимерный материал может быть полностью загружен, поскольку не связывающий продукт напрямую направляется в следующую колонку со свежим материалом колонки. Эти хроматографические процессы известны как периодическая противоточная хроматография (PCC). Таким образом, можно резко снизить затраты на смолу на количество произведенного продукта. Поскольку одна колонка всегда может быть элюирована и регенерирована, в то время как другая колонка загружена, уже двух колонок достаточно, чтобы полностью использовать преимущества. [8] Дополнительные колонки могут дать дополнительную гибкость в отношении времени элюирования и регенерации за счет дополнительного оборудования и затрат на смолу.
Конкретное использование [ править ]
Аффинная хроматография может использоваться в ряде приложений, включая очистку нуклеиновых кислот, очистку белков [9] из бесклеточных экстрактов и очистку из крови.
Используя аффинную хроматографию, можно отделить белки, которые связываются с определенным фрагментом, от белков, которые не связываются с этим конкретным фрагментом. [10] Поскольку этот метод очистки основан на биологических свойствах необходимого белка, это полезный метод, и белки можно очищать во много раз за один этап. [11]
Различные медиа по интересам [ править ]
Существует множество различных аффинити-медиа для множества возможных применений. [12] [13] [14] Вкратце, они (обобщенно) активированы / функционализированы, которые работают как функциональный спейсер, поддерживающая матрица и исключают работу с токсичными реагентами.
Аминокислотные среды используются с различными сывороточными белками, белками, пептидами и ферментами, а также с рРНК и дцДНК. Авидин-биотиновая среда используется в процессе очистки биотина / авидина и их производных.
Углеводное связывание чаще всего используется с гликопротеинами или любым другим углеводсодержащим веществом; углевод используется с лектинами, гликопротеинами или любым другим белком метаболита углеводов. Среда с красителем-лигандом неспецифична, но имитирует биологические субстраты и белки. Глутатион полезен для разделения рекомбинантных белков, меченных GST. Гепарин - это обобщенный аффинный лиганд, и он наиболее полезен для разделения белков свертывания плазмы, наряду с ферментами нуклеиновых кислот и липазами.
Среды для гидрофобного взаимодействия чаще всего используются для нацеливания на свободные карбоксильные группы и белки.
Иммуноаффинная среда (подробно описанная ниже) использует высокую специфичность антигенов и антител для разделения; аффинная хроматография с иммобилизованным металлом подробно описана ниже и использует взаимодействия между ионами металлов и белками (обычно специально помеченными) для разделения; нуклеотид / кофермент, который работает для разделения дегидрогеназ, киназ и трансаминаз.
Нуклеиновые кислоты улавливают мРНК, ДНК, рРНК и другие нуклеиновые кислоты / олигонуклеотиды. Метод белка A / G используется для очистки иммуноглобулинов.
Специальные среды разработаны для определенного класса или типа белка / кофермента; этот тип среды будет работать только для разделения определенного белка или кофермента.
Иммуноаффинность [ править ]
Еще одно применение процедуры - аффинная очистка антител из сыворотки крови. Если известно, что сыворотка содержит антитела против определенного антигена (например, если сыворотка получена из организма, иммунизированного против соответствующего антигена), то ее можно использовать для аффинной очистки этого антигена. Это также известно как иммуноаффинная хроматография. Например, если организм иммунизирован против слитого с GST белка, он будет продуцировать антитела против слитого белка и, возможно, также антитела против GST-метки. Затем белок можно ковалентно связать с твердой подложкой, такой как агароза, и использовать в качестве аффинного лиганда при очистке антитела из иммунной сыворотки.
Для тщательности каждый из белков GST и слитый с GST белок может быть соединен отдельно. Первоначально сыворотке дают возможность связываться с аффинной матрицей GST. Это удалит антитела против GST части слитого белка. Затем сыворотку отделяют от твердой подложки и дают возможность связываться с матрицей слитого с GST белка. Это позволяет любым антителам, распознающим антиген, улавливаться на твердой подложке. Элюирование представляющих интерес антител чаще всего достигается с использованием буфера с низким pH, такого как глицин pH 2,8. Элюат собирают в нейтральный трис or phosphate buffer, to neutralize the low pH elution buffer and halt any degradation of the antibody's activity. This is a nice example as affinity purification is used to purify the initial GST-fusion protein, to remove the undesirable anti-GST antibodies from the serum and to purify the target antibody.
Monoclonal antibodies can also be selected to bind proteins with great specificity, where protein is released under fairly gentle conditions. This can become of use for further research in the future.[15]
A simplified strategy is often employed to purify antibodies generated against peptide antigens. When the peptide antigens are produced synthetically, a terminal cysteine residue is added at either the N- or C-terminus of the peptide. This cysteine residue contains a sulfhydryl functional group which allows the peptide to be easily conjugated to a carrier protein (e.g. Keyhole limpet hemocyanin (KLH)). The same cysteine-containing peptide is also immobilized onto an agarose resin through the cysteine residue and is then used to purify the antibody.
Most monoclonal antibodies have been purified using affinity chromatography based on immunoglobulin-specific Protein A or Protein G, derived from bacteria.[16]
Immunoaffinity chromatography with monoclonal antibodies immobilized on monolithic column has been successfully used to capture extracellular vesicles (e.g., exosomes and exomeres) from human blood plasma by targeting tetraspanins and integrins found on the surface of the EVs.[17][18]
Immunoaffinity chromatography is also the basis for immunochromatographic test (ICT) strips, which provide a rapid means of diagnosis in patient care. Using ICT, a technician can make a determination at a patient's bedside, without the need for a laboratory.[19] ICT detection is highly specific to the microbe causing an infection.[20]
Immobilized metal ion affinity chromatography[edit]
Immobilized metal ion affinity chromatography (IMAC) is based on the specific coordinate covalent bond of amino acids, particularly histidine, to metals. This technique works by allowing proteins with an affinity for metal ions to be retained in a column containing immobilized metal ions, such as cobalt, nickel, copper for the purification of histidine-containing proteins or peptides, iron, zinc or gallium for the purification of phosphorylated proteins or peptides. Many naturally occurring proteins do not have an affinity for metal ions, therefore recombinant DNA technology can be used to introduce such a protein tag into the relevant gene. Methods used to elute the protein of interest include changing the pH, or adding a competitive molecule, such as imidazole.[21][22]
Recombinant proteins[edit]
Possibly the most common use of affinity chromatography is for the purification of recombinant proteins. Proteins with a known affinity are protein tagged in order to aid their purification. The protein may have been genetically modified so as to allow it to be selected for affinity binding; this is known as a fusion protein. Tags include hexahistidine (His), glutathione-S-transferase (GST) and maltose binding protein (MBP). Histidine tags have an affinity for nickel, cobalt, zinc, copper and iron ions which have been immobilized by forming coordinate covalent bonds with a chelator incorporated in the stationary phase. For elution, an excess amount of a compound able to act as a metal ion ligand, such as imidazole, is used. GST has an affinity for glutathione which is commercially available immobilized as glutathione agarose. During elution, excess glutathione is used to displace the tagged protein.
Lectins[edit]
Lectin affinity chromatography is a form of affinity chromatography where lectins are used to separate components within the sample. Lectins, such as concanavalin A are proteins which can bind specific alpha-D-mannose and alpha-D-glucose carbohydrate molecules. Some common carbohydrate molecules that is used in lectin affinity chromatography are Con A-Sepharose and WGA-agarose.[23] Another example of a lectin is wheat germ agglutinin which binds D-N-acetyl-glucosamine.[24] The most common application is to separate glycoproteins from non-glycosylated proteins, or one glycoform from another glycoform.[25] Although there are various ways to perform lectin affinity chromatography, the goal is extract a sugar ligand of the desired protein.[23]
Specialty[edit]
Another use for affinity chromatography is the purification of specific proteins using a gel matrix that is unique to a specific protein. For example, the purification of E. coli β-galactosidase is accomplished by affinity chromatography using p-aminobenyl-1-thio-β-D-galactopyranosyl agarose as the affinity matrix. p-aminobenyl-1-thio-β-D-galactopyranosyl agarose is used as the affinity matrix because it contains a galactopyranosyl group, which serves as a good substrate analog for E.Coli-B-Galactosidase. This property allows the enzyme to bind to the stationary phase of the affinity matrix and is eluted by adding increasing concentrations of salt to the column.[26]
Alkaline phosphatase[edit]
Alkaline phosphatase from E. coli can be purified using a DEAE-Cellulose matrix. A. phosphatase has a slight negative charge, allowing it to weakly bind to the positively charged amine groups in the matrix. The enzyme can then be eluted out by adding buffer with higher salt concentrations.[27]
Boronate affinity chromatography[edit]
Boronate affinity chromatography consists of using boronic acid or boronates to elute and quantify amounts of glycoproteins. Clinical adaptations have applied this type of chromatography for use in determining long term assessment of diabetic patients through analysis of their glycated hemoglobin.[24]
Serum albumin purification[edit]
Of many uses of affinity chromatography, one use of it is seen in affinity purification of albumin and macroglobulin contamination. This type of purification is helpful in removing excess albumin and α2-macroglobulin contamination, when performing mass spectrometry. In affinity purification of serum albumin, the stationary used for collecting or attracting serum proteins can be Cibacron Blue-Sepharose. Then the serum proteins can be eluted from the adsorbent with a buffer containing thiocyanate (SCN−).[28]
Weak affinity chromatography[edit]
Weak affinity chromatography[29] (WAC) is an affinity chromatography technique for affinity screening in drug development.[30][31] WAC is an affinity-based liquid chromatographic technique that separates chemical compounds based on their different weak affinities to an immobilized target. The higher affinity a compound has towards the target, the longer it remains in the separation unit, and this will be expressed as a longer retention time. The affinity measure and ranking of affinity can be achieved by processing the obtained retention times of analyzed compounds.
The WAC technology is demonstrated against a number of different protein targets – proteases, kinases, chaperones and protein–protein interaction (PPI) targets. WAC has been shown to be more effective than established methods for fragment based screening.[31]
History[edit]
Affinity chromatography was conceived and first developed by Pedro Cuatrecasas and Meir Wilchek.[32][33]
References[edit]
- ^ Aizpurua-Olaizola, Oier; Sastre Torano, Javier; Pukin, Aliaksei; Fu, Ou; Boons, Geert Jan; de Jong, Gerhardus J.; Pieters, Roland J. (January 2018). "Affinity capillary electrophoresis for the assessment of binding affinity of carbohydrate-based cholera toxin inhibitors". Electrophoresis. 39 (2): 344–347. doi:10.1002/elps.201700207. PMID 28905402. S2CID 33657660.
- ^ Ninfa, Alexander J.; Ballou, David P.; Benore, Marilee (2009). Fundamental Laboratory Approaches for Biochemistry and Biotechnology (2nd ed.). Wiley. p. 133. ISBN 9780470087664.
- ^ ""Introduction to Affinity Chromatography"". bio-rad.com. Bio-Rad. 2020-09-14. Retrieved 2020-09-14.
- ^ Zachariou, Michael (ed.) (2008). Affinity Chromatography: Methods and Protocols (2nd ed.). Totowa, NJ: Humana Press. ISBN 9781588296597.CS1 maint: extra text: authors list (link)
- ^ a b Bonner, Philip L.R. (2007). Protein Purification (2nd ed.). Totowa, NJ: Taylor & Francis Group. ISBN 9780415385114.
- ^ Kumar, Pranav (2018). Biophysics and Molecular Biology. New Delhi: Pathfinder Publication. p. 11. ISBN 978-93-80473-15-4.
- ^ Fanali, Salvatore; Haddad, Paul R.; Poole, Colin F.; Schoenmakers, Peter; Lloyd, David, eds. (2013). Liquid Chromatography : Applications. Handbooks in Separation Science. Saint Louis: Elsevier. p. 3. ISBN 9780124158061.
- ^ Baur, Daniel; Angarita, Monica; Müller-Späth, Thomas; Steinebach, Fabian; Morbidelli, Massimo (2016). "Comparison of batch and continuous multi-column protein A capture processes by optimal design". Biotechnology Journal. 11 (7): 920–931. doi:10.1002/biot.201500481. PMID 26992151.
- ^ "Cube Biotech". Cube Biotech. Retrieved 2019-09-11.
- ^ Ahern, Kevin (February 12, 2015). Biochemistry Free & Easy. DaVinci Press; 3rd Edition. p. 822.
- ^ M., Grisham, Charles (2013-01-01). Biochemistry. Brooks/Cole, Cengage Learning. ISBN 978-1133106296. OCLC 777722371.
- ^ Mahmoudi Gomari, Mohammad; Saraygord-Afshari, Neda; Farsimadan, Marziye; Rostami, Neda; Aghamiri, Shahin; Farajollahi, Mohammad M. (1 December 2020). "Opportunities and challenges of the tag-assisted protein purification techniques: Applications in the pharmaceutical industry". Biotechnology Advances. 45: 107653. doi:10.1016/j.biotechadv.2020.107653. ISSN 0734-9750.
- ^ "Cube Biotech". Cube Biotech. Retrieved 2019-09-11.
- ^ "Affinity Chromatography".
- ^ Thompson, Nancy E.; Foley, Katherine M.; Stalder, Elizabeth S.; Burgess, Richard R. (2009). Guide to Protein Purification, 2nd Edition. Methods in Enzymology. 463. pp. 475–494. doi:10.1016/s0076-6879(09)63028-7. ISBN 9780123745361. PMID 19892188.
- ^ Uhlén M (2008). "Affinity as a tool in life science". BioTechniques. 44 (5): 649–54. doi:10.2144/000112803. PMID 18474040.
- ^ Multia E, Tear CJ, Palviainen M, et al. (December 2019). "Fast isolation of highly specific population of platelet-derived extracellular vesicles from blood plasma by affinity monolithic column, immobilized with anti-human CD61 antibody". Analytica Chimica Acta. 1091: 160–168. doi:10.1016/j.aca.2019.09.022. hdl:10138/321264. PMID 31679569.
- ^ Multia E, Liangsupree T, Jussila M, et al. (September 2020). "Automated On-Line Isolation and Fractionation System for Nanosized Biomacromolecules from Human Plasma". Analytical Chemistry. 92: 13058–13065. doi:10.1021/acs.analchem.0c01986. PMID 32893620.
- ^ Luppa, Peter (2018). Point-of-care testing : principles and clinical applications. Berlin, Germany: Springer. pp. 71–72. ISBN 9783662544976.
- ^ J. D. Muller; C. R. Wilks; K. J. O'Riley; R. J. Condron; R. Bull; A. Mateczun (2004). "Specificity of an immunochromatographic test for anthrax". Australian Veterinary Journal. 82 (4): 220–222. doi:10.1111/j.1751-0813.2004.tb12682.x. PMID 15149073.
- ^ Singh, Naveen K.; DSouza, Roy N.; Bibi, Noor S.; Fernández-Lahore, Marcelo (2015). "Chapter 16 Direct Capture of His6-Tagged Proteins Using Megaporous Cryogels Developed for Metal-Ion Affinity Chromatography". In Reichelt, S. (ed.). Affinity Chromatography. Methods in Molecular Biology. 1286. New York, NY: Humana Press. pp. 201–212. doi:10.1007/978-1-4939-2447-9_16. ISBN 978-1-4939-2447-9. PMID 25749956.
- ^ Gaberc-Porekar, Vladka K.; Menart, Viktor (2001). "Perspectives of immobilized-metal affinity chromatography". J Biochem Biophys Methods. 49 (1–3): 335–360. doi:10.1016/S0165-022X(01)00207-X. PMID 11694288.
- ^ a b Freeze, H. H. (May 2001). Lectin affinity chromatography. Current Protocols in Protein Science. Chapter 9. pp. 9.1.1–9.1.9. doi:10.1002/0471140864.ps0901s00. ISBN 978-0471140863. ISSN 1934-3663. PMID 18429210. S2CID 3197260.
- ^ a b Hage, David (May 1999). "Affinity Chromatography: A Review of Clinical Applications" (PDF). Clinical Chemistry. 45 (5): 593–615. doi:10.1093/clinchem/45.5.593. PMID 10222345.
- ^ "GE Healthcare Life Sciences, Immobilized lectin". Archived from the original on 2012-03-03. Retrieved 2010-11-29.
- ^ Ninfa, Alexander J.; Ballou, David P.; Benore, Marilee (2006). Fundamental Laboratory Approaches for Biochemistry and Biotechnology (2nd ed.). Wiley. p. 153.
- ^ Ninfa, Alexander J.; Ballou, David P.; Benore, Marilee (2010). Fundamental laboratory approaches for biochemistry and biotechnology (2nd ed.). Hoboken, NJ: John Wiley. p. 240. ISBN 9780470087664. OCLC 420027217.
- ^ Naval, Javier; Calvo, Miguel; Lampreave, Fermin; Piñeiro, Andrés (1983-01-01). "Affinity chromatography of serum albumin: An illustrative laboratory experiment on biomolecular interactions". Biochemical Education. 11 (1): 5–8. doi:10.1016/0307-4412(83)90004-3. ISSN 1879-1468.
- ^ Zopf, D.; S. Ohlson (1990). "Weak-affinity chromatography". Nature. 346 (6279): 87–88. Bibcode:1990Natur.346...87Z. doi:10.1038/346087a0. ISSN 0028-0836. S2CID 4306269.
- ^ Duong-Thi, M. D.; Meiby, E.; Bergström, M.; Fex, T.; Isaksson, R.; Ohlson, S. (2011). "Weak affinity chromatography as a new approach for fragment screening in drug discovery". Analytical Biochemistry. 414 (1): 138–146. doi:10.1016/j.ab.2011.02.022. PMID 21352794.
- ^ a b Meiby, E.; Simmonite, H.; Le Strat, L.; Davis, B.; Matassova, N.; Moore, J. D.; Mrosek, M.; Murray, J.; Hubbard, R. E.; Ohlson, S. (2013). "Fragment Screening by Weak Affinity Chromatography: Comparison with Established Techniques for Screening against HSP90". Analytical Chemistry. 85 (14): 6756–6766. doi:10.1021/ac400715t. PMID 23806099.
- ^ "Meir Wilchek - Wolf Foundation". Wolf Foundation. Retrieved 17 March 2021.
Affinity chromatography is a novel technique which was conceived by Cuatrecasas and Wilchek
- ^ P Cuatrecasas; M Wilchek; C B Anfinsen (October 1968). "Selective enzyme purification by affinity chromatography". Proc Natl Acad Sci U S A. 61 (2): 636–643. Bibcode:1968PNAS...61..636C. doi:10.1073/pnas.61.2.636. PMC 225207. PMID 4971842.
External links[edit]
"Affinity Chromatography Principle, Procedure And Advance Detailed Note - 2020".
| Library resources about Affinity chromatography |
|