Биомаркеры старения - это биомаркеры, которые могут прогнозировать функциональную способность в более позднем возрасте лучше, чем хронологический возраст. [1] Другими словами, биомаркеры старения дадут истинный «биологический возраст», который может отличаться от хронологического возраста.
Подтвержденные биомаркеры старения позволят тестировать вмешательства для увеличения продолжительности жизни , потому что изменения в биомаркерах будут наблюдаться на протяжении всей жизни организма. [1] Хотя максимальная продолжительность жизни была бы средством подтверждения биомаркеров старения, это не было бы практическим средством для долгоживущих видов, таких как люди, потому что лонгитюдные исследования потребовали бы слишком много времени. [2] В идеале биомаркеры старения должны анализировать биологический процесс старения, а не предрасположенность к заболеванию, должны вызывать минимальное количество травм для анализа в организме и должны воспроизводиться в течение короткого интервала времени по сравнению с продолжительностью жизни человека. организм.[1] Набор данных биомаркеров для организма можно назвать его «агеотипом». [3]
Хотя поседение волос увеличивается с возрастом [4], поседение волос нельзя назвать биомаркером старения. Точно так же морщины на коже и другие общие изменения, наблюдаемые при старении, не являются лучшими индикаторами будущей функциональности, чем хронологический возраст. Биогеронтологи продолжали попытки найти и проверить биомаркеры старения, но пока успехи были ограниченными. Уровни CD4 и CD8 Т-клеток памяти и наивных Т-клеток были использованы для получения хороших прогнозов ожидаемой продолжительности жизни мышей среднего возраста. [5]
Достижения в области анализа больших данных позволили разработать новые типы «часов старения». Эпигенетические часы являются перспективным биомаркером старения и могут точно предсказать , хронологический возраст человека. [6] Базовая биохимия крови и подсчет клеток также могут быть использованы для точного прогнозирования хронологического возраста. [7] Дальнейшие исследования гематологических часов на больших наборах данных из южнокорейского, канадского и восточноевропейского населения показали, что биомаркеры старения могут быть специфичными для популяции и предсказывать смертность. [8] Также можно предсказать хронологический возраст человека с помощью транскриптомных часов . [9]
Недавнее внедрение маломощных и компактных датчиков, основанных на микроэлектромеханических системах ( МЭМС ), привело к появлению нового поколения носимых и доступных устройств, обеспечивающих беспрецедентные возможности для сбора и хранения персональных данных о деятельности в цифровом виде. Следовательно, современные методы глубокого машинного обучения могут быть использованы для создания подтверждающего концепцию цифрового биомаркера возраста в форме предиктора смертности от всех причин на основе достаточно большой коллекции однонедельных потоков физической активности человека, дополненных обширными клиническими данными. данные (включая регистр смертей, предоставленный, например, исследованием NHANES ). [10]
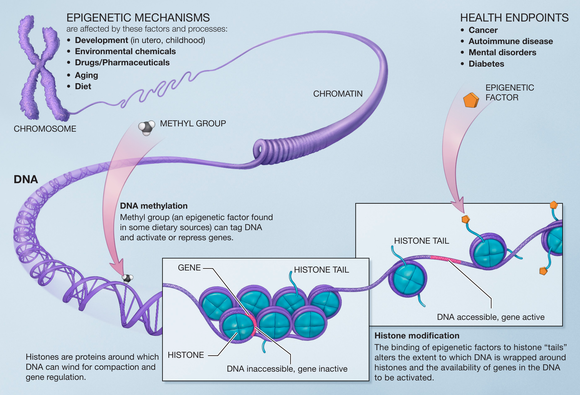
Эпигенетические метки [ править ]
Потеря гистонов [ править ]
Новым эпигенетическим признаком, обнаруженным при исследованиях стареющих клеток, является потеря гистонов . Большинство данных показывает, что потеря гистонов связана с делением клеток. При старении и делении дрожжей MNase-seq (секвенирование микрококковой нуклеазы) показала потерю нуклеосом примерно на 50%. Правильная дозировка гистонов важна для дрожжей, как показывает увеличенная продолжительность жизни, наблюдаемая у штаммов, которые сверхэкспрессируют гистоны. [11] Следствием потери гистонов в дрожжах является усиление транскрипции . В более молодых клетках гены, которые больше всего индуцируются с возрастом, имеют специфические структуры хроматина, такие как нечеткое ядерное расположение, отсутствие области, истощенной нуклеомами (NDR) на промоторе., слабая фазировка хроматина, более высокая частота элементов TATA и более высокая степень занятости репрессивных факторов хроматина. В более старых клетках, однако, потеря нуклеосом тех же генов на промоторе более распространена, что приводит к более высокой транскрипции этих генов. [11]
Это явление наблюдается не только у дрожжей, но также наблюдается у стареющих червей, во время старения диплоидных первичных фибробластов человека и в стареющих клетках человека. В первичных фибробластах человека снижение синтеза новых гистонов было замечено как следствие укороченных теломер, которые активируют ответ на повреждение ДНК. Потеря ядер гистонов может быть общим эпигенетическим признаком старения у многих организмов. [12]
Варианты гистонов [ править ]
Помимо основных гистонов, H2A, H2B, H3 и H4, существуют другие версии гистоновых белков, которые могут значительно отличаться по своей последовательности и важны для регуляции динамики хроматина. Гистон H3.3 представляет собой вариант гистона H3, который включается в геном независимо от репликации. Это основная форма гистона H3, обнаруженная в хроматине стареющих клеток человека, и, похоже, избыток H3.3 может управлять старением . [12]
Существует множество вариантов гистона 2, один из которых наиболее заметно влияет на старение - это macroH2A. Обычно предполагалось, что функцией macroH2A является подавление транскрипции; совсем недавно было высказано предположение, что macroH2A играет важную роль в репрессии транскрипции в ассоциированных со старением гетерохроматиновых очагах (SAHF). [12] Хроматин, содержащий macroH2A, непроницаем для АТФ-зависимых белков ремоделирования и для связывания факторов транскрипции . [13]
Модификации гистонов [ править ]
Повышенное ацетилирование гистонов способствует тому, что хроматин принимает более эухроматическое состояние по мере старения организма, подобно повышенной транскрипции, наблюдаемой из-за потери гистонов. [14] Также наблюдается снижение уровня H3K56ac во время старения и повышение уровня H4K16ac . [11] Повышенный уровень H4K16ac в старых дрожжевых клетках связан со снижением уровня HDAC Sir2, что может увеличить продолжительность жизни при сверхэкспрессии. [11]
Метилирование гистонов связано с регуляцией продолжительности жизни у многих организмов, в частности с H3K4me3, активирующей меткой и H4K27me3, репрессирующей меткой. У C. elegans потеря любого из трех белков Trithorax, которые катализируют триметилирование H3K4, таких как WDR-5 и метилтрансферазы SET-2 и ASH-2, снижает уровни H3K4me3 и увеличивает продолжительность жизни. Потеря фермента, деметилирующего H3K4me3, RB-2, увеличивает уровни H3K4me3 у C. elegans и сокращает продолжительность их жизни. [14] В резус макаки мозга префронтальной коры , H3K4me2 возрастает при промоторов и усилителей во время постнатального развития истарение . [15] Это увеличение отражает прогрессивно более активные и транскрипционно доступные (или открытые) структуры хроматина , которые часто связаны со стрессовыми реакциями, такими как реакция на повреждение ДНК . Эти изменения могут формировать эпигенетическую память о стрессах и повреждениях, испытываемых организмом по мере его развития и старения. [15]
UTX-1, деметилаза H3K27me3 , играет решающую роль в старении C.elegans : повышенная экспрессия utx-1 коррелирует с уменьшением H3K27me3 и сокращением продолжительности жизни. Нокдауны Utx-1 показали увеличение продолжительности жизни [14]. Изменения уровней H3K27me3 также влияют на стареющие клетки у дрозофилы и человека.
Метилирование ДНК [ править ]
Метилирование ДНК - обычная модификация в клетках млекопитающих . Основание цитозина метилируется и становится 5-метилцитозином , чаще всего в контексте CpG . Гиперметилирование CpG-островков связано с репрессией транскрипции, а гипометилирование этих сайтов связано с активацией транскрипции. Многие исследования показали, что во время старения происходит потеря метилирования ДНК у многих видов, таких как крысы, мыши, коровы, хомяки и люди. Также было показано, что DNMT1 и DNMT3a уменьшаются с возрастом, а DNMT3b увеличивается. [16]
Гипометилирование ДНК может снизить стабильность генома, вызвать реактивацию мобильных элементов и вызвать потерю импринтинга , что может способствовать прогрессированию рака и патогенезу . [16]
Иммунные биомаркеры [ править ]
Недавние данные свидетельствуют о том, что повышенная частота стареющих CD8 + Т-клеток в периферической крови связана с развитием гипергликемии из преддиабетического состояния, указывающего на то, что старение играет роль в метаболическом старении. Старые Cd8 + Т-клетки можно использовать в качестве биомаркера, чтобы сигнализировать о переходе от преддиабета к явной гипергликемии. [17]
Недавно Хашимото и его коллеги профилировали тысячи циркулирующих иммунных клеток от пожилых людей с разрешением одной клетки. Они выявили уникальное увеличение цитотоксических CD4 Т-лимфоцитов у этих долгожителей. Как правило, Т-клетки CD4 выполняют вспомогательные, но не цитотоксические, функции в физиологических условиях, однако эти сверхстолетние люди, подвергнутые профилированию отдельных клеток своих Т-клеточных рецепторов, выявили скопления цитотоксических Т-клеток CD4 посредством клональной экспансии. Превращение вспомогательных Т-лимфоцитов CD4 в цитотоксические может быть адаптацией к поздней стадии старения, помогая бороться с инфекциями и потенциально усиливая надзор за опухолью. [18]
Применение биомаркеров старения [ править ]
Основными механизмами, идентифицированными как потенциальные биомаркеры старения, являются метилирование ДНК, потеря гистонов и модификация гистонов. Биомаркеры старения используются повсеместно, и определение физического параметра биологического старения позволит людям определить наш истинный возраст, смертность и заболеваемость. [11] Изменение физического биомаркера должно быть пропорционально изменению возраста вида. Таким образом, после установления биомаркера старения люди смогут погрузиться в исследования по увеличению продолжительности жизни и поиску сроков возникновения потенциальных генетических заболеваний.
Одно из применений этого открытия позволило бы определить биологический возраст человека. Метилирование ДНК использует структуру ДНК на разных этапах жизни для определения возраста. Метилирование ДНК - это метилирование цистеина в области CG или Cpg. Гиперметилирование этой области связано со снижением транскрипционной активности и наоборот - с гипометилированием. Другими словами, чем более «крепко» удерживается участок ДНК, тем более стабильным и «моложе» вид. Глядя на свойства метилирования ДНК в тканях, было обнаружено, что для эмбриональных тканей оно практически равно нулю, его можно использовать для определения ускорения старения, а результаты можно воспроизвести в тканях шимпанзе. [19]
См. Также [ править ]
- Эпигенетические часы
- Биомаркер (лекарство)
- Старение
Ссылки [ править ]
- ^ a b c Baker GT, Sprott RL (1988). «Биомаркеры старения» . Экспериментальная геронтология . 23 (4–5): 223–39. DOI : 10.1016 / 0531-5565 (88) 90025-3 . PMID 3058488 . S2CID 31039588 .
- ^ Харрисон, доктор философии, Дэвид Э. (11 ноября 2011 г.). «V. Продолжительность жизни как биомаркер» . Лаборатория Джексона . Архивировано из оригинального 26 апреля 2012 года . Проверено 3 декабря 2011 .
- ^ Ахади, Сара; Чжоу, Вэньюй; Schüssler-Fiorenza Rose, Sophia Miryam; Сайлани, М. Реза; Контрепуа, Кевин; Авина, Моника; Эшленд, Мелани; Брюне, Энн; Снайдер, Майкл (2020). «Личные маркеры старения и возрастные типы, выявленные с помощью глубокого продольного профилирования» . Природная медицина . 26 (1): 83–90. DOI : 10.1038 / s41591-019-0719-5 . PMC 7301912 . PMID 31932806 .
- ^ Van Neste D, Тобин DJ (2004). «Цикл волос и пигментация волос: динамические взаимодействия и изменения, связанные со старением». Микрон . 35 (3): 193–200. DOI : 10.1016 / j.micron.2003.11.006 . PMID 15036274 .
- Перейти ↑ Miller RA (апрель 2001 г.). «Биомаркеры старения: прогнозирование долголетия с использованием определений подгруппы Т-клеток с учетом возраста в генетически гетерогенной популяции мышей среднего возраста» . Журналы геронтологии. Серия A, Биологические и медицинские науки . 56 (4): B180-6. DOI : 10.1093 / Герона / 56.4.b180 . PMC 7537444 . PMID 11283189 .
- Перейти ↑ Horvath S (2013). «Возраст метилирования ДНК человеческих тканей и типов клеток» . Геномная биология . 14 (10): R115. DOI : 10.1186 / GB-2013-14-10-R115 . PMC 4015143 . PMID 24138928 .
- ^ Путин Э, Мамошина П, Алипер А, Корзинкин М, Москалев А, Колосов А, Островский А, Кантор С, Видж Дж, Жаворонков А (май 2016 г.). «Глубинные биомаркеры старения человека: применение глубоких нейронных сетей для развития биомаркеров» . Старение . 8 (5): 1021–33. DOI : 10.18632 / старение.100968 . PMC 4931851 . PMID 27191382 .
- ^ Мамошин Р, Кочета К, Путин Е, Ж Кортезе, Алипер А, Ли WS, Ahn С.М., UHN л, Skjodt Н, Ковальчук О, Scheibye-Кнудсен М, Жаворонки А (октябрь 2018). «Популяционные биомаркеры старения человека: исследование больших данных с использованием популяций пациентов из Южной Кореи, Канады и Восточной Европы» . Журналы геронтологии. Серия A, Биологические и медицинские науки . 73 (11): 1482–1490. DOI : 10,1093 / герона / gly005 . PMC 6175034 . PMID 29340580 .
- ^ Петерс MJ, Joehanes R, Pilling LC, Schurmann C, Conneely KN, Powell J, et al. (Октябрь 2015 г.). «Транскрипционный ландшафт возраста периферической крови человека» . Nature Communications . 6 : 8570. Bibcode : 2015NatCo ... 6.8570. . DOI : 10.1038 / ncomms9570 . PMC 4639797 . PMID 26490707 .
- ^ Пырков Т.В., Слипенский К., Барг М., Кондрашин А., Журов Б., Зенин А., Пятницкий М., Меньшиков Л., Марков С., Федичев П.О. (март 2018). «Извлечение биологического возраста из биомедицинских данных с помощью глубокого обучения: слишком много хорошего?» . Научные отчеты . 8 (1): 5210. Bibcode : 2018NatSR ... 8.5210P . DOI : 10.1038 / s41598-018-23534-9 . PMC 5980076 . PMID 29581467 .
- ^ a b c d e Сен П., Шах П. П., Нативио Р., Бергер С. Л. (август 2016 г.). «Эпигенетические механизмы долголетия и старения» . Cell . 166 (4): 822–839. DOI : 10.1016 / j.cell.2016.07.050 . PMC 5821249 . PMID 27518561 .
- ^ a b c Pal S, Тайлер JK (июль 2016 г.). «Эпигенетика и старение» . Успехи науки . 2 (7): e1600584. Bibcode : 2016SciA .... 2E0584P . DOI : 10.1126 / sciadv.1600584 . PMC 4966880 . PMID 27482540 .
- ^ Чжан Р., Пустовойтов М.В., Е X, Сантос Х.А., Чен В., Даганзо С.М. и др. (Январь 2005 г.). «Формирование MacroH2A-содержащих гетерохроматиновых фокусов, связанных со старением, и старение, вызванное ASF1a и HIRA». Клетка развития . 8 (1): 19–30. DOI : 10.1016 / j.devcel.2004.10.019 . PMID 15621527 .
- ^ a b c McCauley BS, Dang W (декабрь 2014 г.). «Метилирование гистонов и старение: уроки, извлеченные из модельных систем» . Biochimica et Biophysica Acta (BBA) - механизмы регуляции генов . 1839 (12): 1454–62. DOI : 10.1016 / j.bbagrm.2014.05.008 . PMC 4240748 . PMID 24859460 .
- ^ a b Han Y, Han D, Yan Z, Boyd-Kirkup JD, Green CD, Khaitovich P, Han JD (декабрь 2012 г.). «Связанное со стрессом метилирование H3K4 накапливается во время постнатального развития и старения мозга макаки-резус» . Ячейка старения . 11 (6): 1055–64. DOI : 10.1111 / acel.12007 . PMID 22978322 . S2CID 17523080 .
- ^ a b Lillycrop KA, Hoile SP, Grenfell L, Burdge GC (август 2014 г.). «Метилирование ДНК, старение и влияние питания в раннем возрасте» . Труды общества питания . 73 (3): 413–21. DOI : 10.1017 / S0029665114000081 . PMID 25027290 .
- ^ Ли, Ён-хо; Ким, Со Ра; Хан, Дай Хун; Ю, Хи Тэ; Хан, Юн Дэ; Ким, Джин Хи; Ким Су Хен; Ли, Чан Джу; Мин, Бён Хун; Ким, Дон Хен; Ким, Кён Хван (2018-11-02). «Старые Т-клетки предсказывают развитие гипергликемии у людей» . Диабет . 68 (1): 156–162. DOI : 10,2337 / db17-1218 . ISSN 0012-1797 . PMID 30389747 .
- ↑ Хашимото, Косуке; Куно, Цукаса; Икава, Томокацу; Хаяцу, Норихито; Миядзима, Юрина; Ябуками, Харука; Тероатеа, Томми; Сасаки, Такаши; Сузуки, Такахиро (20 мая 2019 г.). «Одноклеточная транскриптомика показывает увеличение цитотоксических CD4 Т-клеток у пожилых людей» . Труды Национальной академии наук Соединенных Штатов Америки . 116 (48): 24242–24251. bioRxiv 10.1101 / 643528 . DOI : 10.1073 / pnas.1907883116 . PMC 6883788 . PMID 31719197 .
- ^ Хорват, Стив (2013). «Возраст метилирования ДНК человеческих тканей и типов клеток» . Геномная биология . 14 (10): R115. DOI : 10.1186 / GB-2013-14-10-R115 . ISSN 1465-6906 . PMC 4015143 . PMID 24138928 .
Внешние ссылки [ править ]
- Биомаркеры старения Новости Консультативного национального института старения