| Сциталидопепсин B | ||||||
|---|---|---|---|---|---|---|
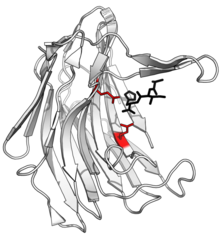 Структура сциталидокарбоксилпептидазы B с расщепленным пептидным продуктом, выделенным черным цветом, и боковыми цепями глутамат-глутаминовой диады активного центра, выделенными красным. ( PDB : 1S2K ) | ||||||
| Идентификаторы | ||||||
| Организм | ||||||
| Символ | N / A | |||||
| PDB | 1С2К | |||||
| UniProt | P15369 | |||||
| Прочие данные | ||||||
| Номер ЕС | 3.4.23.32 | |||||
| ||||||
Глутаминовые протеазы представляют собой группу протеолитических ферментов, содержащих остаток глутаминовой кислоты в активном центре. Этот тип протеазы был впервые описан в 2004 году и стал шестым каталитическим типом протеазы. [1] Ранее предполагалось, что члены этой группы протеаз представляют собой протеазу аспартата , но структурное определение показало, что она принадлежит к новому семейству протеаз. Первой структурой этой группы протеаз была сциталидоглутаминовая пептидаза , активный центр которой содержит каталитическую диаду, глутаминовую кислоту (E) и глутамин (Q), которые дали начало названию эколизин.. Эта группа протеаз обнаруживается в основном в патогенных грибах, поражающих растения и человека. [2]
Распространение и виды [ править ]
Существует два независимых семейства глутаминовых протеаз (G1 и G2), которые имеют ограниченное распространение. Первоначально считалось, что они ограничиваются мицелиальными грибами в основном из типа Ascomycota . [3] Однако впоследствии глутаминовые протеазы были идентифицированы у бактерий и архей . [4]
Первое суперсемейство глутаминовых протеаз было идентифицировано у грибов Scytalidium lignicola и Aspergillus niger var. macrosporus , из которого происходят сциталидоглутаминовая пептидаза (эколизин) и аспергиллоглутаминовая пептидаза соответственно. Эти две протеазы содержат остатки Glu и Gln в активном центре и относятся к семейству MEROPS G1. [5] [6]
Конвергентно эволюционировавшая глутаминовая пептидаза, белок придатка перед шейкой (бактериофаг phi-29), использует диаду Glu и Asp в активном центре и классифицируется как семейство MEROPS G2. [7]
Свойства [ править ]
Эти ферменты представляют собой кислотные протеазы; например, эколизин наиболее активен при pH 2,0, когда в качестве субстрата используется казеин. [2] Эколосины предпочитают объемные аминокислотные остатки в сайте P1 и небольшие аминокислотные остатки в сайте P1 '. Особенностью протеазы является ее нечувствительность к пепстатину и S-PI (ацетилпепстатин), и ранее она была классифицирована как «нечувствительные к пепстатину карбоксилпротеиназы». [8] Другие «нечувствительные к пепстатину карбоксильные протеиназы» принадлежат к подсемейству сериновых протеаз , серин-карбоксилпротеаз (седолизин), которые были открыты в 2001 году [2].Эти протеазы также не ингибируются DAN (метиловый эфир диазоацетил-DL-норлейцина) (7), но могут ингибироваться EPNP (1,2-эпокси-3- ( п- нитрофенокси) пропаном). [9] [10]
Активный сайт и механизм катализа [ править ]
Активный сайт из eqolosin содержит отличительную глутаминовую кислоту и глутамин каталитической диаду , которые участвуют в связывания субстрата и катализе. Эти остатки действуют как нуклеофилы, при этом глутаминовая кислота выступает в качестве общей кислоты на первой фазе реакции, отдавая протон карбонильному кислороду в пептидной связи субстрата. Одна или две молекулы воды могут участвовать в реакции, поставляющей гидроксильную группу, а глутаминовая кислота дополнительно отдает протон амидному азоту, что приводит к разрыву пептидной связи. Затем глутамин возвращает глутаминовую кислоту в исходное состояние. [11]
См. Также [ править ]
- Аспарагиновая протеаза
Ссылки [ править ]
- ^ Fujinaga M, Черное MM, Оям H, Ода К, Джеймс М. (март 2004). «Молекулярная структура и каталитический механизм новой карбоксилпептидазы из Scytalidium lignicolum» . Труды Национальной академии наук Соединенных Штатов Америки . 101 (10): 3364–9. DOI : 10.1073 / pnas.0400246101 . PMC 373467 . PMID 14993599 .
- ^ a b c Oda K (январь 2012 г.). «Новые семейства карбоксилпептидаз: серин-карбоксилпептидазы и глутаминовые пептидазы» . Журнал биохимии . 151 (1): 13–25. DOI : 10.1093 / Jb / mvr129 . PMID 22016395 .
- ^ Sims AH, Dunn-Coleman NS, Robson GD, Оливер SG (октябрь 2004). «Распространение глутаминовой протеазы ограничено мицелиальными грибами» . Письма о микробиологии FEMS . 239 (1): 95–101. DOI : 10.1016 / j.femsle.2004.08.023 . PMID 15451106 .
- ^ Jensen K, Østergaard PR, Увядание R, Лассен SF (2010). «Идентификация и характеристика бактериальной глутаминовой пептидазы» . BMC Biochemistry . 11 (47): 47. DOI : 10,1186 / 1471-2091-11-47 . PMC 3009609 . PMID 21122090 .
- ^ Сасаки Н, Kubota К, Ли туалет, Оцука Дж, Кодзима М, Ивата S, Накагава А, Такахаши К, М Tanokura (июль 2012). «Кристаллическая структура промежуточного димера аспергиллоглутаминовой пептидазы, которая имитирует комплекс продукта активации фермента, образующийся при автопротеолизе». Журнал биохимии . 152 (1): 45–52. DOI : 10.1093 / Jb / mvs050 . PMID 22569035 .
- Перейти ↑ Takahashi K (2013). «Исследования структуры и функций ферментов с каталитической карбоксильной группой (ами): от рибонуклеазы Т1 до карбоксилпептидаз» . Труды Японской академии, серии B . 89 (6): 201–25. DOI : 10,2183 / pjab.89.201 . PMC 3749792 . PMID 23759941 .
- ^ "Семья G2" . МЕРОПЫ .
- ^ "Семья G1" . МЕРОПЫ .
- ^ Murao S, ОДА К, Мацусита Y (1973). «Выделение и идентификация микроорганизма, который продуцирует ингибитор пепсина, не являющийся Streptomyces, и кислотные протеазы, чувствительные к N-диазоацетил-DL-норлейцинметилэфиру» . Agric. Биол. Chem . 37 (6): 1417–1421. DOI : 10.1271 / bbb1961.37.1417 .
- ^ Morihara K, Тсузуки H, Murao S, Ода K (март 1979). «Нечувствительные к пепстатину кислотные протеазы из Scytalidium lignicolum. Кинетическое исследование с синтетическими пептидами» . Журнал биохимии . 85 (3): 661–8. PMID 34596 .
- ^ Moselio Шехтер, изд. (2009). Энциклопедия микробиологии (3-е изд.). Академическая пресса. п. 499. ISBN 978-0123739391.
