| Ячейка Купфера | |
|---|---|
 Изображение конфокальной микроскопии, показывающее стационарное расположение и взаимодействия между клетками Купфера (красный), звездчатыми клетками печени (зеленый) и синусоидальными эндотелиальными клетками печени (синий). Ядра клеток выделены серым цветом. [1] | |
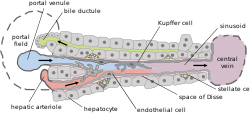 Основное строение печени | |
| Подробности | |
| Место расположения | Печень |
| Функция | Макрофаги |
| Идентификаторы | |
| латинский | звездчатый макрофагоцит |
| MeSH | D007728 |
| TH | H3.04.05.0.00016 |
| FMA | 14656 |
| Анатомические термины микроанатомии | |
Клетки Купфера , также известные как звездчатые макрофаги и клетки Купфера-Бровича , представляют собой специализированные клетки, локализованные в печени в просвете синусоидов печени и прикрепляющиеся к своим эндотелиальным клеткам, которые составляют стенки кровеносных сосудов. Клетки Купфера содержат наибольшее количество тканевых макрофагов в организме. Кишечные бактерии, бактериальные эндотоксины и микробные остатки переносятся в печень из желудочно-кишечного тракта через воротную венусначала вступит в контакт с клетками Купфера, первыми иммунными клетками печени. Именно из-за этого любое изменение функций клеток Купфера может быть связано с различными заболеваниями печени, такими как алкогольная болезнь печени, вирусный гепатит, внутрипеченочный холестаз, стеатогепатит, активация или отторжение печени во время трансплантации печени и фиброз печени. [2] [3] Они составляют часть мононуклеарной системы фагоцитов .
Структура [ править ]
Клетки Купфера амебовидной формы прикреплены к синусоидальным эндотелиальным клеткам. Поверхность клеток Купфера содержит микроворсинки, псевдоподии и ламеллиподии, которые выступают во всех направлениях. Микроворсинки и псевдоподии играют роль в эндоцитозе частиц. В их цитоплазме можно найти рибосомы, аппарат Гольджи, центриоли, микротрубочки и микрофиламенты. Ядро имеет выемку, яйцевидную форму и может быть дольчатым. Они также содержат грубую эндоплазматическую сеть, ядерную оболочку и кольцевидные ламеллы, которые все содержат пероксидазную активность. Как в центрилобулярной, так и в перипортальной областях печени находятся клетки Купфера, но их функции и структуры меняются в зависимости от их расположения. Перипортальные клетки Купфера, как правило, больше и обладают большей лизосомальной ферментативной и фагоцитарной активностью,тогда как центрилобулярные клетки Купфера создают больше супероксидного радикала. Рецептор скавенджера SR-AI / II находится внутри клеток Купфера. Этот рецептор участвует в распознавании и связывании домена липида А липополисахарида (ЛПС) и липотейхоевой кислоты. Липополисахарид (ЛПС) представляет собой бактериальный эндотоксин, который содержится в грамотрицательных бактериях клеточной стенки, тогда как липотейхоевая кислота присутствует в грамположительных бактериях.[4]
Развитие [ править ]
Их развитие начинается в желточном мешке, где они дифференцируются в макрофаги плода . Попадая в кровоток, они мигрируют в печень плода, где и остаются. Там они завершают свою дифференцировку в клетки Купфера. [5]
В основном существует два типа печеночных макрофагов : клетки Купфера, которые находятся в печени и происходят из клеток-предшественников красного костного мозга, полученных из желточного мешка , а также макрофаги, полученные из моноцитов, полученные из гемопоэтических стволовых клеток из костного мозга и транспортируемые через кровообращение в печени. Макрофаги, происходящие из моноцитов, представляют собой иммуногенные макрофаги, которые дифференцируются под влиянием микроокружения. Клетки Купфера самоподдерживаются. Они локально пролиферируют, обычно представляют собой восприимчивую популяцию фагоцитарных клеток. Моноцитыкоторые находятся в периферическом кровообращении и происходят из клеток-предшественников в костном мозге, считаются незрелыми предшественниками тканевых макрофагов у взрослых животных. В печень могут проникать моноциты периферической крови, затем моноциты созревают и приобретают фенотип, характерный для тканевых макрофагов. Различные факторы роста регулируют дифференцировку макрофагов. Однако роль стимуляции колонии макрофагов, по-видимому, является наиболее важной в развитии зрелых клеток Купфера. [6] [3]
Функция [ править ]
Средняя продолжительность жизни ячейки Купфера составляет около 3,8 дня. Основная функция клетки Купфера - удалять инородный мусор и частицы, которые попадают из портальной системы при прохождении через печень. Клетки Купфера могут поглощать крупные частицы посредством фагоцитоза, а более мелкие частицы - посредством пиноцитоза . [4] Клетки Купфера являются неотъемлемой частью врожденных реакций иммунной системы. Они также важны для защиты хозяина и играют роль в метаболизме многих различных соединений, включая липиды, белковые комплексы и мелкие частицы. Они также полезны для удаления апоптотических клеток из кровотока. [2] [3]Количество купферовских клеток в печени постоянно. Они регулируются апоптозом, а также фагоцитируются соседними клетками Купфера. Клетки Купфера обладают пролиферативной способностью, это позволяет им самовосстанавливаться, что полностью контрастирует с макрофагами, происходящими из моноцитов, которые не обладают пролиферативным потенциалом. Было показано, что клетки Купфера неоднородны по своим функциям, в зависимости от их расположения в организме. Например, в зоне 1 долек печени они гораздо более активны, чем их аналоги в зоне 3. Повышенная активность может быть связана с тем, что в зоне 1 гораздо больше воздействия опасных веществ, чем в зоне 3. Клетки Купфера могут производить воспалительные цитокины, TNF-альфа, кислородные радикалы и протеазы, а также выполняющие фагоцитоз.Считается, что создание этих медиаторов приводит к развитию повреждения печени.[4]
Помимо очистки от бактерий, красные кровяные тельца также разрушаются фагоцитарным действием, при котором молекула гемоглобина расщепляется. Цепи глобина используются повторно, а железосодержащая часть, гем , далее расщепляется на железо, которое используется повторно, и билирубин , который конъюгирован с глюкуроновой кислотой в гепатоцитах и секретируется с желчью .
Helmy et al. идентифицировали рецептор, присутствующий в клетках Купфера, рецептор комплемента семейства иммуноглобулинов (CRIg). Мыши без CRIg не могли очистить патогены, покрытые системой комплемента. CRIg сохраняется у мышей и людей и является важным компонентом врожденной иммунной системы. [7]
Клиническое значение [ править ]
Активация клеток Купфера ответственна за раннее повреждение печени, вызванное этанолом, которое часто встречается у хронических алкоголиков. Хронический алкоголизм и повреждение печени справляются с системой двойного удара. Второй удар характеризуется активацией Toll-подобного рецептора 4 ( TLR4 ) и CD14 , рецепторов на клетке Купфера, которые усваивают эндотоксин ( липополисахарид или ЛПС). Это активирует транскрипцию провоспалительных цитокинов ( фактор некроза опухоли альфа или TNFα) и выработку супероксидов (прооксидант). TNFα затем войдет в звездчатую клетку печени, что приведет к синтезу коллагена и фиброзу.. В конечном итоге фиброз вызывает цирроз или потерю функции печени. [8]
В ответ на сепсис клетки Купфера играют роль в патогенезе поврежденной печени. Макрофаги в печени активируют и высвобождают как IL-1, так и TNF-альфа. В свою очередь, это активирует лейкоциты и синусоидальные эндотелиальные клетки для экспрессии ICAM-1 . Это приводит к повреждению ткани эндотелия из-за протеаз, кислородных радикалов, простаноидов и других веществ из лейкоцитов. Алкогольная болезнь печени , или, как ее еще называют, ALD - это термин, который включает широкий спектр повреждений печени от стеатоза до стеатогепатита, фиброза.и цирроз печени. Фактические данные показали, что клетки Купфера играют важную роль в патогенезе как хронической, так и острой ALD. Воздействие алкоголя может привести к увеличению печеночной транслокации эндотоксина / липополисахарида, поступающего из кишечника, что является сильной поляризацией M1 клеток Купфера. Активированные клетки Купфера вырабатывают большое количество активных форм кислорода, провоспалительных цитокинов и хемокинов, что приводит к повреждению печени. Клетки Купфера - невероятно пластичные клетки, которые обладают способностью поляризовать определенные состояния активации и могут выполнять разные функции в разных микросредах. M1 (классическая активация) и M2 (альтернативная активация) - два обозначения двух крайних значений поляризации макрофагов. Поляризованный M1 Купфер продуцирует большое количество провоспалительных цитокинов, таких как TNF-альфа.С другой стороны, M2-поляризованные клетки Купфера демонстрируют большое количество противовоспалительных медиаторов, например IL-10.[9] [4]
История [ править ]
Впервые клетки были обнаружены Карлом Вильгельмом фон Купфер в 1876 году. [10] Ученый назвал их «Sternzellen» (звездчатые клетки или звездчатые клетки печени ), но ошибочно полагал, что они являются неотъемлемой частью эндотелия кровеносных сосудов печени. и что они произошли от него. В 1898 году, после нескольких лет исследований, Тадеуш Брович правильно определил их как макрофаги . [11] [12]
Ссылки [ править ]
- ^ Bonnardel J, T'Jonck W, Gaublomme D, Browaeys R, Scott CL, Martens L, et al. (Октябрь 2019 г.). «Звездчатые клетки, гепатоциты и эндотелиальные клетки отпечатывают идентичность клеток Купфера на моноцитах, колонизирующих нишу макрофагов печени» . Иммунитет . 51 (4): 638–654.e9. DOI : 10.1016 / j.immuni.2019.08.017 . PMC 6876284 . PMID 31561945 .
- ^ a b Nguyen-Lefebvre, Anh Thu; Хоружско, Анатолий (2015). «Метаболизм и функция клеток Купфера» . Журнал энзимологии и метаболизма . 1 (1). PMC 4771376 . PMID 26937490 .
- ^ a b c Диксон, Лора Дж .; Барнс, Марк; Тан, Хуэй; Pritchard, Michele T .; Надь, Лаура Э. (апрель 2013 г.). «Клетки Купфера в печени» . Комплексная физиология . 3 (2): 785–797. DOI : 10.1002 / cphy.c120026 . ISSN 2040-4603 . PMC 4748178 . PMID 23720329 .
- ^ a b c d Басит, Хаджира; Tan, Michael L .; Вебстер, Дэниел Р. (2020), «Гистология, ячейка Купфера» , StatPearls , Treasure Island (FL): StatPearls Publishing, PMID 29630278 , получено 25 августа 2020 г.
- Перейти ↑ Naito M, Hasegawa G, Takahashi K (ноябрь 1997 г.). «Развитие, дифференциация и созревание клеток Купфера». Микроскопические исследования и техника . 39 (4): 350–64. DOI : 10.1002 / (SICI) 1097-0029 (19971115) 39: 4 <350 :: AID-JEMT5> 3.0.CO; 2-L . PMID 9407545 .
- ^ "Клетки Купфера при неалкогольной жировой болезни печени: друг или враг?" . www.ijbs.com . Проверено 31 августа 2020 .
- ^ Хельми KY, Katschke KJ, Gorgani NN, Kljavin NM, Elliott JM, Diehl L, et al. (Март 2006 г.). «CRIg: рецептор комплемента макрофагов, необходимый для фагоцитоза циркулирующих патогенов». Cell . 124 (5): 915–27. DOI : 10.1016 / j.cell.2005.12.039 . PMID 16530040 . S2CID 15525209 .
- ^ Уиллер MD (2003). «Эндотоксин и активация клеток Купфера при алкогольной болезни печени» . Исследования алкоголя и здоровье: Журнал Национального института злоупотребления алкоголем и алкоголизма . 27 (4): 300–6. PMC 6668869 . PMID 15540801 .
- ^ Цзэн, Дао; Чжан, Цуй-Ли; Сяо, Мо; Ян, Руи; Се, Кэ-Цинь (2016). «Критические роли клеток Купфера в патогенезе алкогольной болезни печени: от фундаментальной науки до клинических испытаний» . Границы иммунологии . 7 : 538. DOI : 10.3389 / fimmu.2016.00538 . ISSN 1664-3224 . PMC 5126119 . PMID 27965666 .
- ^ Haubrich WS (июль 2004). «Купфер ячеек Купфера». Гастроэнтерология . 127 (1): 16. DOI : 10,1053 / j.gastro.2004.05.041 . PMID 15236167 .
- ^ Szymanska R, Шмидт-Pospuła M (1979). «[Исследования ретикулоэндотелиальных клеток печени Тадеушем Бровичем и Карлом Купфером. Исторический очерк]». Archiwum Historii Medycyny . 42 (3): 331–6. PMID 386989 .
- ^ Stachura J, K Galazka (декабрь 2003). «История и современное состояние польской гастроэнтерологической патологии». Журнал физиологии и фармакологии . 54 Дополнение 3: 183–92. PMID 15075472 .
Внешние ссылки [ править ]
- Анатомическое фото: пищеварительная система / млекопитающее / печень5 / печень4 - Сравнительная органология в Калифорнийском университете в Дэвисе - «Млекопитающее, печень (EM, низкая)»
- Изображение гистологии: 15508loa - Система обучения гистологии в Бостонском университете
- Kupffer Cell Foundation - Миссия Kupffer Cell Foundation состоит в том, чтобы стимулировать и поддерживать исследования и образование для улучшения знаний о роли клеток Купфера и синусоидального барьера в здоровой и больной печени.