Эта статья может быть слишком технической для понимания большинства читателей . ( Август 2015 г. ) ( Узнайте, как и когда удалить этот шаблон сообщения ) |
| Гематопоэтические стволовые клетки | |
|---|---|
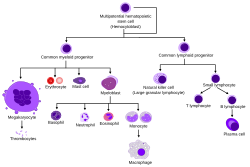 Обзор нормального гемопоэза человека | |
| Подробности | |
| Система | Кроветворная система |
| Место расположения | Костный мозг |
| Функция | Стволовые клетки , дающие начало другим клеткам крови |
| Идентификаторы | |
| латинский | Cellula haematopoietica praecursoria |
| Акроним (ы) | HSC |
| MeSH | D006412 |
| TH | H2.00.01.0.00006 |
| Анатомические термины микроанатомии | |
Гемопоэтические стволовые клетки ( HSC ) - это стволовые клетки, которые дают начало другим клеткам крови . Этот процесс называется гемопоэзом . [1] Этот процесс происходит в красном костном мозге , в сердцевине большинства костей. В эмбриональном развитии красный костный мозг происходит из слоя эмбриона, называемого мезодермой .
Гематопоэз - это процесс, при котором производятся все зрелые клетки крови. Он должен уравновешивать огромные производственные потребности (средний человек производит более 500 миллиардов клеток крови каждый день) с необходимостью регулировать количество клеток крови каждого типа в кровообращении. У позвоночных подавляющее большинство кроветворения происходит в костном мозге и происходит из ограниченного числа гемопоэтических стволовых клеток, которые являются мультипотентными и способны к обширному самообновлению.
Гемопоэтические стволовые клетки дают начало различным типам клеток крови, которые называются миелоидными и лимфоидными . И миелоидные, и лимфоидные клоны участвуют в образовании дендритных клеток. Миелоидные клетки включают моноциты , макрофаги , нейтрофилы , базофилы , эозинофилы , эритроциты и мегакариоциты для тромбоцитов . Лимфоидные клетки включают Т-клетки , В-клетки , естественные клетки-киллеры и врожденные лимфоидные клетки.. Определение гемопоэтических стволовых клеток разработано с тех пор, как HSC были впервые открыты в 1961 году. [2] Гематопоэтическая ткань содержит клетки с долгосрочными и краткосрочными способностями к регенерации и коммитированные мультипотентные , олигопотентные и унипотентные предшественники. Гемопоэтические стволовые клетки составляют 1: 10 000 клеток миелоидной ткани .
Трансплантаты HSC используются при лечении рака и других нарушений иммунной системы. [3]
Структура [ править ]
Они круглые, неприлипающие, с округлым ядром и низким соотношением цитоплазмы к ядру. По форме гемопоэтические стволовые клетки напоминают лимфоциты .
Местоположение [ править ]
Гемопоэтические стволовые клетки обнаруживаются в костном мозге взрослых, особенно в тазу , бедренной кости и грудины . Они также обнаруживаются в пуповинной крови и, в небольшом количестве, в периферической крови . [4]
Стволовые клетки и клетки-предшественники могут быть взяты из таза на гребне подвздошной кости с помощью иглы и шприца. [5] Клетки могут быть удалены в жидком виде (для мазка, чтобы посмотреть на морфологию клеток) или они могут быть удалены с помощью центральной биопсии (для поддержания архитектуры или взаимосвязи клеток друг с другом и с костью). [ необходима цитата ]
Подтипы [ править ]
Колониеобразующая единица - это подтип HSC. (Этот смысл термина отличается от колониеобразующих единиц микробов, который является единицей подсчета клеток .) Существуют различные виды колониеобразующих единиц HSC:
- Колониеобразующая единица– гранулоцит - эритроцит - моноцит - мегакариоцит ( КОЕ-GEMM )
- Колониеобразующая единица - лимфоцит ( КОЕ-Л )
- Колониеобразующая единица - эритроцит ( КОЕ-Э )
- Колониеобразующая единица - гранулоцит - макрофаг ( КОЕ-ГМ )
- Колониеобразующая единица - мегакариоцит ( КОЕ-мег )
- Колониеобразующая единица - базофил (КОЕ-В)
- Колониеобразующая единица - эозинофил ( КОЕ-Eos )
Вышеуказанные КОЕ основаны на родословной. Другая КОЕ, колониеобразующая единица - селезенка (КОЕ-С), была основой образования клональных колоний in vivo , которое зависит от способности инфузированных клеток костного мозга давать начало клонам созревающих гемопоэтических клеток в селезенках облученных мышей через 8-12 дней. Он широко использовался в ранних исследованиях, но теперь считается, что для измерения более зрелых клеток-предшественников или транзитных амплифицирующих клеток, а не стволовых клеток [ необходима ссылка ] .
Выделение стволовых клеток [ править ]
Поскольку гемопоэтические стволовые клетки нельзя выделить в чистую популяцию, их невозможно идентифицировать под микроскопом. [ необходима цитата ] Гематопоэтические стволовые клетки могут быть идентифицированы или выделены с помощью проточной цитометрии, когда комбинация нескольких различных маркеров клеточной поверхности (особенно CD34) используются для отделения редких гемопоэтических стволовых клеток от окружающих клеток крови. Гематопоэтические стволовые клетки не экспрессируют маркеры зрелых клеток крови и поэтому называются Lin-. Отсутствие экспрессии маркеров клонов используется в сочетании с обнаружением нескольких положительных маркеров клеточной поверхности для выделения гемопоэтических стволовых клеток. Кроме того, гемопоэтические стволовые клетки характеризуются своим небольшим размером и низким уровнем окрашивания жизненно важными красителями, такими как родамин 123 (родамин lo ) или Hoechst 33342 (побочная популяция).
Функция [ править ]
Гематопоэз [ править ]
Гематопоэтические стволовые клетки необходимы для гемопоэза, образования клеток в крови. Гемопоэтические стволовые клетки могут восполнять все типы клеток крови (т. Е. Мультипотентны ) и самообновляться. Небольшое количество гемопоэтических стволовых клеток может увеличиваться с образованием очень большого количества дочерних гемопоэтических стволовых клеток. Это явление используется в трансплантации костного мозга , [6] , когда небольшое количество кроветворных стволовых клеток восстановить кроветворную систему. Этот процесс указывает на то, что после трансплантации костного мозга должно произойти симметричное деление клеток на две дочерние гемопоэтические стволовые клетки.
Считается, что самообновление стволовых клеток происходит в нише стволовых клеток в костном мозге, и разумно предположить, что ключевые сигналы, присутствующие в этой нише, будут важны для самообновления. [1] Большой интерес вызывают экологические и молекулярные требования для самообновления HSC, поскольку понимание способности HSC к самовосстановлению в конечном итоге позволит генерировать расширенные популяции HSC in vitro, которые можно использовать в терапевтических целях.
Quiescence [ править ]
Гемопоэтические стволовые клетки, как и все взрослые стволовые клетки , в основном существуют в состоянии покоя или обратимой остановки роста. Измененный метаболизм покоящихся HCS помогает клеткам выживать в течение продолжительных периодов времени в гипоксической среде костного мозга. [7] Спровоцированные гибелью или повреждением клеток, гемопоэтические стволовые клетки выходят из состояния покоя и снова начинают активно делиться. Переход от состояния покоя к распространению и обратно регулируется MEK / ERK пути и PI3K / AKT / MTOR затрагивающего пути . [8] Нарушение регуляции этих переходов может привести к истощению стволовых клеток или постепенной потере активных гемопоэтических стволовых клеток в системе крови. [8]
Мобильность [ править ]
Гемопоэтические стволовые клетки обладают более высоким потенциалом, чем другие незрелые клетки крови, проходить через барьер костного мозга и, таким образом, могут перемещаться с кровью из костного мозга в одной кости в другую кость. Если они оседают в тимусе , они могут развиться в Т-клетки . В случае плода и другого экстрамедуллярного кроветворения гемопоэтические стволовые клетки также могут оседать и развиваться в печени или селезенке .
Это позволяет собирать гемопоэтические стволовые клетки непосредственно из крови.
Повреждение ДНК при старении [ править ]
Разрывы цепи ДНК накапливаются в долгосрочных гемопоэтических стволовых клетках во время старения. [9] Это накопление связано с широким ослаблением репарации ДНК и путей ответа, которые зависят от покоя HSC. [9] Негомологичное соединение концов (NHEJ) - это путь, который восстанавливает двухцепочечные разрывы в ДНК. NHEJ называют «негомологичным», потому что концы разрыва непосредственно лигируются без необходимости в гомологичной матрице. Путь NHEJ зависит от нескольких белков, включая лигазу 4 , ДНК-полимеразу mu и фактор 1 NHEJ (NHEJ1, также известный как Cernunnos или XLF).
ДНК-лигаза 4 (Lig4) играет высокоспецифичную роль в репарации двухцепочечных разрывов с помощью NHEJ. Дефицит Lig4 у мышей вызывает прогрессирующую потерю гемопоэтических стволовых клеток во время старения. [10] Дефицит lig4 в плюрипотентных стволовых клетках приводит к накоплению двухцепочечных разрывов ДНК и усилению апоптоза. [11]
У мышей, мутантных по полимеразе mu, развитие гемопоэтических клеток является дефектным в нескольких популяциях периферических клеток и клеток костного мозга, при этом количество клеток костного мозга уменьшается примерно на 40%, что включает несколько гематопоэтических клонов. [12] Также снижается потенциал роста кроветворных клеток-предшественников. Эти характеристики коррелируют со сниженной способностью восстанавливать двухцепочечные разрывы в кроветворной ткани.
Дефицит фактора 1 NHEJ у мышей приводит к преждевременному старению гемопоэтических стволовых клеток, на что указывают несколько линий доказательств, включая доказательства того, что длительная репопуляция является дефектной и со временем ухудшается. [13] Используя индуцированную человеком модель дефицита NHEJ1 с плюрипотентными стволовыми клетками, было показано, что NHEJ1 играет важную роль в обеспечении выживания примитивных гематопоэтических клеток-предшественников. [14] Эти клетки с дефицитом NHEJ1 обладают слабой способностью к репарации, опосредованной NHEJ1, которая, по-видимому, неспособна справиться с повреждениями ДНК, вызванными физиологическим стрессом, нормальным метаболизмом и ионизирующим излучением. [14]
Чувствительность гемопоэтических стволовых клеток к дефициту Lig4, ДНК-полимеразы mu и NHEJ1 предполагает, что NHEJ является ключевым фактором, определяющим способность стволовых клеток противостоять физиологическому стрессу с течением времени. [10] Росси и др. [15] обнаружили, что эндогенные повреждения ДНК накапливаются с возрастом даже в гемопоэтических стволовых клетках дикого типа, и предположили, что накопление повреждений ДНК может быть важным физиологическим механизмом старения стволовых клеток.
Клиническое значение [ править ]
Пересадка [ править ]
Трансплантация гемопоэтических стволовых клеток (ТГСК) - это трансплантация мультипотентных гемопоэтических стволовых клеток , обычно полученных из костного мозга, периферической крови или пуповинной крови. [16] [17] [18] Он может быть аутологичным (используются собственные стволовые клетки пациента), аллогенным (стволовые клетки поступают от донора) или сингенным (от однояйцевого близнеца). [16] [17]
Это наиболее часто выполняется для пациентов с определенными рака в крови или костного мозга , таких как множественная миелома или лейкоз . [17] В этих случаях иммунная система реципиента обычно разрушается радиацией или химиотерапией перед трансплантацией. Инфекция и реакция «трансплантат против хозяина» являются основными осложнениями аллогенной ТГСК. [17]
Чтобы получить стволовые клетки из циркулирующей периферической крови, донорам крови вводят цитокин , такой как фактор, стимулирующий колонии гранулоцитов (G-CSF), который побуждает клетки покидать костный мозг и циркулировать в кровеносных сосудах. [19] В эмбриологии млекопитающих первые дефинитивные гемопоэтические стволовые клетки обнаруживаются в AGM ( аорта-гонад-мезонефрос ), а затем массово размножаются в печени плода до колонизации костного мозга до рождения. [20]
Трансплантация гемопоэтических стволовых клеток остается опасной процедурой со многими возможными осложнениями; он предназначен для пациентов с опасными для жизни заболеваниями. Поскольку выживаемость после процедуры увеличилась, ее использование расширилось за пределы рака до аутоиммунных заболеваний [21] [22] и наследственных дисплазий скелета ; особенно злокачественный детский остеопетроз [23] [24] и мукополисахаридоз . [25]
Исследование [ править ]
Поведение в культуре [ править ]
Анализ клеток, образующих площадь из булыжника (CAFC) , представляет собой эмпирический анализ на основе культуры клеток. При посеве на конфлюэнтную культуру стромального питающего слоя часть гемопоэтических стволовых клеток ползет между промежутками (даже если стромальные клетки соприкасаются друг с другом) и в конечном итоге оседает между стромальными клетками и субстратом (здесь поверхность чашки) или застревает в ловушке. в клеточных отростках между стромальными клетками. Эмпериполез - это явление in vivo, при котором одна клетка полностью поглощается другой (например, тимоциты в питательные клетки тимуса ); с другой стороны, когда in vitro клетки лимфоидной линии скрываются подмедсестры , процесс называется псевдоэмпериполезом . Это похожее явление более широко известно в области HSC по терминологии клеточных культур: клетки, образующие площадь из булыжника (CAFC) , что означает, что области или кластеры клеток выглядят тусклыми, как булыжник, при фазово-контрастной микроскопии по сравнению с другими гемопоэтическими стволовыми клетками. , преломляющие. Это происходит потому, что клетки, которые свободно плавают поверх стромальных клеток, имеют сферическую форму и, следовательно, преломляют. Однако клетки, которые проникают под стромальные клетки, уплощены и, следовательно, не преломлены. Механизм псевдоэмпериполеза стал известен совсем недавно. Это может быть опосредовано взаимодействием через CXCR4(CD184) рецептор хемокинов CXC (например, SDF1 ) и интегринов α4β1 . [26]
Кинетика репопуляции [ править ]
Гематопоэтические стволовые клетки (HSC) нелегко наблюдать напрямую, и поэтому об их поведении необходимо делать косвенный вывод. Клональные исследования, вероятно, являются наиболее близким методом к изучению одноклеточных in vivo HSC. Здесь используются сложные экспериментальные и статистические методы, чтобы убедиться, что с высокой вероятностью один HSC содержится в трансплантате, введенном смертельно облученному хозяину. Затем можно наблюдать клональную экспансию этой стволовой клетки с течением времени, отслеживая процент клеток донорского типа в крови по мере восстановления хозяина. Результирующий временной ряд определяется как кинетика репопуляции HSC.
Кинетика восстановления очень неоднородна. Однако, используя символическую динамику , можно показать, что они попадают в ограниченное число классов. [27] Чтобы доказать это, несколько сотен экспериментальных кинетик репопуляции из клонального Thy-1 lo SCA-1 + lin - c-kit + HSC были переведены в символические последовательности путем присвоения символов «+», «-», «~» всякий раз, когда два последовательных измерения процента клеток донорского типа имеют положительный, отрицательный или неизменный наклон соответственно. Используя расстояние Хэмминга , образцы репопуляции были подвергнуты кластерному анализу, в результате которого было получено 16 различных групп кинетики. Чтобы завершить эмпирическое доказательство,Подход Лапласа с добавлением единицы [ требуется пояснение ] был использован для определения того, что вероятность обнаружения кинетики, не содержащейся в этих 16 группах, очень мала. Как следствие, этот результат показывает, что компартмент гематопоэтических стволовых клеток также неоднороден по динамическим критериям.
Первоначально считалось, что все гемопоэтические стволовые клетки одинаковы по своей способности к самообновлению и дифференцировке. Впервые эта точка зрения была оспорена открытием 2002 года группой Мюллера-Зибурга из Сан-Диего, которая продемонстрировала, что разные стволовые клетки могут демонстрировать различные паттерны репопуляции, которые являются эпигенетически предопределенными внутренними свойствами клонального Thy-1 lo Sca-1 + lin - c- комплект + HSC. [28] [29] [30] Результаты этих клональных исследований привели к понятию систематической ошибки происхождения . Используя соотношениеИз лимфоидных (L) в миелоидные (M) клеток в крови в качестве количественного маркера компартмент стволовых клеток можно разделить на три категории HSC. Сбалансированные (Bala) гемопоэтические стволовые клетки повторно заселяют периферические лейкоциты в том же соотношении миелоидных и лимфоидных клеток, что и у мышей без манипуляций (в среднем около 15% миелоидных и 85% лимфоидных клеток, или 3 ≤ ρ ≤ 10). Миелоидно-смещенные (My-bi) гемопоэтические стволовые клетки дают очень мало лимфоцитов, что приводит к соотношению 0 <ρ <3, в то время как лимфоидно-смещенные (Ly-bi) гемопоэтические стволовые клеткигенерируют очень мало миелоидных клеток, что приводит к соотношению лимфоид-миелоид р> 10. Все три типа являются нормальными типами HSC и не представляют стадии дифференцировки. Скорее, это три класса HSC, каждый с эпигенетически фиксированной программой дифференциации. Эти исследования также показали, что смещение клонов не регулируется стохастически и не зависит от различий во влиянии окружающей среды. My-bi HSC самообновляются дольше, чем сбалансированные или Ly-bi HSC. Миелоидная ошибка возникает из-за снижения чувствительности к лимфопоэтину интерлейкину 7 (IL-7). [29]
Впоследствии другие группы подтвердили и подчеркнули первоначальные результаты. [31] Например, группа Eaves подтвердила в 2007 году, что кинетика репопуляции, долговременная способность к самообновлению, а также My-bi и Ly-bi являются стабильно унаследованными внутренними свойствами HSC. [32] В 2010 году группа Goodell предоставила дополнительную информацию о молекулярной основе смещения клонов в боковой популяции (SP) SCA-1 + lin - c-kit + HSC. [33] Как ранее было показано для передачи сигналов IL-7, было обнаружено, что член семейства трансформирующих факторов роста (TGF-beta) индуцирует и ингибирует пролиферацию My-bi и Ly-bi HSC соответственно.
Этимология [ править ]
От греческого haimato- , соединяющего форму haima "кровь", и от латинизированной формы греческого poietikos "способный творить, созидать , производить", от poiein "творить, творить". [34]
См. Также [ править ]
- Ниша гемопоэтических стволовых клеток
Ссылки [ править ]
- ^ a b Birbrair A, Frenette PS (апрель 2016 г.). «Неоднородность ниши в костном мозге» . Летопись Нью-Йоркской академии наук . 1370 (1): 82–96. Bibcode : 2016NYASA1370 ... 82B . DOI : 10.1111 / nyas.13016 . PMC 4938003 . PMID 27015419 .
- ↑ Till JE, McCulloch EA (февраль 1961 г.). «Прямое измерение радиационной чувствительности нормальных клеток костного мозга мыши» . Радиационные исследования . 14 (2): 213–22. Bibcode : 1961RadR ... 14..213T . DOI : 10.2307 / 3570892 . hdl : 1807/2781 . JSTOR 3570892 . PMID 13776896 .
- ^ «5. Гематопоэтические стволовые клетки». Информация о стволовых клетках. Национальные институты здравоохранения, Министерство здравоохранения и социальных служб США, 17 июня 2011 г. http://stemcells.nih.gov/info/scireport/pages/chapter5.aspx Архивировано 29 сентября 2015 г. на Wayback Machine
- ^ «Пуповинная кровь 2.0: Банк стволовых клеток пуповины - Америкорд» . cordadvantage.com . Архивировано из оригинала на 2014-06-23.
- ^ «Процесс трансплантации костного мозга» . Клиника Мэйо . Проверено 18 марта 2015 года .
- ^ Mahla RS (2016 г.). «Применение стволовых клеток в регенеративной медицине и терапии болезней» . Международный журнал клеточной биологии . 2016 (7): 6940283. DOI : 10,1155 / 2016/6940283 . PMC 4969512 . PMID 27516776 .
- ^ Srikanth л, Sunitha М.М., Venkatesh К, Кумар П.С., Чандрасекхар С, Vengamma В, Сарма П. В. (2015). «Анаэробный гликолиз и экспрессия HIF1α в гемопоэтических стволовых клетках объясняет его природу покоя». Журнал стволовых клеток . 10 (2): 97–106. PMID 27125138 .
- ^ a b Баумгартнер С, Тойфл С, Фарлик М, Хальбриттер Ф, Шайхер Р, Фишер I, Сексл V, Бок С, Баккарини М (июнь 2018 г.). «Зависящий от ERK механизм обратной связи предотвращает истощение гемопоэтических стволовых клеток» . Стволовая клетка . 22 (6): 879–892.e6. DOI : 10.1016 / j.stem.2018.05.003 . PMC 5988582 . PMID 29804890 .
- ^ a b Берман I, Сейта Дж, Инлей М.А., Вайсман Иллинойс, Росси DJ (июль 2014). «Покоящиеся гемопоэтические стволовые клетки накапливают повреждения ДНК во время старения, которые восстанавливаются при входе в клеточный цикл» . Стволовая клетка . 15 (1): 37–50. DOI : 10.1016 / j.stem.2014.04.016 . PMC 4082747 . PMID 24813857 .
- ^ a b Nijnik A, Woodbine L, Marchetti C, Dawson S, Lambe T., Liu C, Rodrigues NP, Crockford TL, Cabuy E, Vindigni A, Enver T, Bell JI, Slijepcevic P, Goodnow CC, Jeggo PA, Cornall RJ (Июнь 2007 г.). «Восстановление ДНК ограничивает гемопоэтические стволовые клетки во время старения». Природа . 447 (7145): 686–90. Bibcode : 2007Natur.447..686N . DOI : 10,1038 / природа05875 . PMID 17554302 . S2CID 4332976 .
- ^ Тилгнер К, Неганова я, Морено-Джимено я, Аль-AAMA JY, Беркс D, Yung S, Singhapol С, Saretzki G, Эванс Дж, Горбунова В, Gennery А, Przyborski S, Стойкович М, Армстронг л, Jeggo Р, Лако М (август 2013). «Модель дефицита лигазы IV с помощью ИПСК человека показывает важную роль NHEJ-опосредованной репарации DSB в выживании и стабильности генома индуцированных плюрипотентных стволовых клеток и возникающих гематопоэтических предшественников» . Гибель клеток и дифференциация . 20 (8): 1089–100. DOI : 10.1038 / cdd.2013.44 . PMC 3705601 . PMID 23722522 .
- ^ Лукас Д., Эскудеро Б., Лигос Дж. М., Сеговия Дж. К., Эстрада Дж. С., Террадос Г., Бланко Л., Сампер Е., Бернад А. (февраль 2009 г.). «Измененный гематопоэз у мышей, лишенных ДНК-полимеразы mu, происходит из-за неэффективной репарации двухцепочечных разрывов» . PLOS Genetics . 5 (2): e1000389. DOI : 10.1371 / journal.pgen.1000389 . PMC 2638008 . PMID 19229323 .
- ↑ Avagyan S, Churchill M, Yamamoto K, Crowe JL, Li C, Lee BJ, Zheng T, Mukherjee S, Zha S (сентябрь 2014 г.). «Дисфункция гемопоэтических стволовых клеток лежит в основе прогрессирующей лимфоцитопении при дефиците XLF / Cernunnos» . Кровь . 124 (10): 1622–5. DOI : 10,1182 / кровь 2014-05-574863 . PMC 4155271 . PMID 25075129 .
- ^ a b Тилгнер К., Неганова И., Сингхапол С., Сарецки Г., Аль-Аама Дж. Ю., Эванс Дж., Горбунова В., Геннери А., Пржиборски С., Стойкович М., Армстронг Л., Джегго П., Лако М. (сентябрь 2013 г.). «Краткий отчет: индуцированная человеком модель дефицита цернунно с плюрипотентными стволовыми клетками показывает важную роль XLF в выживании примитивных гематопоэтических предшественников». Стволовые клетки . 31 (9): 2015–23. DOI : 10.1002 / stem.1456 . PMID 23818183 . S2CID 3623309 .
- ^ Росси ди - джей, Bryder D, Сейта J, Nussenzweig A, Hoeijmakers J, Вайсман IL (июнь 2007). «Дефицит репарации повреждений ДНК ограничивает функцию гемопоэтических стволовых клеток с возрастом». Природа . 447 (7145): 725–9. Bibcode : 2007Natur.447..725R . DOI : 10,1038 / природа05862 . PMID 17554309 . S2CID 4416445 .
- ^ a b Felfly, H; Хаддад, GG (2014). «Гематопоэтические стволовые клетки: новые возможности для трансляционной медицины». Журнал стволовых клеток . 9 (3): 163–97. PMID 25157450 .
- ^ a b c d Парк, B; Yoo, KH; Ким, К. (декабрь 2015 г.). «Экспансия и генерация гемопоэтических стволовых клеток: пути к прорыву» . Исследование крови . 50 (4): 194–203. DOI : 10,5045 / br.2015.50.4.194 . PMC 4705045 . PMID 26770947 .
- ^ Mahla RS (2016 г.). «Применение стволовых клеток в регенеративной медицине и трепевтике болезней» . Международный журнал клеточной биологии . 2016 (7): 1–24. DOI : 10.1155 / 2016/6940283 . PMC 4969512 . PMID 27516776 . CS1 maint: использует параметр авторов ( ссылка )
- ^ «5. Гематопоэтические стволовые клетки - stemcells.nih.gov» . stemcells.nih.gov .
- ^ Dzierzak E, Спек NA (февраль 2008). «Происхождение и наследие: развитие гемопоэтических стволовых клеток млекопитающих» . Иммунология природы . 9 (2): 129–36. DOI : 10.1038 / ni1560 . PMC 2696344 . PMID 18204427 .
- ^ Тиндаля А, Fassas А, Passweg Дж, и др. (1999). «Аутологичные трансплантаты гемопоэтических стволовых клеток для лечения аутоиммунных заболеваний - возможность и смертность, связанная с трансплантацией. Рабочие группы по аутоиммунным заболеваниям и лимфомам Европейской группы по трансплантации крови и костного мозга, Европейская лига против ревматизма и Международный проект стволовых клеток для аутоиммунных заболеваний» . Пересадка костного мозга . 24 (7): 729–34. DOI : 10.1038 / sj.bmt.1701987 . PMID 10516675 .
- ^ Берт RK, Loh Y, Pearce W, et al. (2008). «Клиническое применение стволовых клеток крови и костного мозга при незлокачественных заболеваниях» . JAMA . 299 (8): 925–36. DOI : 10,1001 / jama.299.8.925 . PMID 18314435 .
- ^ EL-Sobky Т.А., Эль-Хаддад A, E Elsobky, Эльсайед С.М., Сакр HM (март 2017). «Лечение рентгенологической патологии скелета в случае злокачественного детского остеопетроза после трансплантации гемопоэтических стволовых клеток» . Египетский журнал радиологии и ядерной медицины . 48 (1): 237–43. DOI : 10.1016 / j.ejrnm.2016.12.013 .
- ^ Хашеми Taheri А.П., Radmard А.Р., Kooraki S, Behfar М, Н Пак, Hamidieh А.А., Ghavamzadeh А (сентябрь 2015). «Радиологическое разрешение скелетных изменений злокачественного детского остеопетроза после трансплантации гемопоэтических стволовых клеток». Детская кровь и рак . 62 (9): 1645–49. DOI : 10.1002 / pbc.25524 . PMID 25820806 . S2CID 11287381 .
- ^ Langereis EJ, den Os MM, Breen C, Jones SA, Knaven OC, Mercer J, Miller WP, Kelly PM, Kennedy J, Ketterl TG, O'Meara A, Orchard PJ, Lund TC, van Rijn RR, Sakkers RJ, Белый К.К., Вейбург ФА (март 2016 г.). «Прогрессирование дисплазии тазобедренного сустава при мукополисахаридозе типа I Hurler после успешной трансплантации гемопоэтических стволовых клеток». Журнал костной и суставной хирургии . 98 (5): 386–95. DOI : 10,2106 / JBJS.O.00601 . PMID 26935461 .
- ^ Burger JA, Spoo A, Dwenger A, Burger M, Behringer D (август 2003). «Хемокиновые рецепторы CXCR4 (CD184) и интегрины альфа4бета1 опосредуют спонтанную миграцию предшественников CD34 + человека и клеток острого миелоидного лейкоза под стромальные клетки костного мозга (псевдоэмпериполез)» . Британский журнал гематологии . 122 (4): 579–89. DOI : 10.1046 / j.1365-2141.2003.04466.x . PMID 12899713 . S2CID 8764752 .
- ^ Зибург HB, Мюллер-Зибург CE (2004). «Классификация короткой кинетики по форме». В биологии Silico . 4 (2): 209–17. PMID 15107024 .
- ↑ Müller-Sieburg CE, Cho RH, Thoman M, Adkins B, Sieburg HB (август 2002). «Детерминированная регуляция самообновления и дифференцировки гемопоэтических стволовых клеток» . Кровь . 100 (4): 1302–9. DOI : 10.1182 / blood.V100.4.1302.h81602001302_1302_1309 . PMID 12149211 .
- ^ a b Muller-Sieburg CE, Cho RH, Karlsson L, Huang JF, Sieburg HB (июнь 2004 г.). «Гемопоэтические стволовые клетки с миелоидным смещением обладают обширной способностью к самообновлению, но производят уменьшенное лимфоидное потомство с нарушенной чувствительностью к IL-7» . Кровь . 103 (11): 4111–8. DOI : 10.1182 / кровь-2003-10-3448 . PMID 14976059 .
- ^ Sieburg HB, Cho RH, Dykstra B, Uchida N, обрезные CJ, Мюллер-Sieburg CE (март 2006). «Компартмент гемопоэтических стволовых клеток состоит из ограниченного числа дискретных подмножеств стволовых клеток» . Кровь . 107 (6): 2311–6. DOI : 10.1182 / кровь-2005-07-2970 . PMC 1456063 . PMID 16291588 .
- Перейти ↑ Schroeder T (март 2010). «Гетерогенность гемопоэтических стволовых клеток: подтипы, а не непредсказуемое поведение». Стволовая клетка . 6 (3): 203–7. DOI : 10.1016 / j.stem.2010.02.006 . PMID 20207223 .
- ^ Dykstra B, D Kent, Bowie M, L Маккефри, Hamilton M, K Lyons, Lee SJ, Бринкмен R, обрезные C (август 2007). «Долгосрочное распространение различных программ гемопоэтической дифференцировки in vivo». Стволовая клетка . 1 (2): 218–29. DOI : 10.1016 / j.stem.2007.05.015 . PMID 18371352 .
- ^ Challen Г.А., Boles NC, Chambers SM, Goodell MA (март 2010). «Определенные подтипы гемопоэтических стволовых клеток по-разному регулируются TGF-beta1» . Стволовая клетка . 6 (3): 265–78. DOI : 10.1016 / j.stem.2010.02.002 . PMC 2837284 . PMID 20207229 .
- ^ Flexner S, Hauck L, ред. (1993). Несокращенный словарь Random House (2-е изд.). Нью-Йорк: Random House. п. 890. ISBN 0-679-42917-4.
Внешние ссылки [ править ]
- Информационный бюллетень о стволовых клетках крови на EuroStemCell
