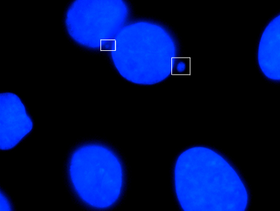
Микронуклеус - это название, данное маленькому ядру, которое образуется всякий раз, когда хромосома или фрагмент хромосомы не включаются в одно из дочерних ядер во время деления клетки. Обычно это признак генотоксических событий и хромосомной нестабильности. Микроядра обычно наблюдаются в раковых клетках и могут указывать на события повреждения генома, которые могут увеличить риск развития или дегенеративных заболеваний. [1]Микроядра образуются во время анафазы из-за отставания ацентрической хромосомы или фрагментов хроматид, вызванных неправильно или нереставрированными разрывами ДНК или нерасхождением хромосом. Эта неправильная сегрегация хромосом может быть результатом гипометилирования повторяющихся последовательностей, присутствующих в перицентромерной ДНК, нарушений в белках кинетохор или их сборки, дисфункционального аппарата веретена или дефектных генов контрольных точек анафазы. [2] Микронуклеусы могут способствовать нестабильности генома, способствуя катастрофическому мутационному событию, называемому хромотрипсисом . [3] Многие микроядерные тесты были разработаны для проверки наличия этих структур и определения их частоты в клетках, подвергшихся воздействию определенных химических веществ или стрессовых условиях.
Термин « микроядро» может также относиться к меньшему ядру у инфузорий простейших , таких как Paramecium . При делении оно делится митозом , а при конъюгации образует пару ядер гамет , в результате взаимного слияния которых образуется ядро зиготы , которое дает начало макронуклеарам и микроядрам индивидов следующего цикла деления. [4]
Открытие [ править ]
Микроядра во вновь образованных эритроцитах человека известны как тельца Хауэлла-Джолли, потому что эти структуры были впервые идентифицированы и описаны в эритроцитах гематологами Уильямом Хауэллом и Джастином Джолли. Позже было обнаружено, что эти структуры связаны с недостатком витаминов, таких как фолиевая кислота и B12. Взаимосвязь между образованием микроядер и воздействием факторов окружающей среды впервые была обнаружена в клетках кончика корня, подвергшихся воздействию ионизирующего излучения. Об индукции микроядер химическим веществом впервые сообщили в асцитных опухолевых клетках Эрлиха, обработанных колхицином. [2]
Формирование [ править ]
Микроядра в основном возникают в результате ацентрических фрагментов хромосом или отставания целых хромосом, которые не включены в дочерние ядра, образованные митозом, потому что они не могут правильно прикрепиться к веретену во время сегрегации хромосом в анафазе. Эти полные хромосомы или фрагменты хроматид в конечном итоге заключены в ядерные мембраны и структурно подобны обычным ядрам, хотя и меньше по размеру. Это небольшое ядро называется микроядром. Образование микроядер можно наблюдать только в клетках, подвергающихся ядерному делению, и его можно четко увидеть при использовании цитохалазина B для блокирования цитокинеза с образованием двуядерных клеток . [2]
Ацентрические фрагменты хромосом могут возникать по-разному. Один из способов заключается в том, что нарушение целостности двухцепочечных разрывов ДНК может приводить к симметричным или асимметричным обменам хроматид и хромосом, а также к хроматидным и хромосомным фрагментам. Если повреждение ДНК превышает репарационную способность клетки, нерепарированные двухцепочечные разрывы ДНК также могут привести к ацентрическим фрагментам хромосомы. Еще один способ возникновения эксцентрических фрагментов хромосом - это когда дефекты в генах, связанные с гомологичной рекомбинационной репарацией (например, ATM, BRCA1, BRCA2 и RAD51), приводят к дисфункциональному безошибочному пути репарации гомологичной рекомбинационной ДНК и заставляют клетку прибегать к ошибке. - путь репарации негомологичных концевых соединений (NHEJ), повышающий вероятность неправильной репарации разрывов ДНК, образования дицентрических хромосом и ацентрических фрагментов хромосом.Если ферменты в пути репарации NHEJ также являются дефектными, разрывы ДНК могут вообще не восстанавливаться. Кроме того, одновременная эксцизионная репарация поврежденных или несоответствующих оснований, включенных в ДНК, которые находятся в непосредственной близости и на противоположных комплементарных цепях ДНК, может привести к двухцепочечным разрывам ДНК и образованию микроядер, особенно если этап заполнения пробелов в пути репарации не завершен.[2]
Микроядра также могут образовываться из фрагментированных хромосом, когда нуклеоплазматические мостики (NPB) образуются, растягиваются и разрываются во время телофазы. [2]
Образование микроядер также может быть результатом неправильной сегрегации хромосом во время анафазы. Гипометилирование цитозина в центромерных и перицентромерных областях и повторы более высокого порядка сателлитной ДНК в центромерной ДНК могут приводить к таким событиям хромосомной потери. Классическая сателлитная ДНК обычно сильно метилирована по остаткам цитозина, но может стать почти полностью неметилированной из-за синдрома ICF (иммунодефицит, нестабильность центромеры и синдром лицевых аномалий) или после лечения ингибиторами ДНК-метилтрансферазы. С момента сборки кинетохораНа белки центромер влияет метилирование цитозиновых и гистоновых белков, снижение целостности гетерохроматина в результате гипометилирования может мешать прикреплению микротрубочек к хромосомам и ощущению натяжения правильных соединений микротрубочки-кинетохоры. Другими возможными причинами потери хромосом, которые могут привести к образованию микроядер, являются дефекты взаимодействия кинетохор и микротрубочек, дефекты сборки митотического веретена, дефекты контрольных точек митоза, аномальная амплификация центросом и слияния концов теломеров, которые приводят к тому, что дицентрические хромосомы отделяются от веретена во время анафаза. Микроядра, происходящие из событий потери хромосом и ацентрических фрагментов хромосом, можно различить с помощью панцентромерных ДНК-зондов. [2]
Идентификация [ править ]
Количество микроядер на клетку можно предсказать, используя следующую формулу:
AF - это количество ацентрических фрагментов и F = 0,5 - 0,5P, где P равно вероятности того, что фрагменты будут включены в традиционное ядро и не образуют микроядро. [5]
Одно исследование, в котором использовалось окрашивание по Гимзе для окрашивания ядерного материала, установило следующие критерии для идентификации микроядер:
1) диаметр менее 1/3 первичного ядра,
2) отсутствие ретракции (за исключением мелких окрашивающих частиц),
3) одинаковый цвет. такое же или легче основного ядра (за исключением крупных окрашивающих частиц),
4) расположение в пределах 3 или 4 ядерных диаметров от основного ядра, не касаясь его, и
5) не более двух, связанных с одним первичным ядром (вероятно, 3 или более микроядра полиморфы или прорубициты с ядерными фрагментами). [6]
Анализы [ править ]
Микроядерные тесты предоставляют важную информацию о способности химического вещества влиять на структуру и функцию хромосом. Например, многие известные канцерогены человека дают положительный результат в тестах на микроядра млекопитающих. В этих тестах организмы обрабатываются химическим веществом и измеряется результирующая частота появления микроядер. Если наблюдается заметное увеличение количества клеток с микроядрами, можно сделать вывод, что химическое вещество вызывает структурные и / или числовые хромосомные повреждения. Поскольку микронуклеарные тесты должны проводиться на активно делящихся клетках, стволовые клетки костного мозга и эритроциты, которые они производят при делении клеток, являются идеальными кандидатами. Эти клетки испытывают постоянный быстрый оборот, а отсутствие настоящего ядра в эритроцитах делает микроядра легко видимыми под микроскопом. [1]
Системы анализа микроядер очень экономичны, требуют гораздо меньших навыков при подсчете баллов, чем обычные метафазные тесты, и намного быстрее, чем эти обычные тесты. Поскольку микроядерные анализы надежно и быстро отражают хромосомные аберрации, они чрезвычайно полезны для быстрой оценки хромосомных повреждений. В частности, анализ CBMNcyt (цитокинез-блокирующий микроядерный цитом) чрезвычайно универсален и является одним из предпочтительных методов измерения уровня хромосомных повреждений и хромосомной нестабильности в клетках. Анализ микроядер с блокировкой цитокинеза (CBMN) был впервые разработан для оценки микроядер в клетках, завершивших деление ядра, путем их блокирования на стадии биядерных ядер перед цитокинезом. Позже он превратился в «цитомный» анализ CBMN для дальнейшего изучения гибели клеток, цитостаза и биомаркеров повреждения ДНК.Основным недостатком использования микроядерных тестов является то, что они не могут определять различные типы хромосомных аберраций и могут зависеть от скорости митоза и доли гибели клеток, искажая результаты.[2]
Образцы в формировании [ править ]
Многочисленные исследования показали, что частота микроядер у женщин выше, чем у мужчин, и что количество микроядер увеличивается примерно до 70 лет. Уровни микроядер колеблются от 0,5 до 1,4% у мужчин и от 0,9 до 1,8% у женщин. Гендерные различия в основном наблюдались в более молодых возрастных группах (<= 50 лет) с почти двукратной разницей между мужчинами и женщинами. Структура количества микроядер после 70 лет противоречива. Некоторые исследования показали, что у лиц старше 70 лет частота микроядер увеличивается у обоих полов. С другой стороны, другие исследования показали, что в самых старших возрастных группах частота микроядер выравнивается. Дефицит микроядер в некоторых из самых старших возрастных групп можно объяснить тем фактом, что микроядерные клетки преимущественно уничтожаются апоптозом. Тем не мение,более высокая частота микроядер соответствует снижению эффективности репарации ДНК и повышенной нестабильности генома, что типично для пожилых людей. Возрастное увеличение частоты микроядер также хорошо согласуется с возрастным увеличением гипоплоидии и возрастным увеличением потери половых хромосом. В качестве альтернативы, выравнивание частоты микроядер у пожилых людей могло бы предложить порог геномной нестабильности, который нельзя преодолеть, если человек хочет выжить. Если бы это было так, женщины, кажется, достигают этого порога быстрее, чем мужчины.Возрастное увеличение частоты микроядер также хорошо согласуется с возрастным увеличением гипоплоидии и возрастным увеличением потери половых хромосом. В качестве альтернативы, выравнивание частоты микроядер у пожилых людей могло бы предложить порог геномной нестабильности, который нельзя преодолеть, если человек хочет выжить. Если бы это было так, женщины, кажется, достигают этого порога быстрее, чем мужчины.Возрастное увеличение частоты микроядер также хорошо согласуется с возрастным увеличением гипоплоидии и возрастным увеличением потери половых хромосом. В качестве альтернативы, выравнивание частоты микроядер у пожилых людей могло бы предложить порог геномной нестабильности, который нельзя преодолеть, если человек хочет выжить. Если бы это было так, женщины, кажется, достигают этого порога быстрее, чем мужчины.[7]
Половые хромосомы вносят вклад в большинство случаев потери хромосом с возрастом. У женщин Х-хромосома может составлять до 72% наблюдаемых микроядер, из которых 37%, по-видимому, лишены функциональной сборки кинетохор, возможно, из-за инактивации Х-хромосомы. Многочисленные исследования показали, что частота аутосомно-положительных микроядер у обоих полов и положительных по половым хромосомам МЯ у мужчин была схожей и оставалась неизменной в более старших группах, в то время как частота Х-положительных МЯ у женщин была выше, чем средняя частота аутосомных МН. -положительный МН и продолжал увеличиваться до самого старшего возраста. [2]
Частота хромосомных аберраций, поврежденных клеток и микроядер значительно выше у курильщиков, чем у некурящих. [8]
У нормальных людей и многих других млекопитающих, у которых нет ядер в эритроцитах, микроядра быстро удаляются селезенкой . Следовательно, высокая частота микроядер в периферической крови человека указывает на разрыв или отсутствие селезенки. У мышей они не удаляются, что является основой для микроядерного теста in vivo .
См. Также [ править ]
- Макронуклеус
- Раковые микроядра
- Микрохромосома
Ссылки [ править ]
- ^ а б «Микронуклеус» . ntp.niehs.nih.gov . Архивировано из оригинала на 2016-10-18 . Проверено 14 октября 2016 .
- ^ a b c d e f g h Фенек, М .; Kirsch-Volders, M .; Натараджан, AT; Surralles, J .; Crott, JW; Parry, J .; Norppa, H .; Истмонд, Округ Колумбия; Такер, Джей Ди (01.01.2011). «Молекулярные механизмы образования микроядер, нуклеоплазматических мостиков и ядерных зачатков в клетках млекопитающих и человека» . Мутагенез . 26 (1): 125–132. DOI : 10,1093 / mutage / geq052 . ISSN 0267-8357 . PMID 21164193 .
- ^ Umbreit, Neil T .; Чжан, Чэн-Чжун; Линч, Люк Д .; Блейн, Логан Дж .; Ченг, Анна М .; Турдо, Ричард; Солнце, Лили; Альмубарак, Ханна Ф .; Судья Ким; Митчелл, Томас Дж .; Спектор, Александр (2020-04-17). «Механизмы, создающие сложность генома рака из-за ошибки деления одной клетки» . Наука . 368 (6488). DOI : 10.1126 / science.aba0712 . ISSN 0036-8075 . PMID 32299917 .
- ^
 Одно или несколько предыдущих предложений включают текст из публикации, которая сейчас находится в общественном достоянии : Chisholm, Hugh, ed. (1911). « Микронуклеус ». Британская энциклопедия . 18 (11-е изд.). Издательство Кембриджского университета. п. 391.
Одно или несколько предыдущих предложений включают текст из публикации, которая сейчас находится в общественном достоянии : Chisholm, Hugh, ed. (1911). « Микронуклеус ». Британская энциклопедия . 18 (11-е изд.). Издательство Кембриджского университета. п. 391. - ^ Сэвидж, Джон РК (1988-01-01). «Комментарий о количественной взаимосвязи между микроядрами и хромосомными аберрациями». Письма об исследованиях мутаций . 207 (1): 33–36. DOI : 10.1016 / 0165-7992 (88) 90008-5 . PMID 3336377 .
- ^ Земляк, Павел I .; Хеддл, Джон А. (1976-12-01). «Производство микроядер из хромосомных аберраций в облученных культурах лимфоцитов человека». Мутационные исследования / Фундаментальные и молекулярные механизмы мутагенеза . 41 (2–3): 321–331. DOI : 10.1016 / 0027-5107 (76) 90105-6 .
- ^ Войда, Алина; Зенткевич, Ева; Витт, Михал (01.05.2007). «Влияние возраста и пола на частоту нерасхождения микроядер и хромосом у долгожителей и более молодых людей» . Мутагенез . 22 (3): 195–200. DOI : 10.1093 / mutage / gem002 . ISSN 0267-8357 . PMID 17284771 .
- ^ Бандана Гангули, Bani (1993-08-01). «Деление клеток, хромосомные повреждения и образование микроядер в периферических лимфоцитах здоровых доноров: в зависимости от возраста донора». Исследование мутаций / ДНК-анализ . 295 (3): 135–148. DOI : 10.1016 / 0921-8734 (93) 90015-U . PMID 7689700 .