| Мотилин / грелин | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Структура мотилина в бицеллярном растворе изотропного фосфолипида. [1] | |||||||||
| Идентификаторы | |||||||||
| Символ | Мотилин_грелин | ||||||||
| Pfam | PF04644 | ||||||||
| ИнтерПро | IPR006738 | ||||||||
| SCOP2 | 1lbj / SCOPe / SUPFAM | ||||||||
| OPM суперсемейство | 145 | ||||||||
| Белок OPM | 1 фунт / дж | ||||||||
| |||||||||
| Мотилин | |||||||
|---|---|---|---|---|---|---|---|
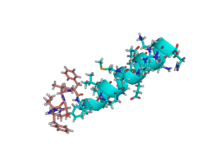 Структура раствора мотилина в бицеллярном растворе фосфолипидов методом ЯМР. [1] | |||||||
| Идентификаторы | |||||||
| Символ | МЛН | ||||||
| Ген NCBI | 4295 | ||||||
| HGNC | 7141 | ||||||
| OMIM | 158270 | ||||||
| PDB | 1 фунт / дж | ||||||
| RefSeq | NM_001040109 | ||||||
| UniProt | P12872 | ||||||
| Прочие данные | |||||||
| Locus | Chr. 6 п.21.3-п21.2 | ||||||
| |||||||
Мотилин представляет собой 22-аминокислотный полипептид гормона в семье мотилина , что у людей, кодируется MLN гена . [2]
Мотилин секретируется эндокринными Mo клеток [3] [4] (или M - клетка, они не являются таким же , как клетки микроскладки (М - клетка) , которые находятся в пейеровых бляшки ) , которые являются многочисленными в криптах в тонком кишечнике , особенно в двенадцатиперстная кишка и тощая кишка . [5] Он попадает в общий кровоток у людей примерно с 100-минутными интервалами во время межпищеварительного состояния и является наиболее важным фактором в контроле межпищеварительных мигрирующих сокращений; а также стимулирует эндогенное высвобождение эндокринной поджелудочной железы. [6]По аминокислотной последовательности мотилин не связан с другими гормонами. Из-за его способности стимулировать деятельность желудка он получил название «мотилин». Помимо у людей, то рецептор мотилина был идентифицирован в желудочно - кишечном тракте от свинех , крыс , коров и кошек , а также в центральной нервной системе кроликов .
Открытие [ править ]
Мотилин был открыт Дж. К. Брауном, когда он вводил щелочной раствор в двенадцатиперстную кишку собак, вызывающий сильные сокращения желудка. Brown et al. предсказал, что щелочь может либо вызвать стимул, чтобы активировать двигательную активность, либо предотвратить секрецию ингибирующего гормона. Они выделили полипептид как побочный продукт очистки секретина на карбоксиметилцеллюлозе. Они назвали этот полипептид «Мотилин». [7]
Структура [ править ]
Мотилин имеет 22 аминокислоты и молекулярную массу 2698 дальтон. В экстракте из кишечника человека и плазмы есть две основные формы мотилина. Первая молекулярная форма - это полипептид из 22 аминокислот. Вторая форма, с другой стороны, больше и содержит те же 22 аминокислоты, что и первая форма, но включает дополнительный конец на карбоксильном конце. [8]
Последовательность аминокислот мотилина: Phe - Val - Pro - Ile -Phe- Thr - Tyr - Gly - Glu - Leu - Gln - Arg - Met -Gln-Glu- Lys -Glu-Arg- Asn -Lys-Gly. -Gln. [9]
Изучены структура и динамика желудочно-кишечного пептидного гормона мотилина в присутствии изотропных фосфолипидных бицелл с q = 0,5 . Структуру раствора пептида в растворе ЯМР в кислотном растворе бицелл определяли из 203 ограничений расстояния, полученных из NOE, и шести ограничений на угол скручивания основной цепи . Динамические свойства вектора 13 C α → 1 H в Leu-10 определяли для мотилина, специально меченного 13 C в этом положении, путем анализа данных релаксации с множеством полей. Структура обнаруживает упорядоченную альфа-спиральную конформацию между Glu-9 и Lys-20. N-конец также хорошо структурирован с поворотом, напоминающим поворот классическогобета-поворот . В 13 динамике C ясно показывает , что Мотилин Рушится медленно в растворе, с временем корреляции характеристикой большого объекта. [1]
Стимул [ править ]
Контроль секреции мотилина в значительной степени неизвестен, хотя некоторые исследования показывают, что щелочной pH в двенадцатиперстной кишке стимулирует его высвобождение. Однако при низком pH он подавляет двигательную активность желудка, тогда как при высоком pH оказывает стимулирующее действие. Некоторые исследования на собаках показали, что мотилин высвобождается во время голодания или в период между пищеварением, и прием пищи в этот период может предотвратить секрецию мотилина. [10] Внутривенная инъекция глюкозы, которая увеличивает высвобождение инсулина, также ингибирует циклическое повышение уровня мотилина в плазме. [11]Другие исследования на собаках также показали, что мотилин действует как эндогенный лиганд в механизме положительной обратной связи, чтобы стимулировать высвобождение большего количества мотилина. [12]
Функция [ править ]
Основная функция мотилина заключается в увеличении мигрирующего компонента миоэлектрического комплекса перистальтики желудочно-кишечного тракта и стимуляции выработки пепсина . Мотилин также называют «экономкой кишечника», поскольку он улучшает перистальтику тонкого кишечника и очищает кишечник, чтобы подготовиться к следующему приему пищи. [9] Высокий уровень мотилина, выделяемого в кровь между приемами пищи, стимулирует сокращение дна и антрального отдела желудка и ускоряет опорожнение желудка. Затем он сжимает желчный пузырь и увеличивает давление сжатия нижнего сфинктера пищевода. Другие функции мотилина включают увеличение высвобождения полипептида поджелудочной железы и соматостатина . [13]
Агонисты мотилина [ править ]
Эритромицин и родственные ему антибиотики действуют как непептидные агонисты мотилина и иногда используются из-за их способности стимулировать моторику желудочно-кишечного тракта. В случае эритромицина это его гемикетальный промежуточный продукт, образующийся после перорального приема в среде с низким pH в просвете желудка, который непосредственно действует на рецептор мотилина. [14] Введение низкой дозы эритромицина вызывает перистальтику , что является дополнительным подтверждением вывода о том, что секреция мотилина запускает этот паттерн перистальтики желудочно-кишечного тракта, а не является его результатом. Однако некоторые свойства эритромицина, в том числе антибиотическая активность, не подходят для лекарств, предназначенных для постоянного применения в течение всей жизни пациента.
Новые агонисты мотилина основаны на эритромицине; однако может оказаться, что этот класс препаратов станет излишним. Рецепторы, усиливающие секрецию гормона роста, имеют 52% своей ДНК с рецепторами мотилина , и агонисты этих рецепторов, называемые грелинами , могут вызывать эффекты, аналогичные агонистам мотилина.
Камицинал - это разрабатываемый агонист мотилина .
Прием ксилита также увеличивает секрецию мотилина, что может быть связано со способностью ксилита вызывать диарею. [15]
Связанные пептиды [ править ]
Этот домен также содержится в грелине , стимуляторе секреции гормона роста, синтезируемом эндокринными клетками желудка. Грелин стимулирует рецепторы, стимулирующие секрецию гормона роста в гипофизе. Эти рецепторы отличаются от рецепторов гормона, высвобождающего гормон роста, и, таким образом, обеспечивают средства контроля высвобождения гормона роста гипофизом желудочно-кишечной системой. [16] Эритромицин имеет преимущество перед метоклопрамидом.при опорожнении желудка из-за отсутствия побочных эффектов со стороны центральной нервной системы. FDA не одобрило его использование для опорожнения желудка. В течение короткого периода времени для пациентов с диабетом и для тех, кому необходимо очистить желудок перед какой-либо процедурой, его можно использовать по усмотрению врача с полным пониманием того, что он не одобрен FDA для такого использования.
Человеческие белки [ править ]
GHRL ; Мотилин;
Ссылки [ править ]
- ^ a b c PDB : 1 фунт j ; Андерссон А., Мелер Л. (октябрь 2002 г.). «Структура раствора ЯМР и динамика мотилина в изотропном бицеллярном растворе фосфолипидов». Журнал биомолекулярного ЯМР . 24 (2): 103–12. DOI : 10,1023 / A: 1020902915969 . PMID 12495026 . S2CID 34766985 .
- ^ Daikh DI, Дуглас JO, Эйдельман JP (октябрь 1989). «Структура и экспрессия гена мотилина человека». ДНК . 8 (8): 615–21. DOI : 10.1089 / dna.1989.8.615 . PMID 2574660 .
- ^ Daniel EE (1990-12-11). Функция нейропептидов в желудочно-кишечном тракте . CRC Press. ISBN 9780849361586.
- ^ Госвами С, Shimada Y, Yoshimura М, Мондал А, ОДА S, Танака Т, Т Сакаи, Саката I (2015-06-26). «Мотилин стимулирует секрецию желудочного сока в координации с грелином у Suncus murinus» . PLOS ONE . 10 (6): e0131554. Bibcode : 2015PLoSO..1031554G . DOI : 10.1371 / journal.pone.0131554 . PMC 4482737 . PMID 26115342 .
- ^ Пойтрас P, Питерс TL (февраль 2008). «Мотилин». Текущее мнение в эндокринологии, диабете и ожирении . 15 (1): 54–7. DOI : 10.1097 / MED.0b013e3282f370af . PMID 18185063 . S2CID 220582156 .
- ^ Ито Z (1997). «Мотилин и его клиническое применение». Пептиды . 18 (4): 593–608. DOI : 10.1016 / S0196-9781 (96) 00333-6 . PMID 9210180 . S2CID 38242445 .
- Перейти ↑ Brown JC, Cook MA, Dryburgh JR (май 1973). «Мотилин, полипептид, стимулирующий двигательную активность желудка: полная аминокислотная последовательность». Канадский журнал биохимии . 51 (5): 533–7. DOI : 10.1139 / o73-066 . PMID 4706833 .
- ^ ДеГрут LJ (1989). Макгиган Дж. Э. (ред.). Эндокринология . Филадельфия: Сондерс. п. 2748. ISBN 978-0-7216-2888-2.
- ^ а б Уильямс Р.Л. (1981). Учебник эндокринологии (6-е изд.). Филадельфия: Сондерс. С. 704–705 . ISBN 978-0-7216-9398-9.
- ^ Ито Z, Такеучи S, Аидзава я, Мори К, Т Taminato, Сейно Y, Имура Н, Н Yanaihara (октябрь 1978 г.). «Изменения концентрации мотилина в плазме и сократительной активности желудочно-кишечного тракта у собак в сознании». Американский журнал болезней органов пищеварения . 23 (10): 929–35. DOI : 10.1007 / BF01072469 . PMID 717352 . S2CID 23526142 .
- ^ Лемойн М, Вассеф R, Tasse D, Trudel л, Пойтрас Р (сентябрь 1984). «Мотилин и блуждающая нить у собак». Канадский журнал физиологии и фармакологии . 62 (9): 1092–6. DOI : 10.1139 / y84-182 . PMID 6388765 .
- ^ Hall KE, Гринберг Р., Эль-Шаркави TY, Diamant NE (июль 1984). «Взаимосвязь между индуцированной мотилином свиньи мигрирующей моторной комплексоподобной активностью, целостностью блуждающего нерва и высвобождением эндогенного мотилина у собак» . Гастроэнтерология . 87 (1): 76–85. DOI : 10.1016 / 0016-5085 (84) 90128-8 . PMID 6724277 .
- ^ Фроман LA, Felig P (2001). Гош П.К., О'Дорисио TM (ред.). Эндокринология и метаболизм . Нью-Йорк: McGraw-Hill, Medical Pub. Div. п. 1330. ISBN 978-0-07-022001-0.
- ^ Galligan JJ, Vanner S (октябрь 2005). «Фундаментальная и клиническая фармакология новых средств, стимулирующих моторику». Нейрогастроэнтерология и моторика . 17 (5): 643–53. DOI : 10.1111 / j.1365-2982.2005.00675.x . PMID 16185302 . S2CID 7298061 .
- ^ Wölnerhanssen BK, Meyer-Gerspach AC, Beglinger C, Islam MS (июнь 2019). «Метаболические эффекты натуральных подсластителей ксилита и эритрита: всесторонний обзор». Критические обзоры в области пищевой науки и питания . 60 (12): 1986–1998. DOI : 10.1080 / 10408398.2019.1623757 . PMID 31204494 .
- ^ Kojima M, Хосода H, Мацуо H, Kangawa K (апрель 2001). «Грелин: открытие природного эндогенного лиганда рецептора, стимулирующего секрецию гормона роста». Тенденции в эндокринологии и метаболизме . 12 (3): 118–22. DOI : 10.1016 / S1043-2760 (00) 00362-3 . PMID 11306336 . S2CID 42054657 .
Внешние ссылки [ править ]
- Мотилин в Национальной медицинской библиотеке США по предметным заголовкам по медицинским предметам (MeSH)
- Носек, Томас М. «Раздел 6 / 6ч2 / с6ч2_26» . Основы физиологии человека . Архивировано из оригинала на 2016-03-24.