Агломерация частиц относится к образованию скоплений в суспензии и представляет собой механизм, ведущий к функциональной дестабилизации коллоидных систем. Во время этого процесса частицы, диспергированные в жидкой фазе, прилипают друг к другу и самопроизвольно образуют нерегулярные скопления частиц, хлопья или агломераты. Это явление также называют коагуляцией или флокуляцией, и такую суспензию также называют нестабильной . Агломерация частиц может быть вызвана добавлением солей или других химических веществ, называемых коагулянтом или флокулянтом. [1]

Агломерация частиц может быть обратимым или необратимым процессом. Агломераты частиц, определяемые как «твердые агломераты», труднее повторно диспергировать до исходных отдельных частиц. В процессе агломерации агломераты будут увеличиваться в размерах, и, как следствие, они могут осесть на дно емкости, что называется осаждением . В качестве альтернативы коллоидный гель может образовываться в виде концентрированных суспензий, что изменяет его реологические свойства . Обратный процесс, при котором агломераты частиц повторно диспергируются в виде отдельных частиц, называемый пептизацией , вряд ли происходит спонтанно, но может происходить при перемешивании или сдвиге .
Коллоидные частицы также могут оставаться диспергированными в жидкостях в течение длительного времени (от нескольких дней до нескольких лет). Это явление называется коллоидной стабильностью, и такая суспензия считается функционально стабильной . Стабильные суспензии часто получают при низких концентрациях солей или добавлением химикатов, называемых стабилизаторами или стабилизаторами . Стабильность частиц, коллоидных или иных, чаще всего оценивается с точки зрения дзета-потенциала . Этот параметр обеспечивает легко поддающуюся количественной оценке меру межчастичного отталкивания, которое является ключевым ингибитором агрегации частиц.
Подобные процессы агломерации происходят и в других дисперсных системах. В эмульсиях они также могут быть связаны с коалесценцией капель , что приводит не только к седиментации, но и к образованию сливок . В аэрозолях взвешенные в воздухе частицы могут одинаково агрегировать и образовывать более крупные кластеры (например, сажу ).
Ранние стадии [ править ]
Хорошо диспергированная коллоидная суспензия состоит из отдельных отдельных частиц и стабилизируется силами отталкивания между частицами. Когда силы отталкивания ослабевают или становятся притягивающими из-за добавления коагулянта, частицы начинают агрегироваться. Первоначально из синглетов A 1 будут формироваться дублеты частиц A 2 по схеме [2].
- А 1 + А 1 → А 2
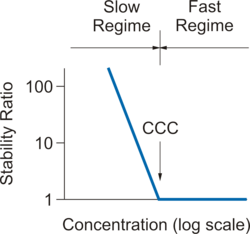
На ранней стадии процесса агрегации суспензия в основном содержит отдельные частицы. Скорость этого явления характеризуется коэффициентом скорости агрегации k . Поскольку образование дублета является процессом второго порядка скорости , единицы измерения этого коэффициента - м 3 с -1, поскольку концентрации частиц выражаются как количество частиц в единице объема (м -3 ). Поскольку абсолютные скорости агрегации трудно измерить, часто ссылаются на безразмерный коэффициент устойчивости W = k fast / k, где k fast - коэффициент скорости агрегации в быстром режиме, а kкоэффициент при интересующих условиях. Коэффициент устойчивости близок к единице в быстром режиме, увеличивается в медленном режиме и становится очень большим, когда подвеска стабильна.
Часто коллоидные частицы взвешены в воде. В этом случае они накапливают поверхностный заряд, и вокруг каждой частицы образуется двойной электрический слой . [3] Перекрытие между диффузными слоями двух приближающихся частиц приводит к отталкивающему потенциалу взаимодействия двойного слоя , который приводит к стабилизации частицы. Когда соль добавляется к суспензии, отталкивание двойного электрического слоя экранируется, и притяжение Ван-дер-Ваальса становится доминирующим и вызывает быструю агрегацию. На рисунке справа показана типичная зависимость коэффициента устойчивости W от концентрации электролита, при этом указаны режимы медленной и быстрой агрегации.
В приведенной ниже таблице критическая концентрация коагуляции (КТС) диапазоны для различного суммарного заряда счетчика иона . [4] Заряд выражается в единицах элементарного заряда . Эта зависимость отражает правило Шульце – Харди [5] [6] , согласно которому CCC изменяется как обратная шестая степень заряда противоиона. CCC также несколько зависит от типа иона, даже если они несут одинаковый заряд. Эта зависимость может отражать различные свойства частиц или различное сродство ионов к поверхности частицы. Поскольку частицы часто имеют отрицательный заряд, катионы многовалентных металлов представляют собой высокоэффективные коагулянты.
| Обвинять | CCC (× 10 -3 моль / л) |
|---|---|
| 1 | 50–300 |
| 2 | 2-30 |
| 3 | 0,03-0,5 |
Адсорбция противоположно заряженных частиц (например, протонов, в частности адсорбирующих ионов, поверхностно-активных веществ или полиэлектролитов ) может дестабилизировать суспензию частиц за счет нейтрализации заряда или стабилизировать ее за счет накопления заряда, что приводит к быстрой агрегации вблизи точки нейтрализации заряда и медленной агрегации вдали. от него.
Количественная интерпретация коллоидной стабильности была впервые сформулирована в рамках теории DLVO . [2] Эта теория подтверждает существование медленного и быстрого режимов агрегации, даже несмотря на то, что в медленном режиме зависимость от концентрации соли часто предсказывается намного сильнее, чем наблюдается экспериментально. Правило Шульце – Харди также может быть выведено из теории ДЛВО .
Не менее возможны и другие механизмы стабилизации коллоидов, в частности, с участием полимеров. Адсорбированные или привитые полимеры могут образовывать защитный слой вокруг частиц, вызывать стерические силы отталкивания и приводить к стерической стабилизации, как в случае с поликарбоксилатным эфиром (PCE), последним поколением химически адаптированного суперпластификатора, специально разработанного для повышения удобоукладываемости бетона. при уменьшении содержания воды для улучшения его свойств и долговечности. Когда полимерные цепи слабо адсорбируются на частицах, полимерная цепь может связывать две частицы и вызывать мостиковые силы. Эта ситуация называется мостиковой флокуляцией .
Когда агрегация частиц происходит исключительно за счет диффузии, имеется в виду перикинетическая агрегация. Агрегация может быть усилена за счет напряжения сдвига (например, перемешивания). Последний случай называется ортокинетической агрегацией.
Более поздние стадии [ править ]
По мере продолжения процесса агрегации формируются более крупные кластеры. Рост происходит в основном за счет встреч между различными кластерами, поэтому один относится к процессу агрегации кластер-кластер. Полученные кластеры нерегулярны, но статистически самоподобны. Они являются примерами массовых фракталов , при этом их масса M растет с их типичным размером, который характеризуется степенным радиусом вращения R g [2]
где d - массовая фрактальная размерность. В зависимости от того, является ли агрегация быстрой или медленной, один относится к кластерной агрегации с ограниченной диффузией (DLCA) или к кластерной агрегации с ограниченной реакцией (RLCA). Кластеры имеют разные характеристики в каждом режиме. Кластеры DLCA рыхлые и разветвленные ( d ≈ 1,8), а кластеры RLCA более компактны ( d ≈ 2,1). [7] Распределение кластеров по размерам также отличается в этих двух режимах. Кластеры DLCA относительно монодисперсны, тогда как распределение кластеров RLCA по размерам очень широкое.
Чем больше размер кластеров, тем выше их скорость оседания. Таким образом, агрегация частиц осадка и этот механизм обеспечивает возможность отделения их от суспензии. При более высоких концентрациях частиц растущие кластеры могут связываться друг с другом и образовывать гель из частиц . Такой гель представляет собой упругое твердое тело, но отличается от обычных твердых тел очень низким модулем упругости .
Гомоагрегация против гетероагрегации [ править ]
Когда агрегация происходит в суспензии, состоящей из подобных монодисперсных коллоидных частиц, этот процесс называется гомоагрегацией (или гомокоагуляцией ). Когда агрегация происходит в суспензии, состоящей из разнородных коллоидных частиц, один относится к гетероагрегации (или гетерокоагуляции ). Простейший процесс гетероагрегации происходит при смешивании двух типов монодисперсных коллоидных частиц. На ранних стадиях могут образовываться три типа дублетов [8]
- А + А → А 2
- В + В → В 2
- А + В → АВ
В то время как первые два процесса соответствуют гомоагрегации в чистых суспензиях, содержащих частицы A или B, последняя реакция представляет собой фактический процесс гетероагрегации. Каждая из этих реакций характеризуется соответствующими коэффициентами агрегации k AA , k BB и k AB . Например, когда частицы A и B несут положительный и отрицательный заряд, соответственно, скорость гомоагрегации может быть низкой, а скорость гетероагрегации высокой. В отличие от гомоагрегации, скорость гетероагрегации увеличивается с уменьшением концентрации соли. Кластеры, образующиеся на более поздних стадиях таких процессов гетероагрегации, еще более разветвлены, чем кластеры, полученные при DLCA ( d ≈ 1,4). [9]
Важным частным случаем процесса гетероагрегации является осаждение частиц на подложку. [1] Ранние стадии процесса соответствуют прикреплению отдельных частиц к субстрату, которые могут быть изображены как другая, гораздо более крупная частица. Более поздние стадии могут отражать блокирование субстрата посредством отталкивающих взаимодействий между частицами, в то время как взаимодействия притяжения могут приводить к многослойному росту, что также называется созреванием. Эти явления актуальны при засорении мембраны или фильтра .
Экспериментальные методы [ править ]
Для изучения агрегации частиц было разработано множество экспериментальных методов. Наиболее часто используются оптические методы с временным разрешением, основанные на пропускании или рассеянии света. [10]
Светопропускание. Изменение проходящего света через агрегатную суспензию можно изучить с помощью обычного спектрофотометра в видимой области. По мере агрегации среда становится более мутной, и ее оптическая плотность увеличивается. Увеличение оптической плотности может быть связано с константой скорости агрегации k, и коэффициент устойчивости можно оценить по таким измерениям. Преимущество этой техники в ее простоте.
Рассеяние света. Эти методы основаны на измерении рассеянного света от агрегированной суспензии с временным разрешением. Статическое рассеяние света приводит к изменению интенсивности рассеяния, а динамическое рассеяние света - к изменению кажущегося гидродинамического радиуса. На ранних стадиях агрегации изменение каждой из этих величин прямо пропорционально константе скорости агрегации k . [11] На более поздних этапах можно получить информацию о сформированных кластерах (например, фрактальную размерность). [7]Рассеяние света хорошо работает для частиц широкого диапазона размеров. Возможно, придется учитывать эффекты множественного рассеяния, поскольку рассеяние становится все более важным для более крупных частиц или более крупных агрегатов. В слабомутных суспензиях такими эффектами можно пренебречь. Процессы агрегации в сильно рассеивающих системах изучались с помощью методов пропускания , обратного рассеяния или спектроскопии диффузных волн .
Подсчет одиночных частиц. Этот метод предлагает отличное разрешение, благодаря которому кластеры, состоящие из десятых долей частиц, могут быть разрешены индивидуально. [11] Агрегатирующая суспензия пропускается через узкий капиллярный счетчик частиц, и размер каждого агрегата анализируется с помощью светорассеяния. По интенсивности рассеяния можно определить размер каждого агрегата и построить подробное распределение агрегатов по размерам. Если суспензии содержат большое количество соли, можно также использовать счетчик Коултера.. С течением времени распределение по размерам смещается в сторону более крупных агрегатов, и из этого изменения могут быть выведены скорости агрегирования и разрушения с участием различных кластеров. Недостатком метода является то, что агрегаты проталкиваются через узкий капилляр при высоком сдвиге, и в этих условиях агрегаты могут разрушаться.
Косвенные техники. Поскольку многие свойства коллоидных суспензий зависят от агрегатного состояния взвешенных частиц, для контроля агрегации частиц также использовались различные косвенные методы. Хотя в таких экспериментах может быть сложно получить количественную информацию о скорости агрегации или свойствах кластера, они могут быть наиболее ценными для практических приложений. Среди этих приемов заселениятесты наиболее актуальны. При осмотре серии пробирок с суспензиями, приготовленными с различной концентрацией флокулянта, стабильные суспензии часто остаются диспергированными, а нестабильные - оседают. Были разработаны автоматизированные инструменты, основанные на светорассеянии / пропускании для контроля осаждения суспензии, и их можно использовать для исследования агрегации частиц. Однако необходимо понимать, что эти методы не всегда могут правильно отражать фактическое агрегатное состояние суспензии. Например, более крупные первичные частицы могут осесть даже в отсутствие агрегации, или агрегаты, которые образовали коллоидный гель, останутся во взвешенном состоянии. Другие косвенные методы, позволяющие контролировать агрегатное состояние, включают, например, фильтрацию , реологию , абсорбциюультразвуковые волны или диэлектрические свойства . [10]
Актуальность [ править ]
Агрегация частиц - широко распространенное явление, которое спонтанно возникает в природе, но также широко исследуется на производстве. Некоторые примеры включают.
Формирование дельты реки . Когда речная вода, несущая частицы взвешенных отложений, достигает соленой воды, агрегация частиц может быть одним из факторов, ответственных за образование дельты реки. Заряженные частицы стабильны в речной пресной воде с низким содержанием соли, но они становятся нестабильными в морской воде с высоким содержанием соли. В последней среде частицы агрегируются, более крупные агрегаты осаждаются и, таким образом, образуют дельту реки.
Производство бумаги . В целлюлозную массу добавляют удерживающие добавки для ускорения образования бумаги. Эти вспомогательные вещества представляют собой коагулирующие добавки, которые ускоряют агрегацию между целлюлозными волокнами и частицами наполнителя. Часто для этой цели используются катионные полиэлектролиты.
Водоподготовка . Очистка городских сточных вод обычно включает этап удаления мелких твердых частиц. Это разделение достигается добавлением флокулирующего или коагулирующего агента, который вызывает агрегацию взвешенных твердых частиц. Агрегаты обычно отделяются осаждением, что приводит к образованию осадка сточных вод. Обычно используемые при обработке воды флокулянты включают ионы многовалентных металлов (например, Fe 3+ или Al 3+ ), полиэлектролиты или и то, и другое.
Производство сыров . Ключевым этапом производства сыра является разделение молока на твердый творог и жидкую сыворотку. Это разделение достигается за счет стимулирования процессов агрегации между мицеллами казеина путем подкисления молока или добавления сычужного фермента. Подкисление нейтрализует карбоксилатные группы мицелл и вызывает агрегацию.
См. Также [ править ]
- Аэрозоль
- Коллоидный
- Разъясняющий агент
- Силы двойного слоя
- Теория ДЛВО (устойчивость коллоидов)
- Электрический двойной слой
- Эмульсия
- Флокуляция
- Гель
- Наночастицы
- Осаждение частиц
- Пептизация
- Скорость реакции
- Поселение
- Уравнение коагуляции Смолуховского
- Золь-гель
- Поверхностный заряд
- Суспензия (химия)
Внешние ссылки [ править ]
- в условиях микрогравитации
Ссылки [ править ]
- ^ a b М. Элимелех, Дж. Грегори, X. Джиа, Р. Уильямс, Осаждение и агрегация частиц: измерение, моделирование и моделирование , Баттерворт-Хайнеман, 1998.
- ^ a b c В. Б. Рассел, Д. А. Сэвилл, В. Р. Шовальтер, Коллоидные дисперсии , Cambridge University Press, 1989.
- ↑ DF Evans, H. Wennerstrom, The Colloidal Domain , John Wiley, 1999.
- ^ Тезак, Б .; Matijevic, E .; Schuiz, KF (1955). «Коагуляция гидрофобных золей в Statu Nascendi. III. Влияние ионного размера и валентности противоиона». Журнал физической химии . 59 (8): 769–773. DOI : 10.1021 / j150530a018 . ISSN 0022-3654 .
- ^ Золотая книга ИЮПАК. Правило Шульце – Харди: «Обобщение, согласно которому критическая концентрация коагуляции для типичного лиофобного золя чрезвычайно чувствительна к валентности противоионов (высокая валентность дает низкую критическую концентрацию коагуляции)» . Источник: PAC, 1972, 31, 577 (Руководство по символам и терминологии для физико-химических величин и единиц, Приложение II: Определения, терминология и символы в коллоидной химии и химии поверхности) на стр. 610.
- ^ Золотая книга IUPAC (1997). Правило Шульце – Харди. Сборник химической терминологии ИЮПАК, 2-е издание (1997 г.).
- ^ а б М. Ю. Линь; HM Lindsay; Д. А. Вайц; RC Ball; Р. Кляйн; П. Микин (1989). «Универсальность в агрегации коллоидов» (PDF) . Природа. С. 360–362. Bibcode : 1989Natur.339..360L . DOI : 10.1038 / 339360a0 .
- ^ Джеймс, Роберт O .; Хомола, Эндрю; Хили, Томас В. (1977). «Гетерокоагуляция амфотерных коллоидов латекса». Журнал химического общества, Труды Фарадея 1: Физическая химия в конденсированных фазах . 73 (0): 1436. DOI : 10.1039 / f19777301436 . ISSN 0300-9599 .
- ^ Ким, Энтони Y; Hauch, Kip D; Берг, Джон С; Мартин, Джеймс Э; Андерсон, Роберт А. (2003). «Линейные цепочки и цепочечные фракталы от электростатической гетероагрегации». Журнал коллоидной и интерфейсной науки . 260 (1): 149–159. Bibcode : 2003JCIS..260..149K . DOI : 10.1016 / S0021-9797 (03) 00033-X . ISSN 0021-9797 .
- ^ a b Грегори, Джон (2009). «Мониторинг процессов агрегации частиц». Достижения в коллоидной и интерфейсной науке . 147–148: 109–123. DOI : 10.1016 / j.cis.2008.09.003 . ISSN 0001-8686 .
- ^ a b Холтхофф, Гельмут; Шмитт, Артур; Фернандес-Барберо, Антонио; Борковец, Михал; Кабрерызо-Вильчес, Мигель Анхель; Шуртенбергер, Питер; Идальго-Альварес, Роке (1997). «Измерение абсолютных констант скорости коагуляции коллоидных частиц: сравнение методов одно- и многочастичного рассеяния света». Журнал коллоидной и интерфейсной науки . 192 (2): 463–470. Bibcode : 1997JCIS..192..463H . DOI : 10,1006 / jcis.1997.5022 . ISSN 0021-9797 .