| Петазис реакция | |
|---|---|
| Названный в честь | Никос А. Петасис |
| Тип реакции | Реакция сцепления |
| Идентификаторы | |
| Портал органической химии | петазис-реакция |
| Идентификатор онтологии RSC | RXNO: 0000232 |
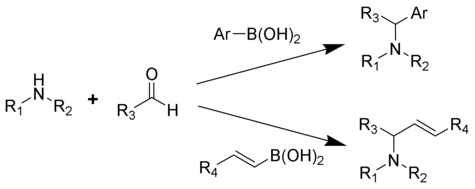
Реакцию Petasis (альтернативно называемый Petasis реакция Бороно-Манниха (PBM) ) представляет собой многокомпонентную реакцию из амина , в карбонила , и винил - или арил - борной кислоты с образованием замещенных аминов.
В 1993 году Никос Петасис сообщил о практическом методе синтеза геометрически чистого противогрибкового агента, нафтифина . [1] [2] [3] В реакции Петасиса винильная группа борорганической кислоты служит нуклеофилом. По сравнению с другими методами получения аллиламинов, реакция Петазиса допускает наличие многофункционального каркаса с множеством аминов и борорганических кислот в качестве потенциальных исходных материалов. Кроме того, для реакции не требуются безводные или инертные условия. В качестве мягкого селективного синтеза реакция Петазиса полезна для получения α-аминокислот и используется в комбинаторной химии и открытии лекарств . [4] [5] [6][7]
Механизм реакции [ править ]
Механизм реакции Петазиса до конца не изучен. В реакции Петазиса неясно, какой интермедиат служит электрофилом. Петасис предполагает, что реакция характеризуется сложным равновесием между тремя исходными материалами и различными промежуточными продуктами, а конечный продукт образуется через определяющую скорость и необратимую стадию образования CC-связи. Конденсация между амином 1 и карбонилом 2 образует полуаминал 4 , который находится в сложном равновесии с иминий-ионом 3 и аминалом 5 . Бороновая кислота 6 обратимо реагирует с полуаминалом 4 и аминалом 5 через промежуточное соединение 7.и 8 соответственно, снова образуя электрофильный ион иминиума 3 , на этот раз сопровождаемый нуклеофильным боронатом 3 ' . Обратите внимание, что нет никаких доказательств того, что бороновая кислота сама по себе может напрямую реагировать с ионами иминиума: помимо того, что для образования значительного количества соли иминия требуется кислота, было показано, что винилбороновые кислоты не реагируют эффективно с предварительно образованными солями иминиума. (как соль Эшенмозера). Затем следует необратимая миграция связи С-С между 3 и 3 'с получением желаемого продукта 9 с потерей борной кислоты. Все промежуточные продукты в конечном итоге приведут к конечному продукту, так как реакция между 3 и 3 'является необратимым, притягивая равновесие всей системы к конечному продукту. [8]
Исследования по теории функционала плотности (DFT) были выполнены для изучения механизма реакции Петазиса. Начиная с реакции Петазиса между глиоксиловой кислотой, диметиламином и фенилбороновой кислотой, Gois et al. сообщил о том , что миграция борной кислоты (заместитель фенильной группы) из «съела комплекс» несет энергетический барьер 10kcal / молей и пятичленную переходное состояние B . [9] Образование солей четвертичного бора во время реакции было экспериментально подтверждено Хансеном и соавторами. Они сообщили , что, в отсутствии амина, Апфилд 11 В сдвиге наблюдаются после добавления глиоксиловой кислоты к раствору фенилбороновой кислоты. Предположительно, это связано с образованием боронатных частиц, богатых электронами.[10]
Подготовка [ править ]
Реакция Петазиса протекает в мягких условиях без использования сильных кислот, оснований или металлов. Амин смешивают с карбонильным субстратом с использованием диоксана или толуола в качестве растворителя при 90 ° C в течение 10 минут. Затем к смеси добавляют бороновую кислоту и образуется продукт либо через 30 минут при 90 ° C, либо через несколько часов при 25 ° C. При синтезе α-аминокислот α-кетокислоты, такие как глиоксиловая и пировиноградная кислота, перемешиваются в этаноле , толуоле или дихлорметане с аминами и винилбороновой кислотой при 25–50 ° C в течение 12–48 ч с получением соответствующих β , γ-ненасыщенные соединения. [1]
Одной из наиболее привлекательных особенностей реакции Петазиса является использование бороновых кислот в качестве источника нуклеофилов. В отличие от большинства виниловых подложек, винилбороновые кислоты устойчивы к воздуху и воде и могут быть удалены во время обработки с помощью простой экстракции. Многие производные бороновой кислоты легко приготовить, и с появлением сочетания Suzuki их большее количество теперь коммерчески доступно. В основополагающем отчете о реакции борорганические кислоты получали гидроборированием концевых алкинов катехолбораном . [1]
Сообщалось также о других методах получения бороновых кислот. [11] [12]
Объем реакции и синтетические приложения [ править ]
В реакции Петазиса допускается широкий спектр функциональных групп, включая спирты, карбоновые кислоты и амины. Известные субстраты, совместимые с условиями реакции, включают сложные эфиры винилбороновой кислоты, эфиры арилбороновой кислоты и органотрифторбораты калия . [13] [14] [15] Кроме того, кроме вторичных аминов, можно использовать различные замещенные амины. Сообщалось о третичных ароматических аминах , гидразинах , гидроксиламинах , сульфонамидах и индолах . [16] [17] [18] [19]
Синтез аллиламинов
Петасис и его коллеги в своем плодотворном исследовании предположили, что винилбороновые кислоты могут реагировать с аддуктами вторичных аминов и параформальдегидом с образованием третичных аллиламинов. Геометрия двойной связи исходной винилбороновой кислоты полностью сохраняется в конечном продукте. Урожайность обычно находится в диапазоне от хорошего до отличного. Следующая реакция особенно эффективна с выходом 96%: [1]
Петасис с соавторами использовали эту реакцию для синтеза нафтифина, очень мощного антимикотика для местного применения, за одну стадию с выходом 82%. Другие соединения с родственной структурой включают тербинафин и NB598. [1]
Синтез аминокислот.
Β, γ-ненасыщенные, N-замещенные аминокислоты удобно получать путем конденсации борорганических кислот, боронатов или сложных эфиров бороновой кислоты с аминами и глиоксиловыми кислотами. Выходы обычно находятся в диапазоне 60–80%, и можно использовать широкий спектр полярных или неполярных растворителей (хотя обычно используются DCM и MeOH). Свободные аминокислоты, не содержащие N-замещений, могут быть получены с использованием тритиламина или бис- (4-метоксифенил) метиламина с последующим снятием защиты в ацильных условиях. [2] Пиеттр и его коллеги обнаружили, что использование высокополярных протонных растворителей, таких как гексафторизопропанол (HFIP), может сократить время реакции и повысить выход. Микроволновое облучение также использовалось для ускорения реакции в метаноле. [20]
Помимо винилбороновой кислоты, в многокомпонентном сочетании Petasis могут также использоваться арилбороновые кислоты и другие гетероциклические производные. Возможный объем субстрата включает тиенил, пиридил, фурил и бензофуранил, 1-нафтил и арильные группы с электронодонорным или электроноакцепторным заместителем. [13]
Клопидогрель, антиагрегант, был синтезирован рацемическим способом Калински и его коллегами в два этапа с использованием реакции Петазиса в качестве ключевой стратегии. Катализируемая кислотой этерификация сразу после стадий многокомпонентного сочетания с получением клопидогреля с общим выходом 44%. [21]
Реакция Петазиса демонстрирует высокую степень стереоконтроля, когда в качестве субстрата используется хиральный амин или альдегид. Когда определенные хиральные амины, такие как (S) -2-фенилглицин, смешиваются с α-кетокислотой и винилбороновой кислотой при комнатной температуре, соответствующий аллиламин образуется в виде единственного диастереомера. Кроме того, энантиомерная чистота может быть достигнута гидрированием диастереоселективного продукта. В реакции с (S) -2-фенилглицинолом (R) -2-фенилглицин образуется с выходом 76%. [1]
Нетрадиционный синтез карбоновых кислот
Помимо аминокислот, реакция Петасиса бороно-Манниха также может быть использована для получения карбоновых кислот, хотя и с нетрадиционными механизмами. Naskar et al. сообщили об использовании N- замещенных индолов в качестве эквивалента амина. Механизм начинается с нуклеофильной атаки 3-положения «N» -замещенного индола на электрофильный альдегид с последующим образованием «комплекса ате» 1.через реакцию бороновой кислоты с карбоновой кислотой. Промежуточный продукт затем подвергается дегидратации с последующей миграцией боронат-алкильной группы с получением конечного продукта - карбоновой кислоты. Урожайность находится в диапазоне от умеренного до хорошего (40–70%). Допускается широкий спектр арилбороновых кислот, в то время как об использовании винилбороновых кислот не сообщается. «N» -незамещенные индолы реагируют очень медленно при нормальных условиях реакции, что подтверждает механизм, описанный ниже. [19]
Naskar et al. также предложил использовать третичные ароматические амины в реакции Петасиса в качестве другого эквивалента нуклеофила амина. Механизм аналогичен случаю N-замещенного индола. Реакцию проводят в жестких условиях (24 часа кипячения с обратным холодильником в 1,4-диоксане), но полученная карбоновая кислота получается с приемлемым выходом (выход 41–54%). Обратите внимание, что использование α-кетокислоты вместо глиоксиловой кислоты не снижает выхода. 1,3,5-триоксигенированные производные бензола также могут быть использованы вместо третичных ароматических аминов. [18]
Синтез производных иминодикарбоновой кислоты
При использовании в качестве азотных нуклеофилов аминокислоты могут давать различные производные иминодикарбоновой кислоты. Обычно наблюдается высокая диастереоселективность, и вновь образованный стереоцентр обычно имеет ту же конфигурацию, что и исходная аминокислота. Эта реакция хорошо работает в высокополярных растворителях (например, вода, этанол и т. Д.). Пептиды с незащищенным азотистым концом также можно использовать в качестве эквивалента нуклеофилов азота. Петасис и его коллеги приготовили этим методом эналаприлат, ингибитор АПФ. [8]
Синтез пептидомиметических гетероциклов.
Когда диамины используются в реакциях PBM, эффективно получаются гетероциклы различной структуры, такие как пиперазиноны, бензопиперазиноны и бензодиазепиноны. Реакции лактамизации обычно используются для образования гетероциклов, обычно в сильно кислых условиях. [8]
Синтез аминоспиртов
Когда α-гидроксиальдегид используется в качестве субстрата в синтезе β-аминоспиртов, образуется единственный диастереомер. В этой реакции образуется исключительно анти-продукт, что подтверждаетсяспектроскопией 1 H ЯМР. Продукт не подвергается рацемизации, и при использовании энантиомерно чистых α-гидроксиальдегидов может быть достигнут энантиомерный избыток. Считается, что бороновая кислота сначала прореагировала с хиральной гидроксильной группой, давая нуклеофильный алкенилборонат, а затем последовала селективная внутримолекулярная миграция алкенильной группы в электрофильный иминиевый углерод, необратимо образуя желаемую СС-связь. В реакции энантиомерно чистых глицеральдегидов соответствующий 3-амино 1,2-диол образуется с выходом 70% и более 99% ее.[3]
Пайн с соавторами предположили, что диастереоселективность возникает в результате реакции более стабильной (и, в данном случае, более реактивной) конформации комплекса ат, где 1,3-аллильный штамм сведен к минимуму. [22] [23] [24]
Используя дигидроксиацетон, несколько нетрадиционный эквивалент альдегида, Sugiyama et al. может использовать реакцию Петазиса для сборки основной структуры FTY720 (мощного иммунодепрессанта) с выходом 40%. Затем следует прямое гидрирование с получением продукта путем одностадийного удаления бензильной группы и гидрирования двойной связи CC. [25]
Синтез аминополиолов и аминосахаров
Петасис и его коллеги сообщили об использовании незащищенных углеводов в качестве карбонильного компонента в реакциях с PBM. Его используют как эквивалент α-гидроксилальдегидов с уже существующей хиральностью, и аминополиол обычно получают с выходом от умеренного до хорошего и с превосходной селективностью. Для получения продуктов с высоким стереохимическим обогащением можно использовать широкий спектр углеводов, а также нуклеофилов азота (например, аминокислот). Затем продукты аминополиола могут подвергаться дальнейшим реакциям с получением аминосахаров. Петасис использовал эту реакцию для получения Boc-защищенного маннозамина из D-арабинозы. [8]
Приложения в энантиоселективном синтезе [ править ]
С хиральным нуклеофилом амина.
Вообще говоря, когда хиральный амин используется в связывании Петасиса, стереохимический результат реакции Петасиса сильно коррелирует с хиральностью амина, и наблюдается высокая или превосходная диастереоселективность даже без использования объемных хиральных индуцирующих групп.Было показано, чтохиральные бензиламины, [26] 2-замещенные пирролидины [27] и 5-замещенные 2-морфолиноны [28] [29] вызывают от хорошего до превосходного диастереомерный избыток в различных условиях реакции Петасиса.
С хиральными ионами
N-ацилиминия «исходные материалы» хиральных ионов N-ацилиминия обычно получают дегидратацией циклического полуаминаля in situ. Они также несут хиральную гидроксильную группу, которая находится рядом с иминиевым углеродом; бороновые кислоты реагируют с такими хиральными гидроксильными группами с образованием хиральных и богатых электронами частиц бороната с последующим боковым селективным и внутримолекулярным переносом винила / арила бороната на иминиевый углерод. Следовательно, реакция является высоко диастереоселективной, причем преобладающим путем является перенос цисборонатарила / винила. Гидроксипирролидины [30] и гидрокси-γ- и δ-лактамы [31]было показано, что они очень диастереоселективно реагируют с выходом от хорошего до превосходного. Однако такие процедуры ограничиваются использованием только винил- или богатых электронами арилбороновой кислоты.
Бейти и его коллеги воспользовались высокой диастереоселективностью этой реакции для получения (±) -6-дезоксикастаноспермина в 7 стадий с впечатляющим общим выходом 32% (из сложного винилборонового эфира). Ключевой ациклический предшественник дезоксикастаноспермина (A) сначала образуется путем конденсации сложного винилборонового эфира 1 с Cbz-защищенным гидроксипирролидином 2 с помощью связывания PBM с последующим дигидроксилированием и защитой TBS. Затем A подвергается внутримолекулярной циклизации посредством образования и восстановления имина в одном реакторе с последующим снятием защиты TBS с получением (±) -6-дезоксикастаноспермина. [32]
С тиомочевиной катализатором
Такемото иколлеги из Университета Киото недавно сообщили энантиоселективную реакцию Petasis типа для преобразования хинолинов в соответствующие хиральные 1,2-дигидрохинолины (продукт)использованием бороновой кислотойалкенили и хиральную катализатор тиомочевины. Сообщается о хороших урожаях (59–78%) и отличной энантиоселективности (82–96%). [33]
Такемото и его коллеги заметили, что добавление хлорформиатов необходимо в качестве электрофильных активирующих агентов, и без них реакция не протекает. Кроме того, для стереоселективного протекания реакции на катализаторе требуется функциональная группа 1,2-аминоспирта. Они рационализируют эти результаты, предполагая, что реагент хлорформиата реагировал с азотом хинолина с образованием N-ацилированного хинолиниевого промежуточного соединения B, которое дополнительно активируется электрофильной хиральной тиомочевиной. Они также предполагают, что 1,2-аминоспиртовая функциональность катализатора хелатирует алкенилбороновые кислоты и что такое хелатирование влияет на стереохимический результат. [33]
С хиральными бифенолами
Шаус и Лу из Бостонского университета сообщили о следующей реакции, в которой хиральные α-аминокислоты с различными функциональными возможностями удобно получать путем смешивания алкенилдиэтилборонатов, вторичных аминов, глиоксилатов и хирального бифенольного катализатора в толуоле в одной емкости: [34 ]
Эта реакция допускает широкий спектр функциональных возможностей как со стороны алкенилборонатов, так и со стороны вторичного амина: электронное богатство субстратов не влияет на выход и энантиоселективность, а также стерически требовательные субстраты (диалкилзамещенные алкенилборонаты и амины с α-стереоцентром). ) лишь незначительно ухудшают энантиоселективность. Скорость реакции зависит от конкретного случая. [34]
В указанных условиях субстраты бороновых кислот не проявляли энантиоселективности. Также в реакционной системе используется молекулярное сито 3Å. Хотя авторы не указали причину такого использования в статье, было высказано предположение, что молекулярные сита 3Å действуют как поглотитель воды и предотвращают разложение алкенилдиэтилборонатов на соответствующие бороновые кислоты. Катализатор можно рециркулировать из реакции и использовать повторно без снижения выхода или энантиоселективности. [34]
Совсем недавно Юань с коллегами из Института органической химии Чэнду Китайской академии наук объединили оба подхода (хиральный тиомочевинный катализатор и хиральный бифенол) в одном катализаторе, впервые сообщив о каталитической системе, которая способна выполнять энантиоселективную реакцию Петазиса между салицилальдегиды, вторичные циклические амины и арил- или алкенилбороновые кислоты: [35]
В одном приложении реакция Петазиса используется для быстрого доступа к многофункциональному каркасу для дивергентного синтеза . Реагентами являются лактол, полученный из L- фенилмолочной кислоты и ацетона , метиловый эфир 1-фенилаланина и бороновая кислота . Реакция протекает в этаноле при комнатной температуре с образованием анти-1,2-аминоспирта с диастереомерным избытком 99%. [36]
Обратите внимание, что авторы не могут оценить син-1,2-аминоспирт с помощью этого метода из-за внутренней механистической селективности, и авторы утверждают, что такая внутренняя селективность препятствует их способности получить доступ к полной матрице стереоизомерных продуктов для использования скрининга малых молекул. В недавнем отчете Шаус и его сотрудники сообщили, что синаминоспирт может быть получен при следующих условиях реакции с использованием хирального дибром-бифенольного катализатора, разработанного их группой: [37]
Хотя соотношение син-антидиастереомеров варьируется от среднего до хорошего (от 1,5: 1 до 7,5: 1), объем субстрата для таких реакций остается довольно ограниченным, и обнаружено, что диастереоселективность зависит от стереогенного центра исходного материала амина. . [37]
Реакция Петазиса и тотальный синтез [ править ]
Бо с соавторами собрали дигидропирановый каркас ядра из конгенеров занамивира посредством комбинации реакции PBM и последовательности снятия защиты-циклизации, стимулированной железом (III). Стереохимически определенный α-гидроксиальдегид 2, диаллиламин и диметилкеталь-защищенная бороновая кислота 1 соединяются с образованием ациклического, стереохимически определенного аминоспирта 3, который затем подвергается циклизации, стимулируемой железом (III), с образованием бициклического дигидропирана 4 Селективное раскрытие оксазолиновой части промежуточного дигидропирана 4 водой или тиметилсилилазидом затем приводит к получению последующих продуктов, которые имеют структуру, напоминающую члены семейства Занамивира. [38]
Вонг с соавторами получили N-ацетилнейраминовую кислоту с помощью связывания PBM с последующим нитрон- [3 + 2] циклоприсоединением. Винилбороновую кислоту сначала связывают с L-арабинозой 1 и бис (4-метоксифенил) метанамином 2 с образованием стереохимически определенного аллиламина 3. После этого последовательность диполярного циклоприсоединения, опосредованного основаниями разрыва связи NO и гидролиза завершает синтез N-ацетилнейраминовая кислота. [39]
См. Также [ править ]
- Реакция Манниха
- Восстановительное аминирование
- Сузуки реакция
Ссылки [ править ]
- ^ a b c d e f Петазис, штат Северная Каролина; Акритопулу, И. (1993). «Реакция Манниха бороновой кислоты: новый метод синтеза геометрически чистых аллиламинов». Tetrahedron Lett. 34 (4): 583–586. DOI : 10.1016 / S0040-4039 (00) 61625-8 .
- ^ a b Петазис, штат Северная Каролина; Завьялов И.А. (1997). «Новый и практичный синтез -аминокислот из алкенилбороновой кислоты». Варенье. Chem. Soc. 119 (2): 445–446. DOI : 10.1021 / ja963178n .
- ^ a b Петазис, Северная Америка; Завьялов И.А. (1998). «Высококонтролируемый одностадийный синтез анти-β-аминоспиртов из борорганических кислот, аминов и α-гидроксиальдегидов». Варенье. Chem. Soc. 120 (45): 11798–11799. DOI : 10.1021 / ja981075u .
- ^ Candeias, NR; Montalbano, F .; Cal, PMSD, Gois, PMP (2010). «Бороновые кислоты и сложные эфиры в многокомпонентной реакции Петасис-Бороно Манниха». Chem. Ред. 110 (10): 6169–6193. DOI : 10.1021 / cr100108k . PMID 20677749 . CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Бэйти, RA (2005). «Реакции нуклеофильного присоединения арильных и алкенилборных кислот и их производных к иминам и ионам иминия». В Холле, Д.Г. (ред.). Бороновые кислоты: получение и применение в органическом синтезе и медицине . Wiley-VCH. стр. 279 -304. DOI : 10.1002 / 3527606548.ch7 . ISBN 9783527606542.
- ^ Рамадхар, TR; Батей, РА (2011). «Последние достижения в реакциях нуклеофильного присоединения борорганических кислот и их производных к ненасыщенным функциям CN». В Холле, Д.Г. (ред.). Бороновые кислоты: подготовка и применение в органическом синтезе, медицине и материалах, второе издание . Wiley-VCH. С. 427–477. DOI : 10.1002 / 9783527639328.ch9 . ISBN 9783527639328.
- ^ Ву, Пэн; Гивсков Михаил; Нильсен, Томас Э. (27 августа 2019 г.). «Реакционная способность и синтетические применения многокомпонентных петазисных реакций» . Химические обзоры . 119 (20): 11245–11290. DOI : 10.1021 / acs.chemrev.9b00214 . PMC 6813545 . PMID 31454230 .
- ^ а б в г Петасис, Северная Америка (2005). «Многокомпонентные реакции с борорганическими соединениями». In Zhu, J .; Биенайме, Х. (ред.). Многокомпонентные реакции . Wiley-VCH. С. 199 –223. DOI : 10.1002 / 3527605118.ch7 . ISBN 9783527605118.
- ^ Candeias, NR; Cal, PMSD; Андре, В; Duarte, MT; Вейрос, LF; Гойс, PMP (2010). «Вода как реакционная среда для многокомпонентных реакций на основе бороновых кислот». Тетраэдр . 66 (14): 2736–2745. DOI : 10.1016 / j.tet.2010.01.084 .
- ^ Schlienger, N; Брайс, MR; Хансен, Т.К. (2000). "Борная реакция Манниха в твердофазном подходе". Тетраэдр . 56 (51): 10023–10030. DOI : 10.1016 / s0040-4020 (00) 00957-1 .
- ^ Хоффманн. RW; Dresely, S. (1988), "Получение 3-замещенных (E) -1-alkenylboronic сложные эфиры", Синтез , 1988 (2): 103-106, DOI : 10,1055 / с-1988-27480
- ^ Браун, HC; Bhat, NG; Iyer, RR (1991), «Новый путь к сложным эфирам 1,3-диенил-2-бороновой кислоты, обеспечивающий простой синтез конъюгированных (E, E) -диенов и конъюгированных (E) -алкенонов», Tetrahedron Lett. , 32 (30): 3655-3658, DOI : 10.1016 / s0040-4039 (00) 79758-9
- ^ a b Петазис, штат Северная Каролина; Гудман, А., Завьялов, И. (1997), "Новый синтез альфа-arylglycines из арилбороновых кислот", Tetrahedron , 53 (48): 16463-16470, DOI : 10.1016 / S0040-4020 (97) 01028-4CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Кабалка, GW; Venkataiah, B .; Донг, Г. (2004), «Использование алкинилтрифторборатов калия в реакциях Манниха», Tetrahedron Lett. , 45 (4): 729-731, DOI : 10.1016 / j.tetlet.2003.11.049
- ^ Tremblay-Morin, J.P .; Raeppel, S .; Gaudette, F. (2004), "Катализируемые кислотой Льюиса реакции типа Манниха с органофторборатом калия", Tetrahedron Lett. , 45 (17): 3471-3474, DOI : 10.1016 / j.tetlet.2004.03.014
- ^ Портлок, Германия; Naskar, D .; West, L .; Ли, М. (2002), "Реакции Петазиса бороновой кислоты-Манниха замещенных гидразинов: синтез α-гидразинкарбоновых кислот", Tetrahedron Lett. , 43 (38): 6845-6847, DOI : 10.1016 / S0040-4039 (02) 01511-3
- ^ Naskar, D., Roy, A., Seibel, WL, Portlock, DE (2003), «Гидроксиламины и сульфинамид в качестве аминных компонентов в реакции Петасис бороновая кислота – Манниха: синтез N-гидрокси или алкокси-α-аминокарбоновых кислот и N- (трет-бутилсульфинил) -α-аминокарбоновые кислоты », Tetrahedron Lett. , 44 (49): 8865-8868, DOI : 10.1016 / j.tetlet.2003.09.179CS1 maint: несколько имен: список авторов ( ссылка )
- ^ а б Наскар, Д .; Рой, А .; Seibel, WL, Portlock, DE (2003), «Новая бороновая кислота Petasis - реакции Манниха с третичными ароматическими аминами», Tetrahedron Lett. , 44 (31): 5819-5821, DOI : 10.1016 / S0040-4039 (03) 01405-9CS1 maint: несколько имен: список авторов ( ссылка )
- ^ а б Наскар, Д .; Neogi, S .; Рой, А .; Mandal, AB (2008), "Новые реакции бороновой кислоты Petasis с индолами: синтез индол-3-иларилуксусных кислот", Tetrahedron Lett. , 49 (48): 6762-6764, DOI : 10.1016 / j.tetlet.2008.08.029
- ^ Jourdan, H .; Gouhier, G .; Van Hijfte, L .; Angibaud, P .; Пьеттр, SR (2005). «Об использовании боронатов в реакции Петасиса». Tetrahedron Lett . 46 (46): 8027–8031. DOI : 10.1016 / j.tetlet.2005.09.060 .CS1 maint: несколько имен: список авторов ( ссылка )
- ^ Калински, C .; Lemoine, H .; Schmidt, J .; Burdack, C .; Kolb, J .; Umkehrer, M .; Росс, Г. (2008). «Многокомпонентные реакции как мощный инструмент для синтеза дженериков». Синтез . 2008 (24): 4007–4011. DOI : 10,1055 / с-0028-1083239 .
- ^ Дэвис, AS; Pyne, SG; Скелтон, Б.В.; Белый, AH (2004). «Синтез предполагаемого унифлорина А». J. Org. Chem . 69 (9): 3139–43. DOI : 10.1021 / jo049806y . PMID 15104453 .
- ^ Au, CWG; Пайн, С. Г. (2006). «Асимметричный синтез анти-1,2-аминоспиртов через реакцию Бороно-Манниха: формальный синтез (-) - сваинсонина». J. Org. Chem . 71 (18): 7097–9. DOI : 10.1021 / jo0610661 . PMID 16930074 .
- ^ Пайн, SG; Au, CWG; Дэвис, А.С.; Morgan, IR; Ritthiwigrom, T .; Язычи, А. (2008). «Использование бороно-реакции Манниха в синтезе биоактивных алкалоидов» . Pure Appl. Chem . 80 (4): 751–762. DOI : 10,1351 / pac200880040751 .
- ^ Sugiyama, S .; Arai, S .; Кирияма, М .; Исии, К. (2005). «Удобный синтез иммунодепрессанта FTY720 с использованием реакции Петазиса» . Chem. Pharm. Бык . 53 (1): 100–2. DOI : 10,1248 / cpb.53.100 . PMID 15635240 .
- ^ Jiang, B .; Yang, C.-G .; Гу, X.-H. (2001). «Высокостереоселективный синтез индолил-N-замещенных глицинов». Tetrahedron Lett . 42 (13): 2545–2547. DOI : 10.1016 / s0040-4039 (01) 00229-5 .
- ^ Нанда, KK; Троттер, Б.В. (2005). «Диастереоселективные реакции Петазиса Манниха, ускоренные гексафторизопропанолом: синтез арилглицина на основе пирролидина». Tetrahedron Lett . 46 (12): 2025–8. DOI : 10.1016 / j.tetlet.2005.01.151 .
- ^ Харвуд, LM; Карри, GS; Дрю, МГБ; Люк, RWA (1996). «Асимметрия в реакции Манниха бороновой кислоты: диастереоконтролируемое добавление к хиральным образцам иминия, полученным из альдегидов и (S) -5-фенилморфолин-2-она». Chem. Commun. (16): 1953. DOI : 10.1039 / cc9960001953 .
- ^ Карри, GS; Дрю, МГБ; Харвуд, Л. М.; Хьюз, диджей; Люк, RWA; Викерс, Р.Дж. (2000). «Хирали темплатная реакция Манниха бороновой кислоты в синтезе оптически активных α-аминокислот». J. Chem. Soc., Perkin Trans. 1 (17): 2982–2990. DOI : 10.1039 / B003067H .
- ^ Бэти, РА; MacKay, DB; Сантакумар В. (1999). «Алкенил и арилборонаты мягкие нуклеофилы для стереоселективного образования функционализированных N-гетероциклов». Варенье. Chem. Soc . 121 (21): 5075–5076. DOI : 10.1021 / ja983801z .
- ^ Морган, IR; Yazici, A .; Пайн, С.Г. (2008). «Диастереоселективные реакции бороно-Манниха на циклических ионах N-ацилиминия». Тетраэдр . 64 (7): 1409–1419. DOI : 10.1016 / j.tet.2007.11.046 .
- ^ Бэти, РА; Маккей, ДБ (2000). «Полный синтез (±) -6-дезоксикастаноспермина: применение добавления борорганических соединений к ионам N-ацилиминия». Tetrahedron Lett . 41 (51): 9935–9938. DOI : 10.1016 / s0040-4039 (00) 01790-1 .
- ^ a b Ямаока, Й .; Miyabe, H .; Такемото, Ю. (2007). «Каталитическая энантиоселективная реакция петазисного типа хинолинов, катализируемая новым тиомочевинным катализатором». Варенье. Chem. Soc . 129 (21): 6686–7. DOI : 10.1021 / ja071470x . PMID 17488015 .
- ^ a b c Lou, S .; Schaus, SE (2008). «Асимметричные реакции петазиса, катализируемые хиральными бифенолами» . Варенье. Chem. Soc . 130 (22): 6922–6923. DOI : 10.1021 / ja8018934 . PMC 2440570 . PMID 18459782 .
- ^ Хан, W.-Y .; Wu, Z.-J .; Zhang, X.-M .; Юань, W.-C. (2012), "Энантиоселективная трехкомпонентная петазисная органокаталитическая реакция среди салициловых альдегидов, аминов и борорганических кислот", Org. Lett. , Как можно скорее (4): 976-979, DOI : 10.1021 / ol203109a , PMID 22292670
- ^ Наоя Кумагаи, Джованни Мунчипинто, Стюарт Л. Шрайбер; Мунчипинто; Шрайбер (2006). «Короткий синтез скелетно и стереохимически разнообразных малых молекул путем связывания реакций петазовой конденсации с реакциями циклизации». Angewandte Chemie International Edition . 45 (22): 3635–3638. DOI : 10.1002 / anie.200600497 . PMID 16646101 . CS1 maint: несколько имен: список авторов ( ссылка )
- ^ a b Muncipinto, G .; Moquist, PN; Schreiber, SL; Scahus, SE (2011). «Каталитические диастереоселективные петазисные реакции» . Энгью. Chem. Int. Эд . 50 (35): 8172–8175. DOI : 10.1002 / anie.201103271 . PMC 4673970 . PMID 21751322 .
- ^ Soule, J.-F .; Mathieu, A .; Норсикян, С .; Бо, Ж.-М. (2010). «Соединение конденсации Петазиса с каскадом, стимулируемым хлоридом железа (III), обеспечивает короткий синтез конгенеров Реленца». Орг. Lett . 12 (22): 5322–5325. DOI : 10.1021 / ol102326b . PMID 20945892 .
- ^ Hong, Z .; Liu, L .; Hsu, C.-C .; Вонг, C, -H. (2006). «Трехстадийный синтез сиаловых кислот и производных». Энгью. Chem. Int. Эд . 45 (44): 7417–7421. DOI : 10.1002 / anie.200601555 . PMID 17031889 . CS1 maint: несколько имен: список авторов ( ссылка )