Катализ окисления воды
Катализ окисления воды (WOC) – это ускорение (катализ) превращения воды в кислород и протоны:
Эффективны многие катализаторы, как гомогенные , так и гетерогенные . Основным примером является комплекс, выделяющий кислород при фотосинтезе. Нет никакого интереса в получении кислорода путем окисления воды, так как кислород легко получается из воздуха. Наоборот, интерес к окислению воды мотивирован ее отношением к расщеплению воды , которое могло бы обеспечить «солнечный водород », т. е. окисление воды генерировало бы электроны и протоны для производства водорода. [2] Идеальный WOC должен работать быстро при низком перенапряжении, демонстрировать высокую стабильность и иметь низкую стоимость, поскольку он изготовлен из нетоксичных компонентов.
Воду труднее окислить, чем сопряженный с ней гидроксид основания . Гидроксид стабилизируется путем координации с катионами металлов. Некоторые гидроксиды металлов, имеющие окислительно-восстановительные центры металлов, могут быть окислены с образованием оксокомплексов металлов . Атака водой оксоцентров металлов представляет собой один из путей образования связи ОО, приводящий к образованию дикислорода. В качестве альтернативы, решающая стадия образования ОО-связи может возникать за счет соединения подходящим образом расположенных пар металлических гидроксоцентров. Молекулярный механизм ОЕС не выяснен.
Для превращения даже гидроксокомплексов металлов в О 2 требуются очень сильные окислители. В фотосинтезе такими окислителями являются электронные дырки на катион-радикалах порфирина. Для применения в устройствах аспирационным окислителем является фотогальванический материал. Для скрининга WOC типичным акцептором электронов является нитрат церия и аммония .
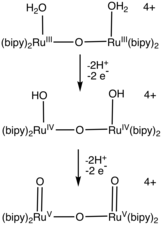
Ряд рутениево- аквакомплексов катализирует окисление воды. Большинство катализаторов содержат бипиридиновые и терпиридиновые лиганды. [3] [4] [2] Катализаторы, содержащие пиридин-2-карбоксилат , демонстрируют скорости (300 с -1 ), сравнимые со скоростью фотосистемы II . [5] [6] Работа в этой области открыла много новых полипиридильных лигандов. [7] [8]
Ранние образцы WOC на основе кобальта страдали нестабильностью. [9] Гомогенный WOC [Co(Py 5 )(H 2 O)](ClO 4 ) 2 [10] действует путем протонно-связанного переноса электрона с образованием частиц [Co III -OH] 2+ , которые на дальнейшее окисление образует промежуточный продукт Co IV . Образовавшийся промежуточный продукт реагирует с водой с выделением O 2 . Кобальт- полиоксометаллатный комплекс [Co 4 (H 2 O) 2 (α-PW 9 O 34 ) 2 ] 10– является высокоэффективным ВОС.[11]