| ацетолактатсинтаза | ||||||||
|---|---|---|---|---|---|---|---|---|
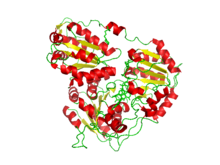 Кристаллическая структура синтазы ацетогидроксикислот Arabidopsis thaliana в комплексе с сульфонилмочевинным гербицидом, метсульфурон-метилом . [1] | ||||||||
| Идентификаторы | ||||||||
| ЕС нет. | 2.2.1.6 | |||||||
| № CAS | 9027-45-6 | |||||||
| Альт. имена | пируват: пируват ацетальдегидетрансфераза (декарбоксилирование) | |||||||
| Базы данных | ||||||||
| IntEnz | Просмотр IntEnz | |||||||
| BRENDA | BRENDA запись | |||||||
| ExPASy | Просмотр NiceZyme | |||||||
| КЕГГ | Запись в KEGG | |||||||
| MetaCyc | метаболический путь | |||||||
| ПРИАМ | профиль | |||||||
| Структуры PDB | RCSB PDB PDBe PDBsum | |||||||
| Генная онтология | Amigo / QuickGO | |||||||
| ||||||||
| ILVBL | |||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Идентификаторы | |||||||||||||||||||||||||
| Псевдонимы | ILVBL , 209L8 , AHAS, ILV2H, ilvB (бактериальный ацетолактатсинтаза) -подобный, HACL1L, ilvB-подобный ацетолактатсинтазе | ||||||||||||||||||||||||
| Внешние идентификаторы | OMIM : 605770 MGI : 1351911 HomoloGene : 68532 GeneCards : ILVBL | ||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| |||||||||||||||||||||||||
| Ортологи | |||||||||||||||||||||||||
| Разновидность | Человек | Мышь | |||||||||||||||||||||||
| Entrez |
|
| |||||||||||||||||||||||
| Ансамбль |
|
| |||||||||||||||||||||||
| UniProt |
|
| |||||||||||||||||||||||
| RefSeq (мРНК) |
|
| |||||||||||||||||||||||
| RefSeq (белок) |
|
| |||||||||||||||||||||||
| Расположение (UCSC) | Chr 19: 15.11 - 15.13 Мб | Chr 10: 78,57 - 78,58 Мб | |||||||||||||||||||||||
| PubMed поиск | [4] | [5] | |||||||||||||||||||||||
| Викиданные | |||||||||||||||||||||||||
| |||||||||||||||||||||||||
Ацетолактатсинтаза ( БАС ) фермент (также известная как ацетогидроксикислоты - синтазы , или AHAS ) представляет собой белка , содержатся в растениях и микроорганизмах. ALS катализирует первую стадию синтеза аминокислот с разветвленной цепью ( валина , лейцина и изолейцина ). [6]
Человеческий белок до сих пор неизвестной функции, разделяя некоторое сходство последовательности с бактериальной АЛС, кодируются ILVBL (ilvB-подобный) гена . [7]
Структура [ править ]
Джин [ править ]
Ген ILVBL человека имеет 17 экзонов, расположенных на хромосоме 19 на q13.1. [8]
Белок [ править ]
Каталитический пептид БАС в кресс-салате мышей представляет собой хлоропластный белок, состоящий из 670 остатков, последние 615 из которых образуют активную форму. Обнаружены три основных домена, из которых два тиаминпирофосфата расположены между DHS-подобным NAD / FAD-связывающим доменом. [9] В SCOP-присвоении эти субъединицы именуются d1yhya1, d1yhya2 и d1yhya3 от N-конца до C-конца. [10]
Структура ацетолактатсинтазы, которая использовалась для изображения на этой странице, была определена с помощью дифракции рентгеновских лучей при 2,70 ангстрем. Рентгеновская дифракция использует рентгеновские лучи с определенными длинами волн для создания структур, поскольку рентгеновские лучи рассеиваются определенным образом, что дает представление о структуре анализируемой молекулы.
Есть пять специфических лигандов, которые взаимодействуют с этим белком. Эти пять перечислены ниже.
| Идентификатор лиганда | Имя | Состав |
|---|---|---|
| P22 | ДИФОСФАТ ЭТИЛ ДИГИДРОГЕНА | С 2 Н 8 О 7 П 2 |
| NHE | 2- [N-ЦИКЛОГЕКСИЛАМИНО] ЭТАН СУЛЬФОНОВАЯ КИСЛОТА | C 8 H 17 NO 3 S |
| Mg | Ион магния | Mg |
| FAD | ФЛАВИН-АДЕНИН ДИНКЛЕОТИД | C 27 H 33 N 9 O 15 P 2 |
| 1см | МЕТИЛ 2 - [({[(4,6-ДИМЕТИЛПИРИМИДИН-2-ИЛ) АМИНО] КАРБОНИЛ} АМИНО) СУЛЬФОНИЛ] БЕНЗОАТ | C 15 H 16 N 4 O 5 S |
Связанный FAD не является катализатором.
Функция [ править ]
Ацетолактатсинтаза - это каталитический фермент, участвующий в биосинтезе различных аминокислот. Этот фермент имеет код Комиссии по ферментам 2.2.1.6, что означает, что фермент представляет собой транскетолазу или трансальдолазу, которая классифицируется как трансферазы, переносящие остатки альдегида или кетона. В этом случае синтаза ацетолактазы представляет собой транскетолазу, которая движется вперед и назад, имея как катаболические, так и анаболические формы. Они действуют на кетон ( пируват ) и могут перемещаться вперед и назад в метаболической цепи. Они обнаружены у людей, животных, растений и бактерий. У растений они расположены в хлоропластах, чтобы помочь в обменных процессах. [9] В пекарских дрожжах они расположены в митохондриях. [11]В нескольких экспериментах было показано, что мутировавшие штаммы Escherichia coli K-12 без фермента не могли расти в присутствии только ацетата или олеата в качестве единственных источников углерода. [12]
Катаболическая версия, не связывающая FAD ( InterPro : IPR012782 ), обнаружена у некоторых бактерий.
Каталитическая активность [ править ]
Ацетолактатсинтаза, также известная как синтаза ацетогидроксикислот, представляет собой фермент, специально участвующий в превращении пирувата в ацетолактат:
- 2 CH 3 COCO 2 - → - O 2 CC (OH) (CH 3 ) COCH 3 + CO 2
В реакции используется пирофосфат тиамина, чтобы связать две молекулы пирувата. Полученный продукт этой реакции, ацетолактат, в конечном итоге становится валином, лейцином и изолейцином. Все три из этих аминокислот являются незаменимыми аминокислотами и не могут быть синтезированы человеком. Это также приводит к системному названию пирувата: пируват ацетальдегидетрансфераза (декарбоксилирование) . Этот фермент является первым из нескольких ферментов в цикле биосинтеза лейцина и валина, который берет исходные молекулы пирувата и начинает преобразование пировиноградной кислоты в аминокислоты. Конкретный остаток, который отвечает за это, представляет собой глицин в положении 511 белка. Это тот, который требует кофактора TPP для своей функции.
За каталитическую активность этого фермента отвечают четыре специфических остатка. Они перечислены здесь с обязательными кофакторами после них.
| Остаток | Должность | Кофакторы |
|---|---|---|
| Валин | 485 | HE3 |
| Метионин | 513 | HE3 |
| Гистидин | 643 | - |
| Глицин | 511 | ТЭС |
Первичная последовательность этого белка в кресс-салате мышей приведена ниже. Остатки, участвующие в каталитической активности, выделены жирным шрифтом. Мутагенез Asp428, который является решающим карбоксилатным лигандом для Mg (2+) в «мотиве ThDP», приводит к снижению сродства AHAS II к Mg (2+). В то время как мутант D428N демонстрирует сродство к ThDP, близкое к таковому у дикого типа при насыщении Mg (2+), D428E имеет пониженное сродство к ThDP. Эти мутации также приводят к зависимости фермента от K (+). [13]
> SP | P1759 | 86-667TFISRFAPDQPRKGADILVEALERQGVETVFAYPGGASMEIHQALTRSSSIRNVLPRHEQGGVFAAEGYARSSGKPGICIATSGPGATNLVSGLADALLDSVPLVAITGQVPRRMIGTDAFQETPIVEVTRSITKHNYLVMDVEDIPRIIEEAFFLATSGRPGPVLVDVPKDIQQQLAIPNWEQAMRLPGYMSRMPKPPEDSHLEQIVRLISESKKPVLYVGGGCLNSSDELGRFVELTGIPVASTLMGLGSYPXDDELSLHMLGMHGTVYANYAVEHSDLLLAFGVRFDDRVTGKLEAFASRAKIVHIDIDSAEIGKNKTPHVSVCGDVKLALQGMNKVLENRAEELKLDFGVWRNELNVQKQKFPLSFKTFGEAIPPQYAIKVLDELTDGKAIISTG V GQHQMWAAQFYNYKKPRQWLSSGGL G М GFGLPAAIGASVANPDAIVVDIDGDGSFIMNVQELATIRVENLPVKVLLLNNQHLGMVMQWEDRFYKANRAHTFLGDPAQEDEIFPNMLLFAAACGIPAARVTKKADLREAIQTMLDTPGPYLLDVICP H QEHVLPMIPSGGTFNDVITEGDGR
Из-за торможения и нескольких факторов это медленная процедура.
Регламент [ править ]
В кресс- салате с ушами мыши две цепи каталитического ALS ( InterPro : IPR012846 ) образуют комплекс с двумя небольшими регуляторными субъединицами ( InterPro : IPR004789 ), VAT1 и At2g31810. [15] [16] Такое расположение широко распространено как в бактериальном, так и в эукариотическом БАС. Гетромерная структура была продемонстрирована у E. coli в 1984 г. и у эукариот ( S. cerevisiae и Porphyra purpurea ) в 1997 г. [17] Большинство регуляторных белков имеют домен ACT ( InterPro : IPR002912 ), а некоторые из них имеют NiKR - как C-терминал ( InterPro : IPR027271 ).
У бактерий ( E. coli ) ацетолактатсинтаза состоит из трех пар изоформ. Каждая пара включает большую субъединицу, которая, как считается, отвечает за катализ , и небольшую субъединицу за ингибирование обратной связи . Каждая пара субъединиц, или ALS I, II и III соответственно, расположена на своем собственном опероне , ilvBN, ilvGM и ilvIH (где ilvN регулирует ilvB, и наоборот). Вместе эти опероны кодируют несколько ферментов, участвующих в биосинтезе аминокислот с разветвленной цепью. Регулирование разное для каждого оперона. [18]
IlvGMEDA оперон кодирует (АЛС II) , пара ilvGM, а также с разветвленной цепью-амино-кислоты трансаминазы (ILVE), дигидрокси-дегидратаза кислоты (ilvD) и треонин аммиак-лиазы (ILVA). Он регулируется ингибированием обратной связи в форме ослабления транскрипции . То есть транскрипция снижается в присутствии конечных продуктов пути - аминокислот с разветвленной цепью.
IlvBNC оперон кодирует АЛС (I) пару IlvBN и кетола-кислоты reductoisomerase (ilvC). Он регулируется аналогичным образом, но специфичен для изолейцина и лейцина; валин не влияет на него напрямую.
Оба ilvGMEDA и ilvBNC опероны активируются во время нехватки разветвленной цепи аминокислот по тому же механизма , который репрессирует их. Оба эти оперона, а также третий, ilvIH , регулируются лейцин-чувствительным белком (Lrp). [19]
Ингибиторы [ править ]
Ингибиторы БАС используются в качестве гербицидов, которые медленно истощают пораженные растения этими аминокислотами , что в конечном итоге приводит к ингибированию синтеза ДНК. Они влияют как на травы, так и на двудольные растения. Семейство ингибиторов ALS включает сульфонилмочевину (SU), имидазолиноны , триазолопиримидины , пиримидинилоксибензоаты и сульфониламинокарбонилтриазолиноны . [20]
Клиническое значение [ править ]
CADASIL , идентифицированное аутосомно-доминантное заболевание, характеризующееся рецидивом подкорковых инфарктов, ведущих к деменции , ранее было сопоставлено с геном «ILVBL» в интервале 2 сМ, D19S226 – D19S199. Никакого события рекомбинации не наблюдалось с D19S841, высокополиморфным микросателлитным маркером, выделенным из космиды, картированной в этой области. У пациентов с CADASIL не было обнаружено мутации в этом гене, что позволяет предположить, что он не участвует в этом заболевании. [7]
Взаимодействия [ править ]
В исследовании Escherichia coli было показано , что FAD- связывающий домен ilvB взаимодействует с ilvN и активирует фермент AHAS I. [21]
Ссылки [ править ]
- ^ PDB : 1YHY ; Маккорт Дж. А., Панг С. С., Кинг-Скотт Дж., Гуддат Л. В., Дагглби Р. Г. (январь 2006 г.). «Сайты связывания гербицидов, выявленные в структуре синтазы ацетогидроксикислот растений» . Труды Национальной академии наук Соединенных Штатов Америки . 103 (3): 569–73. Bibcode : 2006PNAS..103..569M . DOI : 10.1073 / pnas.0508701103 . PMC 1334660 . PMID 16407096 .
- ^ a b c GRCh38: Ensembl, выпуск 89: ENSG00000105135 - Ensembl , май 2017 г.
- ^ a b c GRCm38: выпуск Ensembl 89: ENSMUSG00000032763 - Ensembl , май 2017 г.
- ^ "Human PubMed Reference:" . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ «Ссылка на Mouse PubMed:» . Национальный центр биотехнологической информации, Национальная медицинская библиотека США .
- ^ Чипмэн D, Barak Z, Schloss JV (июнь 1998). «Биосинтез 2-ацето-2-гидроксикислот: ацетолактатсинтазы и синтазы ацетогидроксикислот». Biochimica et Biophysica Acta (BBA) - Структура белка и молекулярная энзимология . 1385 (2): 401–19. DOI : 10.1016 / S0167-4838 (98) 00083-1 . PMID 9655946 .
- ^ a b Joutel A, Ducros A, Alamowitch S, Cruaud C, Domenga V, Maréchal E, Vahedi K, Chabriat H, Bousser MG, Tournier-Lasserve E (декабрь 1996 г.). «Человеческий гомолог бактериальных генов ацетолактатсинтазы карты в критической области CADASIL». Геномика . 38 (2): 192–8. DOI : 10.1006 / geno.1996.0615 . PMID 8954801 .
- ^ «Энтрез Ген: ILVBL ilvB (бактериальная ацетолактатсинтаза) -подобный» .
- ^ a b «Ацетолактатсинтаза, хлоропласт (P17597) <InterPro <EMBL-EBI» .
- ^ "SCOPe 2.07: Структурная классификация белков - расширенная" .
- ^ «ILV2 - каталитическая субъединица ацетолактатсинтазы, митохондриальный предшественник - Saccharomyces cerevisiae (штамм ATCC 204508 / S288c) (пекарские дрожжи) - ген и белок ILV2» . www.uniprot.org .
- ^ Дэйли FE, Кронан JE (февраль 1986). «Синтаза ацетогидроксикислоты I, необходимый фермент для биосинтеза изолейцина и валина в Escherichia coli K-12 во время роста на ацетате в качестве единственного источника углерода» . Журнал бактериологии . 165 (2): 453–60. DOI : 10.1128 / jb.165.2.453-460.1986 . PMC 214440 . PMID 3511034 .
- ↑ Бар-Илан А., Балан В., Титтманн К., Голбик Р., Вязьменский М., Хюбнер Г., Барак З., Чипман Д.М. Связывание и активация тиаминдифосфата в синтазе ацетогидроксикислот. Биохимия. 2 октября 2001 г .; 40 (39): 11946-54
- ^ «БАС - Ацетолактатсинтаза, хлоропластный предшественник - Arabidopsis thaliana (Мышиный кресс-салат) - ген и белок БАС» . www.uniprot.org .
- Перейти ↑ Chen H, Saksa K, Zhao F, Qiu J, Xiong L (август 2010). «Генетический анализ регуляции пути повышения биосинтеза аминокислот с разветвленной цепью в растениях». Заводской журнал . 63 (4): 573–83. DOI : 10.1111 / j.1365-313X.2010.04261.x . PMID 20497381 .
- ↑ Lee YT, Duggleby RG (июнь 2001 г.). «Идентификация регуляторной субъединицы синтазы ацетогидроксикислот Arabidopsis thaliana и воссоздание ее каталитической субъединицы». Биохимия . 40 (23): 6836–44. DOI : 10.1021 / bi002775q . PMID 11389597 .
- ^ Duggleby RG (май 1997). «Идентификация гена малой субъединицы ацетолактатсинтазы у двух эукариот». Джин . 190 (2): 245–9. DOI : 10.1016 / s0378-1119 (97) 00002-4 . PMID 9197540 .
- Перейти ↑ Valle J, Da Re S, Schmid S, Skurnik D, D'Ari R, Ghigo JM (январь 2008 г.). «Аминокислота валин секретируется в бактериальных биопленках с непрерывным потоком» . Журнал бактериологии . 190 (1): 264–74. DOI : 10.1128 / JB.01405-07 . PMC 2223729 . PMID 17981982 .
- ^ Кальво, JM; Мэтьюз, Р.Г. (1994). «Реагирующий на лейцин регуляторный белок, глобальный регулятор метаболизма Escherichia coli» . Микробиологические обзоры . 58 (3): 466–490. DOI : 10.1128 / mmbr.58.3.466-490.1994 . ISSN 0146-0749 .
- Перейти ↑ Zhou Q, Liu W, Zhang Y, Liu KK (октябрь 2007 г.). «Механизмы действия гербицидов, ингибирующих ацетолактатсинтазу». Биохимия и физиология пестицидов . 89 (2): 89–96. DOI : 10.1016 / j.pestbp.2007.04.004 .
- Перейти ↑ Mitra A, Sarma SP (февраль 2008 г.). «Escherichia coli ilvN взаимодействует с FAD-связывающим доменом ilvB и активирует фермент AHAS I». Биохимия . 47 (6): 1518–31. DOI : 10.1021 / bi701893b . PMID 18193896 .
Внешние ссылки [ править ]
- Ацетолактат + синтаза в медицинских предметных рубриках Национальной медицинской библиотеки США (MeSH)
- Сюжет Рамачандрана [1]
- [2] [ постоянная неработающая ссылка ]



