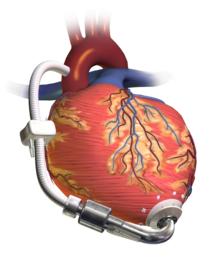
Вентрикулярное вспомогательное устройство
| Вентрикулярное вспомогательное устройство | |
|---|---|
 Вспомогательное устройство для левого желудочка (LVAD), перекачивающее кровь из левого желудочка в аорту, соединенное с внешним блоком управления и аккумуляторной батареей. | |
| МедлайнПлюс | 007268 |
Вентрикулярное вспомогательное устройство (VAD) представляет собой электромеханическое устройство для улучшения сердечного кровообращения, которое используется для частичной или полной замены функции пораженного сердца . Функция VAD отличается от функции искусственного кардиостимулятора тем, что VAD перекачивает кровь , тогда как кардиостимулятор доставляет электрические импульсы к сердечной мышце. Некоторые VAD предназначены для краткосрочного использования [1] , как правило, для пациентов, выздоравливающих после инфаркта миокарда (сердечного приступа), и для пациентов, выздоравливающих после операции на сердце ; некоторые из них предназначены для длительного использования (от месяцев до лет до бесконечности), как правило, для пациентов с далеко зашедшимисердечная недостаточность .
VAD предназначены для помощи либо правому желудочку (RVAD), либо левому желудочку (LVAD), либо обоим желудочкам (BiVAD). Тип имплантируемого VAD зависит от типа основного заболевания сердца .и на легочное артериальное сопротивление, определяющее нагрузку на правый желудочек. Вспомогательное устройство для левого желудочка (LVAD) является наиболее распространенным устройством, применяемым к пораженному сердцу (в большинстве случаев его достаточно; тогда правая сторона сердца часто может использовать сильно увеличенный кровоток), но когда сопротивление легочной артерии высокое, то может потребоваться (дополнительное) вспомогательное устройство для правого желудочка (RVAD) для решения проблемы сердечного кровообращения. Если необходимы и LVAD, и RVAD, обычно используется BiVAD, а не отдельные LVAD и RVAD.
Обычно долгосрочная ДВА используется в качестве моста к трансплантации (BTT) — поддерживая жизнь пациента и его достаточно хорошее состояние, а также возможность ожидать трансплантацию сердца вне больницы. Другие «мосты» включают мост к кандидатуре, мост к решению и мост к выздоровлению. В некоторых случаях VAD также используются в качестве целевой терапии (DT). В этом случае пациент не будет подвергаться трансплантации сердца и будет полагаться на VAD до конца своей жизни. [2] [3]
VAD отличаются от искусственных сердец , которые предназначены для выполнения функции сердца и обычно требуют удаления сердца пациента.
Дизайн
Насосы
Насосы , используемые при ДВА, можно разделить на две основные категории: пульсирующие насосы [4] , которые имитируют естественную пульсацию сердца, и насосы непрерывного действия. [5] В импульсных VAD используются поршневые насосы . [6] [7] [8] В некоторых пульсирующих помпах (использующих сжатый воздух в качестве источника энергии [9] ) объем, занимаемый кровью, изменяется во время цикла откачки. Если насос находится внутри корпуса, требуется вентиляционная трубка для наружного воздуха.
VAD с непрерывным потоком меньше по размеру и оказались более долговечными, чем VAD с пульсирующим потоком. [10] Обычно они используют либо центробежный насос , либо насос с осевым потоком . Оба типа имеют центральный ротор с постоянными магнитами. Управляемые электрические токи, проходящие через катушки, содержащиеся в корпусе насоса, воздействуют на магниты, которые, в свою очередь, заставляют роторы вращаться. В центробежных насосах роторы имеют такую форму, чтобы ускорять кровь по окружности и тем самым заставлять ее двигаться к внешнему краю насоса, тогда как в насосах с осевым потоком роторы имеют более или менее цилиндрическую форму со спиральными лопастями, что приводит к перекачиванию крови. ускоряться в направлении оси ротора. [11]
Важной проблемой насосов с непрерывным потоком является метод, используемый для подвешивания ротора. В ранних версиях использовались сплошные подшипники; однако в более новых насосах, некоторые из которых одобрены для использования в ЕС, используется либо магнитная левитация («маглев») [12] [13] [14] , либо гидродинамическая подвеска . Эти насосы содержат только одну движущуюся часть (ротор). [ нужна ссылка ]
История
Первая система вспомогательного устройства для левого желудочка (LVAD) была создана Доминго Лиоттой в Медицинском колледже Бейлора в Хьюстоне в 1962 году. Первый LVAD был имплантирован в 1963 году Лиоттой и Э. Стэнли Кроуфордом. Первая успешная имплантация LVAD была завершена в 1966 году Лиоттой вместе с доктором Майклом Э. Дебейки . Пациентка была 37-летней женщиной, и паракорпоральный (внешний) контур был в состоянии обеспечить механическую поддержку в течение 10 дней после операции. [16] Первая успешная долгосрочная имплантация LVAD была проведена в 1988 году доктором Уильямом Ф. Бернхардом из Бостонского медицинского центра детской больницы и Thermedics, Inc. в Вобурне, Массачусетс, в рамках Национального института здравоохранения.(NIH) исследовательский контракт, в рамках которого было разработано вспомогательное устройство HeartMate с электронным управлением. Это было профинансировано трехлетним контрактом на 6,2 миллиона долларов с Терапевтической и детской больницей в Бостоне, Массачусетс, с Национальным институтом сердца, легких и крови , программой Национального института здравоохранения. [17] Ранние VAD эмулировали сердце, используя «пульсирующее» действие, когда кровь попеременно всасывается насосом из левого желудочка, а затем выталкивается в аорту. Устройства такого типа включают HeartMate IP LVAS, который был одобрен для использования в США Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) в октябре 1994 года. а такжеМехмет Оз начал популяризировать идею о том, что пациенты могут жить вне больницы. Освещение в СМИ амбулаторных пациентов с VAD подчеркивало эти аргументы. [18]
Более поздние работы были сосредоточены на насосах с непрерывным потоком, которые можно грубо разделить на центробежные насосы или насосы с осевым приводом от рабочего колеса . Эти насосы имеют преимущество большей простоты, что приводит к меньшему размеру и большей надежности. Эти устройства называются VAD второго поколения. Побочным эффектом является то, что у пользователя не будет пульса [ 19] или что интенсивность пульса будет серьезно снижена. [20]
VAD третьего поколения подвешивают рабочее колесо в насосе с помощью гидродинамической или электромагнитной подвески, что устраняет необходимость в подшипниках и сокращает количество движущихся частей до одной. [ нужна ссылка ]
Еще одна технология, проходящая клинические испытания, - это использование чрескожной индукции для питания и управления устройством вместо использования чрескожных кабелей. Помимо очевидного косметического преимущества, это снижает риск заражения и, как следствие, необходимость принятия профилактических мер. Пульсирующий насос, использующий эту технологию, имеет одобрение CE Mark и проходит клинические испытания для получения одобрения FDA США. [ нужна ссылка ]
Совсем другим подходом на ранних стадиях развития было использование надувной манжеты вокруг аорты. Накачивание манжеты приводит к сужению аорты, а сдувание манжеты позволяет аорте расшириться — фактически аорта становится вторым левым желудочком. Предлагаемое усовершенствование заключается в использовании скелетных мышц пациента, приводимых в действие кардиостимулятором , для питания этого устройства, что сделает его действительно автономным. Однако подобная операция ( кардиомиопластика ) была предпринята в 1990-х годах с неутешительными результатами. В любом случае, он имеет существенные потенциальные преимущества, поскольку позволяет избежать необходимости оперировать само сердце и избегать любого контакта между кровью и устройством. Этот подход предполагает возврат к пульсирующему потоку. [ нужна ссылка ]
В свое время Питер Хоутон дольше всех выживал, получая VAD для постоянного использования. В июне 2000 года он получил экспериментальный LVAD Jarvik 2000. С тех пор он совершил благотворительную прогулку протяженностью 91 милю, опубликовал две книги, много читал лекции, путешествовал по швейцарским Альпам и американскому Западу, летал на сверхлегком самолете и путешествовал. широко по всему миру. Он умер от острой почечной недостаточности в 2007 году в возрасте 69 лет. [21] [22] С тех пор пациентка Лидия Плухар превзошла по продолжительности жизни Хоутона на VAD, получив HeartMate II в марте 2011 года в возрасте 75 лет, и в настоящее время продолжает использовать это устройство. В августе 2007 года Энтони «Тони» Мартин, практикующая медсестра (NP) и клинический руководитель программы механической поддержки кровообращения (MCS) в Ньюаркском медицинском центре Бет Исраэль, Ньюарк, Нью-Джерси, основал Международный консорциум клиницистов, помогающих кровообращению (ICCAC). ICCAC был разработан как организация 501c3, посвященная разработке передового опыта и обучению, связанному с уходом за людьми, которым требуется MCS в качестве моста к трансплантации сердца или в качестве целевой терапии для тех людей, которые не соответствуют критериям для трансплантации сердца. [23]
Исследования и результаты
Последние достижения
- В августе 2007 года Энтони «Тони» Мартин основал Международный консорциум клиницистов по оказанию помощи кровообращению (ICCAC). Практикующая медсестра (NP) и клинический руководитель программы механической поддержки кровообращения (MCS) в медицинском центре Newark Beth Israel, Ньюарк, штат Нью-Джерси.
- В июле 2009 года в Англии хирурги удалили донорское сердце, которое было имплантировано малышке рядом с ее родным сердцем после того, как ее родное сердце выздоровело. Этот метод предполагает, что механическое вспомогательное устройство, такое как LVAD, может снять часть или всю работу с нативного сердца и дать ему время для заживления. [24]
- В июле 2009 года 18-месячные результаты клинического исследования HeartMate II пришли к выводу, что LVAD с непрерывным потоком обеспечивает эффективную гемодинамическую поддержку в течение как минимум 18 месяцев у пациентов, ожидающих трансплантации, с улучшенным функциональным статусом и качеством жизни. [25]
- В июле 2009 года больница Гейдельбергского университета сообщила, что там был имплантирован первый аппарат HeartAssist5, известный как современная версия VAD Дебейки. HeartAssist5 весит 92 грамма, изготовлен из титана и пластика и служит для перекачивания крови из левого желудочка в аорту. [26]
- В настоящее время проводится фаза 1 клинических испытаний (по состоянию на август 2009 г.), в которую входят пациенты с аортокоронарным шунтированием и пациенты с терминальной стадией сердечной недостаточности, у которых есть вспомогательное устройство для левого желудочка. Испытание включает тестирование пластыря под названием Anginera, который содержит клетки, секретирующие гормоноподобные факторы роста, стимулирующие рост других клеток. Пластыри засеиваются клетками сердечной мышцы, а затем имплантируются в сердце с целью заставить мышечные клетки начать общаться с нативными тканями таким образом, чтобы обеспечить регулярные сокращения. [27] [28]
- В сентябре 2009 года новозеландское новостное агентство Stuff сообщило, что еще через 18 месяцев или два года будет готово к клиническим испытаниям новое беспроводное устройство, которое будет питать VAD без прямого контакта. В случае успеха это может снизить вероятность заражения в результате прохождения кабеля питания через кожу. [29]
- Национальные институты здравоохранения (NIH) предоставили грант в размере 2,8 миллиона долларов на разработку полностью искусственного сердца без пульса с использованием двух VAD компании Micromed , первоначально созданной Майклом Дебейки и Джорджем Нуном . Грант был продлен на второй год исследований в августе 2009 года. Полное искусственное сердце было создано с использованием двух VAD HeartAssist5, при этом один VAD перекачивает кровь по всему телу, а другой обеспечивает циркуляцию крови в легких и из них. [30]
- HeartWare International объявила в августе 2009 года, что она превзошла 50 имплантатов своей системы HeartWare Ventricular Assist System в своем клиническом испытании ADVANCE, одобренном FDA, исследовании IDE. Исследование предназначено для оценки системы в качестве моста к трансплантации для пациентов с сердечной недостаточностью в терминальной стадии. Исследование «Оценка системы HeartWare LVAD для лечения прогрессирующей сердечной недостаточности» представляет собой многоцентровое исследование, которое началось в мае 2009 г. [31] [32] .
- 27 июня 2014 года Ганноверская медицинская школа в Ганновере, Германия, провела первый человеческий имплантат HeartMate III под руководством профессора Акселя Хавериха, доктора медицины, заведующего отделением кардиоторакальной, трансплантационной и сосудистой хирургии, и хирурга Яна Шмитто, доктора медицины, доктора философии [33] .
- 21 января 2015 года в Журнале Американского колледжа кардиологов было опубликовано исследование, в котором предполагалось, что длительное использование LVAD может вызывать регенерацию сердца. [34] Это может объяснить явление моста к восстановлению, впервые описанное группой Якуба в NEJM в 2009 году (см. выше). [ нужна ссылка ]
- Член Зала славы бейсболиста Род Кэрью страдал застойной сердечной недостаточностью и был оснащен устройством HeartMate II. Он боролся с ношением оборудования, поэтому он объединил усилия, чтобы помочь поставить наиболее полезную одежду, чтобы помочь HeartMate II и HeartMate III. [35]
- В декабре 2018 года в Казахстане было проведено два клинических случая, и людям была имплантирована полностью беспроводная система LVAD в сочетании Jarvik 2000 с Leviticus Cardio FiVAD (Fully Implantable Ventricular Assist Device). Технология беспроводной передачи энергии основана на методе, называемом копланарной передачей энергии (CET), который способен передавать энергию от внешней передающей катушки к небольшой принимающей катушке, имплантированной в тело человека. В ранней послеоперационной фазе операция CET была выполнена, как и ожидалось, у обоих пациентов, которая включала помпу и поддерживала аккумулятор заряженным, чтобы можно было проводить медицинские и сестринские процедуры. Левит КардиоСистема FiVAD с беспроводной копланарной технологией передачи энергии, которая снижает риск заражения за счет устранения трансмиссии, обеспечивая при этом успешную передачу энергии, что позволяет существенно (приблизительно 6 часов) поддерживать LVAD без кобуры. [36]
- 3 июня 2021 г. компания Medtronic выпустила срочное уведомление о медицинских устройствах, в котором говорилось, что их устройства HVAD больше не следует имплантировать из-за более высоких показателей неврологических событий и смертности при использовании HVAD по сравнению с другими доступными устройствами [37] .
Большинство VAD на рынке сегодня несколько громоздки. Самое маленькое устройство, одобренное FDA, HeartMate II, весит около 1 фунта (0,45 кг) и имеет размеры 3 дюйма (7,6 см). Это оказалось особенно важным для женщин и детей, для которых альтернативы были бы слишком велики. [38] По состоянию на 2017 год HeartMate III был одобрен FDA. Он меньше, чем его предшественник HeartMate II, и использует рабочее колесо на магнитной подвеске вместо системы чашечно-шаровых подшипников, как в HeartMate II. [39]
Одно устройство, VentrAssist, получило одобрение CE Mark для использования в ЕС и начало клинические испытания в США. По состоянию на июнь 2007 года эти помпы были имплантированы более чем 100 пациентам. В 2009 году Ventracor был передан в руки администраторов из-за финансовых проблем и позже в том же году был ликвидирован. Никакие другие компании не приобрели эту технологию, поэтому устройство VentrAssist фактически прекратило свое существование. По состоянию на январь 2010 г. около 30–50 пациентов во всем мире продолжают пользоваться устройствами VentrAssist .
HeartWare HVAD работает аналогично VentrAssist, хотя и намного меньше и не требует имплантации брюшного кармана. Устройство получило маркировку CE в Европе и одобрение FDA в США. HeartWare HVAD можно было имплантировать через ограниченный доступ без стернотомии , однако в 2021 году компания Medtronic прекратила выпуск устройства. [40] [37]
В небольшом числе случаев вспомогательные устройства для левого желудочка в сочетании с медикаментозной терапией позволили сердцу достаточно восстановиться, чтобы устройство можно было удалить ( эксплантировать ). [2] [3]
Базовое исследование HeartMate II LVAD
Серия исследований, связанных с использованием HeartMate II LVAD, оказалась полезной для установления жизнеспособности и рисков использования LVAD для переходной терапии к трансплантации и целевой терапии.
- Пилотное испытание HeartMate II LVAD началось в ноябре 2003 г. и включало 46 пациентов в 15 центрах. Результаты включали 11 пациентов с поддержкой более одного года и трех пациентов с поддержкой более двух лет. [ нужна ссылка ]
- Базовое исследование HeartMate II началось в 2005 году и включало оценку HeartMate II по двум показаниям: мост к трансплантации (BTT) и целевая терапия (DT) или долгосрочная постоянная поддержка. Thoratec Corp. объявила, что FDA впервые одобрило клиническое испытание, включающее оба показания в один протокол. [41] [42] [43]
- Многоцентровое исследование, проведенное в США с 2005 по 2007 год с участием 113 пациентов (из которых 100 сообщили об основных исходах), показало, что значительное улучшение функции преобладало через три месяца, а выживаемость составила 68% через двенадцать месяцев. [44]
- Основываясь на годичных данных наблюдения за первыми 194 пациентами, включенными в исследование, FDA одобрило HeartMate II для мостовидной трансплантации. Испытание предоставило клинические доказательства улучшения показателей выживаемости и качества жизни для широкого круга пациентов. [45] [46]
- Данные 18-месячного наблюдения за 281 пациентом, которые либо достигли конечной точки исследования, либо завершили 18-месячное послеоперационное наблюдение, показали улучшенную выживаемость, менее частые побочные эффекты и большую надежность при использовании LVADS с непрерывным потоком по сравнению с устройствами с пульсирующим потоком. Из 281 пациента 157 пациентов перенесли трансплантацию, 58 пациентов продолжали иметь LVAD в своем организме, а у семи пациентов LVAD был удален, потому что их сердце восстановилось; остальные 56 умерли. Результаты показали, что класс пациентов по NYHAсердечной недостаточности значительно улучшились после шести месяцев поддержки LVAD по сравнению с исходным уровнем до LVAD. Несмотря на то, что в этом испытании использовались показания моста к трансплантации, результаты дают ранние доказательства того, что LVAD с непрерывным потоком имеют преимущества с точки зрения долговечности и надежности для пациентов, получающих механическую поддержку для целевой терапии. [47]
- После одобрения Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов (FDA) устройства HeartMate II LVAD в качестве моста к трансплантации было проведено послерегистрационное («регистрационное») исследование для оценки эффективности устройства в коммерческих условиях. Исследование показало, что устройство улучшило результаты как по сравнению с другими методами лечения LVAD, так и с исходными пациентами. В частности, пациенты HeartMate II показали более низкие уровни креатинина, 30-дневная выживаемость была значительно выше — 96%, и 93% достигли успешных результатов (трансплантация, восстановление сердца или долгосрочная LVAD). [48]
АРФЫ
Harefield Recovery Protocol Study (HARPS) — это клиническое исследование, целью которого является оценка того, могут ли пациенты с прогрессирующей сердечной недостаточностью, нуждающиеся в поддержке VAD, восстановить достаточную функцию миокарда, чтобы можно было удалить устройство (известное как эксплантация). HARPS сочетает в себе LVAD (HeartMate XVE) с обычными пероральными препаратами от сердечной недостаточности, за которыми следует новый агонист β2 кленбутерол . Это открывает возможность того, что некоторые пациенты с прогрессирующей сердечной недостаточностью могут отказаться от трансплантации сердца. [49]
На сегодняшний день 73% (11 из 15) пациентов, прошедших комбинированную терапию, продемонстрировали достаточное восстановление, позволяющее провести эксплантацию и избежать трансплантации сердца; свобода от рецидива сердечной недостаточности у выживших пациентов составила 100% и 89% через 1 и 4 года после эксплантации соответственно; средняя фракция выброса составила 64% через 59 мес после эксплантации; все пациенты относились к классу I по NYHA, и при терапии кленбутеролом не сообщалось о каких-либо значительных побочных эффектах. [ нужна ссылка ]
РЕМАТЧ
Клинические испытания REMATCH (рандомизированная оценка механической помощи при лечении застойной сердечной недостаточности) начались в мае 1998 г. и продолжались до июля 2001 г. в 20 центрах трансплантации сердца в США. Исследование было разработано для сравнения долгосрочной имплантации вспомогательных устройств для левого желудочка с оптимальным медицинским ведением пациентов с сердечной недостаточностью в терминальной стадии, которые нуждаются в трансплантации сердца, но не имеют права на нее. В результате клинических результатов устройство получило одобрение FDA для обоих показаний в 2001 и 2003 годах соответственно. [50]
Исследование продемонстрировало улучшение двухлетней выживаемости на 81% среди пациентов, получавших HeartMate XVE, по сравнению с оптимальным медикаментозным лечением. Кроме того, исследование целевой терапии после исследования REMATCH продемонстрировало дополнительное улучшение на 17 % (61 % против 52 %) годовой выживаемости пациентов, которым был имплантирован VAD (HeartMate XVE), что требует соответствующего выбора. кандидатов и сроки имплантации VAD. [ нужна ссылка ]
Тест, проведенный в 2001 году доктором Эриком А. Роузом и исследовательской группой REMATCH с пациентами с застойной сердечной недостаточностью, которым не была показана трансплантация, показал, что двухлетняя выживаемость составляет 23% для тех, кому имплантировали LVAD, по сравнению с 8% для тех, кто которых лечили наркотиками. Двумя основными осложнениями имплантации VAD были инфекция и механическая поломка .
Согласно ретроспективному когортному исследованию, в котором сравнивали пациентов, получавших вспомогательное устройство для левого желудочка, и пациентов, получавших инотропную терапию, в ожидании трансплантации сердца, в группе, получавшей LVAD, на момент трансплантации наблюдалось улучшение клинической и метаболической функции с улучшением артериального давления, натрия, азота мочевины в крови, и креатинин. После трансплантации у 57,7% группы инотропной терапии развилась почечная недостаточность по сравнению с 16,6% в группе LVAD; 31,6% в группе инотропов имели правожелудочковую недостаточность по сравнению с 5,6% в группе LVAD; а бессобытийная выживаемость составила 15,8% в группе инотропов по сравнению с 55,6% в группе LVAD. [51]
Осложнения и побочные эффекты
Кровотечение является наиболее частым послеоперационным ранним осложнением после имплантации или эксплантации LVAD, что требует повторной операции у 60% реципиентов. [52] [53] Последствия массивных переливаний крови велики и включают инфекцию, легочную недостаточность, увеличение расходов, правожелудочковую недостаточность, аллосенсибилизацию и передачу вируса, некоторые из которых могут привести к летальному исходу или предотвратить трансплантацию. [53] Когда происходит кровотечение, оно влияет на годовую смертность Каплана-Мейера. [52] В дополнение к сложности популяции пациентов и сложности этих процедур, способствующих кровотечению, сами устройства могут способствовать тяжелой коагулопатии, которая может возникнуть при имплантации этих устройств. [54]
Поскольку устройства обычно приводят к течению крови по небиологической поверхности, предрасполагая кровь к свертыванию , необходимы меры по предотвращению свертывания крови. Одно устройство, HeartMate XVE, имеет биологическую поверхность, полученную из фибрина , и не требует длительной антикоагулянтной терапии (за исключением аспирина); к сожалению, эта биологическая поверхность может также предрасполагать пациента к инфекции за счет избирательного снижения определенных типов лейкоцитов. [55]
Новые конструкции VAD, которые в настоящее время одобрены для использования в Европейском сообществе и проходят испытания для одобрения FDA, почти полностью устранили механические неисправности. [ нужна ссылка ]
Трудно измерить артериальное давление у пациентов с LVAD с помощью стандартного мониторинга артериального давления, и в настоящее время практика заключается в измерении с помощью ультразвуковой допплерографии у амбулаторных пациентов и инвазивного мониторинга артериального давления у стационарных пациентов . [56]
Инфекция, связанная с VAD, может быть вызвана большим количеством различных организмов: [57]
- Грамположительные бактерии ( стафилококки , особенно Staph. aureus , энтерококки )
- Грамотрицательные бактерии ( Pseudomonas aeruginosa , виды Enterobacter , виды Klebsiella )
- Грибы, особенно виды Candida
Лечение инфекции, связанной с ДВА, чрезвычайно сложно, и многие пациенты умирают от инфекции, несмотря на оптимальное лечение. Первоначальное лечение должно проводиться антибиотиками широкого спектра действия, но необходимо приложить все усилия для получения соответствующих образцов для посева. Окончательное решение относительно антибактериальной терапии должно быть основано на результатах микробиологических посевов. [ нужна ссылка ]
Другие проблемы включают иммуносупрессию , свертывание крови с последующим инсультом и кровотечение, вторичное по отношению к антикоагулянтам. Некоторые полиуретановые компоненты, используемые в устройствах, вызывают делецию части иммунных клеток при контакте с ними крови. Это предрасполагает пациента к грибковым и некоторым вирусным инфекциям, требующим соответствующей профилактической терапии . [58]
Учитывая множество рисков и модификаций образа жизни, связанных с имплантацией вспомогательного желудочкового устройства [59] , важно, чтобы потенциальные пациенты были проинформированы до принятия решения. [60] Помимо консультаций с врачами, для помощи в обучении пациентов доступны различные интернет-ресурсы, предназначенные для пациентов. [61] [62]
Список имплантируемых устройств VAD
Этот раздел необходимо обновить . ( апрель 2015 г. ) |
Это неполный список и, возможно, никогда не будет полным.
Ссылки на дополнения приветствуются .
| Устройство | Производитель | Тип | Статус утверждения по состоянию на июль 2010 г. |
|---|---|---|---|
| HeartAssist5 | ReliantHeart | Непрерывный поток, приводимый в движение осевым ротором. | Одобрено для использования в Европейском Союзе. Детская версия одобрена FDA для использования у детей в США. Проходит клинические испытания в США для одобрения FDA. |
| Новакор | Сердце Мира | Пульсирующий. | Был одобрен для использования в Северной Америке, Европейском Союзе и Японии. Сейчас не существует и больше не поддерживается производителем. (Приобретение HeartWare завершено в августе 2012 г.) |
| HeartMate XVE | Торатек | пульсирующий | Одобрено FDA для BTT в 2001 г. и DT в 2003 г. Маркировка CE разрешена. Редко используется больше из-за проблем с надежностью. |
| Друг Сердца II | Торатек | Непрерывный осевой поток с приводом от ротора, шариковые и наружные подшипники. | Одобрено для использования в Северной Америке и ЕС. Маркировка CE авторизована. Одобрение FDA для BTT в апреле 2008 г. Недавно одобрено FDA в США для целевой терапии (по состоянию на январь 2010 г.). |
| Друг Сердца III | Торатек | Непрерывный поток, приводимый в движение осевым ротором на магнитной подвеске. | Основные испытания HeartMate III начались в 2014 году при поддержке CarewMedicalWear . Одобрение FDA для BTT в 2017 г. |
| Инкор | Берлинское сердце | Непрерывный поток, приводимый в движение осевым ротором на магнитной подвеске. | Одобрено для использования в Европейском Союзе. Используется при гуманитарном разрешении в каждом конкретном случае в США. Вступил в клинические испытания в США в 2009 году. |
| Экскор Педиатр | Берлинское сердце | Наружное мембранное насосное устройство, предназначенное для детей. | Одобрено для использования в Европейском Союзе. FDA предоставило США исключение для гуманитарных устройств в декабре 2011 года. |
| Ярвик 2000 | Ярвик Харт | Непрерывный поток, осевой ротор, поддерживаемый керамическими подшипниками. | В настоящее время используется в Соединенных Штатах в качестве моста к пересадке сердца в рамках клинического исследования, одобренного FDA. В Европе Jarvik 2000 получил сертификат CE Mark как для мостовидного протеза, так и для использования в течение всего срока службы. В настоящее время разрабатывается детская версия. |
| Микромед Дебейки VAD | МикроМед | Непрерывный поток приводится в движение осевым ротором, поддерживаемым керамическими подшипниками. | Одобрено для использования в Европейском Союзе. Детская версия одобрена FDA для использования у детей в США. Проходит клинические испытания в США для одобрения FDA. |
| Вентрассист | Вентракор [63] | Непрерывный поток, приводимый в движение центробежным ротором с гидродинамической подвеской. | Одобрено для использования в Европейском Союзе и Австралии. Компания объявлена банкротом, когда в 2009 году шли клинические испытания для одобрения FDA. В настоящее время компания распущена, а интеллектуальная собственность продана Thoratec. |
| MTIHeartLVAD | www.mitiheart.com | Непрерывный поток, приводимый в движение центробежным ротором на магнитной подвеске. | В настоящее время проходит испытания на животных, недавно был успешно завершен 60-дневный имплант теленка. |
| C-Pulse (теперь «Аквадекс») | Солнечное сердце (теперь «Решения CHF») | Пульсирующий, приводимый в движение надувной манжетой вокруг аорты. | В настоящее время доступно в продаже |
| HVAD | HeartWare (сейчас Medtronic ) | Миниатюрный аппарат «третьего поколения» с центробежным кровотоком и ротором на гидромагнитной подвеске, который можно разместить в перикардиальном пространстве. | Получен знак CE для распространения в Европе, январь 2009 г. Получено одобрение FDA в США, ноябрь 2012 г. Испытание BTT в США начато в октябре 2008 г. (завершено в феврале 2010 г.) и испытание DT в США в августе 2010 г. (регистрация завершена в мае 2012 г.). Одобрение FDA для BTT в 2012 г. и DT в 2017 г. Снят с рынка в июне 2021 г. [64] |
| МВД | HeartWare | Помпа MVAD компании HeartWare представляет собой миниатюрное устройство поддержки желудочков, находящееся на стадии разработки, примерно в три раза меньше помпы HVAD компании HeartWare. | HeartWare завершила исследования GLP (сентябрь 2011 г.). |
| твердая сердцевина | Тэрумо | Центробежный насос на магнитной подвеске. | Одобрен CE, по состоянию на январь 2010 г. проводятся испытания FDA США. |
| Thoratec PVAD (паракорпоральное вспомогательное устройство для работы желудочков) | Торатек | Пульсирующая система включает три основных компонента: насос для крови, канюли и пневматический привод (консоль с двойным приводом или портативный привод VAD). | Маркировка CE авторизована. Получено одобрение FDA для BTT в 1995 году и для восстановления после кардиотомии (операция на открытом сердце) в 1998 году. |
| IVAD — имплантируемое вспомогательное устройство для желудочков | Торатек | Пульсирующая система включает три основных компонента: насос для крови, канюли и пневматический привод (консоль с двойным приводом или портативный привод VAD). | Маркировка CE авторизована. Получено одобрение FDA для BTT в 2004 году. Разрешено только для внутренних имплантатов, а не для паракорпоральных имплантатов из-за проблем с надежностью. |
| ФиВАД | Левит Кардио | Универсальная беспроводная система для LVAD. Дайте пациентам 6 часов свободы | Исследовательский прибор, испытание 2 пациентов, проведенное в декабре 2018 г. с Jarvik 2000 LVAD в Астане проф. Пя. [36] |
Смотрите также
- Внутриаортальная баллонная контрпульсация
использованная литература
- ^ Сеф, Д; Мохите, П; Де Робертис, Ф; Верзеллони Сеф, А; Махеш, Б; шток, У; Саймон, А. (сентябрь 2020 г.). «Мост к трансплантации сердца с использованием устройства краткосрочной поддержки желудочков Levitronix CentriMag». Искусственные органы . 44 (9): 1006–1008. doi : 10.1111/aor.13709 . PMID 32367538 . S2CID 218506853 .
- ^ б Биркс , EJ; Тэнсли, PD; Харди, Дж.; и другие. (2006). «Вспомогательное устройство для левого желудочка и лекарственная терапия для купирования сердечной недостаточности». Медицинский журнал Новой Англии . 355 (18): 1873–1884. doi : 10.1056/NEJMoa053063 . PMID 17079761 .
- ^ a b "Первое восстановление сердца VentrAssist, показанное на национальном телевидении" . Вентракор.com . 19 октября 2006 г.
- ^ Файдек, Б; Кшиштоф, Дж. (2–5 сентября 2014 г.). «Автоматическая система управления вспомогательным желудочковым устройством». 19-я Международная конференция по методам и моделям в автоматизации и робототехнике (MMAR) : 874–879. doi : 10.1109/MMAR.2014.6957472 . ISBN 978-1-4799-5081-2. S2CID 13070912 .
- ^ Шульман, А.Р.; Мартенс, Т.П.; Христос, П.Дж.; и другие. (2007). «Сравнение инфекционных осложнений между вспомогательными устройствами для левого желудочка с непрерывным и пульсирующим потоком» . Журнал торакальной и сердечно-сосудистой хирургии . 133 (3): 841–842. doi : 10.1016/j.jtcvs.2006.09.083 . PMID 17320612 .
- ^ «Панель A показывает пульсирующий поток первого поколения слева ve - Open-i» . openi.nlm.nih.gov . Проверено 23 апреля 2018 г.
- ^ "Страница 404 не найдена" . ResearchGate . Проверено 23 апреля 2018 г.
{{cite web}}: Cite использует общий заголовок ( помощь ) - ^ «Компоненты пульсирующего насоса SynCardia TAH» (PDF) . Syncardia.com . Проверено 23 апреля 2018 г.
- ^ «У HeartMate XVE тоже есть вентиляционная линия, несмотря на то, что он питается от батареи» (PDF) . aldmd.com . Проверено 23 апреля 2018 г.
- ^ Слотер, Массачусетс; Пагани, Ф.Д.; Роджерс, Дж. Г.; и другие. (2010). «Клиническое лечение вспомогательных устройств левого желудочка с непрерывным потоком при прогрессирующей сердечной недостаточности». Журнал трансплантации сердца и легких . 29 (4): С1–39. doi : 10.1016/j.healun.2010.01.011 . PMID 20181499 .
- ^ Фукамачи, Киё; Смедира, Николай (август 2005 г.). «Меньше, безопаснее, полностью имплантируемые LVAD: факт или фантазия?». Текущий обзор журнала ACC . 14 (8): 40–42. doi : 10.1016/j.accreview.2005.06.001 .
- ^ Умный, Фрэнк. «Магнитно-левитационный сердечный насос имплантирован первому пациенту в США» . «Кардиология сегодня». октябрь 2008 г.
- ^ Пай, Китай; Шинши, Т; Асама, Дж.; и другие. (2008). «Разработка компактного центробежного насоса для крови на маглеве, заключенного в титановый корпус» . Журнал передового механического проектирования, систем и производства . 2 (3): 343–355. Бибкод : 2008JAMDS...2..343P . doi : 10.1299/jamdsm.2.343 .
- ^ Хоши, Х; Шинши, Т; Такатани, С. (2006). «Кровавые насосы третьего поколения с механическими бесконтактными магнитными подшипниками». Искусственные органы . 30 (5): 324–338. doi : 10.1111/j.1525-1594.2006.00222.x . PMID 16683949 .
- ^ «Доктор Дентон Кули и доктор Майкл Э. Дебейки: рок-звезды хьюстонской медицины» . Хьюстон Хроникл . 3 апреля 2014 г.
- ^ Кирклин, Дж. К.; Нафтель, округ Колумбия (сентябрь 2008 г.). «Механическая поддержка кровообращения: регистрация терапии в эволюции» . Циркуляция: сердечная недостаточность . 1 (3): 200–5. doi : 10.1161/circheartfailure.108.782599 . ПВК 3437761 . PMID 19808290 .
- ^ «Объявлен прогресс сердечного насоса - многообещающий шаг в технологии искусственного сердца» . Детский день (март): 1,5. 19 марта 1988 г.
- ^ Электрическое сердце . ПБС.
- ^ Дэн Баум. «Нет пульса: как врачи заново изобрели человеческое сердце» . Популярная наука. 2012.
- ^ "Часто задаваемые вопросы о VAD" . Медицинский центр Колумбийского университета. цитата: «У пациента, которому имплантирован HeartMate II, пульс обычно ослаблен». Просмотрено 27 августа 2016 г.
- ^ «Первый пациент с пожизненным использованием» . Ярвик Харт. Архивировано из оригинала 21 ноября 2010 г.
- ^ Пациент устанавливает мировой рекорд по проживанию с устройством для помощи при сердечно-сосудистых заболеваниях . Техасский институт сердца. 6 июля 2007 г.
- Викискладе есть медиафайлы по теме ICCAC .
- ↑ Мо, Томас (14 июля 2009 г.). «Трансплантат показывает репаративные возможности сердца» . Лос-Анджелес Таймс .
- ^ Пагани, Ф.Д.; Миллер, Л.В.; Рассел, SD; и другие. (2009). «Расширенная механическая поддержка кровообращения с помощью вращающегося вспомогательного устройства для левого желудочка с непрерывным потоком» . Журнал Американского колледжа кардиологов . 54 (4): 312–321. doi : 10.1016/j.jacc.2009.03.055 . PMID 19608028 .
- ^ «Кардиохирурги Гейдельберга имплантируют первое в мире новое устройство DeBakey Heart Assist» . Науки . 17 августа 2009 г. Архивировано из оригинала 18 июля 2011 г.
- ↑ Куинн, Дейл (4 августа 2009 г.). «Исследование VA: пластырь для лечения сердца» . Аризона Дейли Стар . Архивировано из оригинала 7 августа 2009 года.
- ^ «Исследование ангинеры у пациентов, перенесших операцию аортокоронарного шунтирования (АКШ)» . ClinicalTrials.gov . Национальные институты здоровья США. 27 марта 2009 г. . Проверено 15 сентября 2009 г.
- ↑ Хантер, Тим (13 сентября 2009 г.). «Познакомьтесь с бионическим человеком киви» . Стандарт Манавату .
- ^ «Продлен грант в размере 2,8 миллиона долларов на разработку тотального искусственного сердца без пульса» . БизнесВайр . 6 августа 2009 г.
- ^ «Оценка системы HeartWare LVAD для лечения прогрессирующей сердечной недостаточности» . Медицинский центр Джонса Хопкинса . май 2009 г.
- ^ «HeartWare International превосходит 50 имплантатов в США» . Биомедицина . 20 августа 2009 г.
- ^ «Thoratec объявляет о первом человеческом имплантате HeartMate III и начале испытания маркировки CE» . Корпорация Торатек. 20 августа 2009 г. Архивировано из оригинала 7 октября 2014 г.
- ^ Кансеко, Дайана С .; Кимура, Ватару; Гарг, Соня; Мукерджи, Шибани; Бхаттачарья, Супарно; Абдисалаам, Салим; Дас, Сандип; Асайтамби, Арумугаме; Маммен, Прадип, Пенсильвания; Садек, Хешам А. (2015). «Разгрузка желудочков человека вызывает пролиферацию кардиомиоцитов» . Журнал Американского колледжа кардиологов . 65 (9): 892–900. doi : 10.1016/j.jacc.2014.12.027 . ПВК 4488905 . PMID 25618530 .
- ^ "Одежда LVAD" . www.carewmedicalwear.com .
- ^ a b «Первое использование человеком беспроводной копланарной передачи энергии в сочетании с устройством поддержки левого желудочка с непрерывным потоком» . Трансплантация сердца и легких. 4 февраля 2019 г.
- ↑ a b Нджоку, Ннамди (3 июня 2021 г.). «Срочное сообщение о медицинском устройстве: Письмо-уведомление Medtronic HVAD™ System» (PDF) . Проверено 30 сентября 2021 г.
{{cite web}}: CS1 maint: URL-статус ( ссылка ) - ^ Богаев, Р; Чен, Л; Рассел, SD; и другие. (2007). «Медицинские аспекты сердечной недостаточности на конечной стадии: трансплантация и терапия устройствами I, реферат 1762: новый вариант для женщин с сердечной недостаточностью на поздних стадиях: результаты испытания моста вспомогательного устройства левого желудочка HeartMate II с непрерывным потоком для трансплантации» . Тираж . II. Американская Ассоциация Сердца. 116 : 372. Архивировано из оригинала 8 июня 2011 г.
- ^ https://www.thoratec.com/medical-professionals/vad-product-information/heartmate3/HeartMate3_PressKit-UK.pdf [ мертвая ссылка ]
- ^ Попов, А.Ф.; Хоссейни, Монтана; Зыч, Б; и другие. (2012). «Имплантация вспомогательного устройства левого желудочка HeartWare посредством двусторонней передней торакотомии». Анналы торакальной хирургии . 93 (2): 674–676. doi : 10.1016/j.athoracsur.2011.09.055 . PMID 22269746 .
- ↑ Бентон, Сьюзен (19 августа 2008 г.). «Информационный бюллетень основного клинического испытания HeartMate II» (PDF) . Корпорация Торатек . Проверено 10 сентября 2009 г.
- ↑ Дьюи, Тодд (19 августа 2008 г.). «Основное испытание HeartMate II LVAS» . Кардиопульмонологический научно-технический институт. Архивировано из оригинала 13 июля 2007 года.
- ↑ Магер, Белинда (25 апреля 2008 г.). «FDA одобряет механический сердечный насос HeartMate II для пациентов с сердечной недостаточностью, ожидающих трансплантации органов» . Нью-Йоркская пресвитерианская больница . Архивировано из оригинала 8 мая 2008 года.
- ^ Миллер, Л.В.; Пагани, Ф.Д.; Рассел, SD; и другие. (2007). «Использование устройства непрерывного потока у пациентов, ожидающих трансплантации сердца». Медицинский журнал Новой Англии . 357 (9): 885–896. doi : 10.1056/NEJMoa067758 . PMID 17761592 .
- ↑ Гэвин, Кара (23 апреля 2008 г.). «Впечатляющие времена для устройств, помогающих работе сердца, в UM» . Система здравоохранения Мичиганского университета. Архивировано из оригинала 10 мая 2008 г.
- ^ "Thoratec HeartMate II LVAS - P060040" . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов . 23 апреля 2008 г. . Проверено 28 августа 2009 г.
- ^ Эйзен, Х.Дж.; Хэнкинс, С.Р. (2009). «Вращающееся вспомогательное устройство для левого желудочка с непрерывным потоком» . Журнал Американского колледжа кардиологов . 54 (4): 322–324. doi : 10.1016/j.jacc.2009.04.028 . PMID 19608029 .
- ^ Старлинг, RC; Нака, Ю; Бойл, Эй Джей; и другие. (август 2009 г.). «Результаты первоначального исследования FDA после утверждения реестра INTERMACS с помощью вспомогательного устройства для левого желудочка с непрерывным потоком в качестве моста к трансплантации сердца» . Журнал сердечной недостаточности . 15 (6): с46. doi : 10.1016/j.cardfail.2009.06.252 .
- ^ Миллер, Лесли; Ааронсон и Пагани (2008). «Исследование протокола восстановления Хэрфилда для пациентов с рефрактерной хронической сердечной недостаточностью (HARPS)» . ClinicalTrials.gov . Проверено 3 августа 2009 г.
- ^ Роуз, EA; Московиц, А.Дж.; Пакер, М.; и другие. (1999). «Испытание REMATCH: обоснование, дизайн и конечные точки. Рандомизированная оценка механической помощи при лечении застойной сердечной недостаточности». Анналы торакальной хирургии . 67 (3): 723–730. doi : 10.1016/S0003-4975(99)00042-9 . PMID 10215217 .
- ^ Роджерс, Дж. Г.; Батлер, Дж.; Лансман, С.Л.; и другие. (2007). «Хроническая механическая поддержка кровообращения у пациентов с инотропно-зависимой сердечной недостаточностью, которые не являются кандидатами на трансплантацию» . Журнал Американского колледжа кардиологов . 50 (8): 741–747. doi : 10.1016/j.jacc.2007.03.063 . PMID 17707178 .
- ^ б Шаффер, Дж . М.; Арнаутакис, Г.Дж.; Аллен, JG; и другие. (2011). «Осложнения кровотечения и использование продуктов крови при имплантации вспомогательного устройства левого желудочка». Анналы торакальной хирургии . 91 (3): 740–749. doi : 10.1016/j.athoracsur.2010.11.007 . PMID 21352991 .
- ^ б Гольдштейн, Дэниел Дж . ; Роберт Б. Бофорд (2003). «Вспомогательные устройства левого желудочка и кровотечение: добавление оскорбления к травме». Анналы торакальной хирургии . 75 (6): С42–7. doi : 10.1016/s0003-4975(03)00478-8 . PMID 12820734 .
- ^ Спаниер, Талия; Оз, М; Левин, Х; и другие. (1996). «Активация путей коагуляции и фибринолиза вспомогательными устройствами для левого желудочка» . Журнал торакальной и сердечно-сосудистой хирургии . 112 (4): 1090–1097. doi : 10.1016/s0022-5223(96)70111-3 . PMID 8873737 .
- ^ Сэмюэлс, LE; Кохут, Дж.; Казанова-Гош, Э; и другие. (2008). «Аргатробан как первичный или вторичный послеоперационный антикоагулянт у пациентов, которым имплантированы вспомогательные желудочковые устройства». Анналы торакальной хирургии . 85 (5): 1651–1655. doi : 10.1016/j.athoracsur.2008.01.100 . PMID 18442558 .
- ^ Кастанья, Франческо; Штер, Эрик Дж .; Пинсино, Альберто; Кокрофт, Джон Р.; Уилли, Джошуа; Решад Гаран, А .; Топкара, Вели К.; Коломбо, Паоло К.; Юзефпольская, Мелана; Макдоннелл, Барри Дж. (2017). «Уникальные показатели артериального давления и пульса у пациентов с LVAD: текущие проблемы и будущие возможности» . Текущие отчеты о гипертонии . 19 (10): 85. doi : 10.1007/s11906-017-0782-6 . ISSN 1522-6417 . ПМС 5645430 . PMID 29043581 .
- ^ Гордон, Р.Дж.; Квальярелло, Б; Лоуи, Ф.Д. (2006). «Инфекции, связанные с вспомогательным желудочковым устройством». Ланцет Инфекционные заболевания . 6 (7): 426–37. doi : 10.1016/S1473-3099(06)70522-9 . PMID 16790383 .
- ^ Холман, WL; Рейберн, БК; Макгиффин, округ Колумбия; и другие. (2003). «Инфекция в вспомогательных желудочковых устройствах: профилактика и лечение». Анналы торакальной хирургии . 75 (6 Дополнение): S48–S57. doi : 10.1016/S0003-4975(03)00479-X . PMID 12820735 .
- ^ Маркуччилли, Л; Касида, Дж.; Питерс, Р. М. (2013). «Модификация самооценки у пациентов с вспомогательным устройством для левого желудочка: начальное исследование» (PDF) . Журнал клинического ухода . 22 (2456–64): 2456–64. doi : 10.1111/j.1365-2702.2012.04332.x . hdl : 2027.42/99069 . PMID 23506318 .
- ^ Макиллвеннан, CK; Аллен, Луизиана; Новелс, К.; Брике, А; Кливленд, JC; Мэтлок, Д. Д. (2014). «Принятие решения о назначении терапии вспомогательными устройствами для левого желудочка: «не было выбора» против «я очень много думал об этом»" . Циркуляция: качество сердечно-сосудистой системы и исходы . 7 (3): 374–80. doi : 10.1161 /CIRCOUTCOMES.113.000729 . PMC 4081474. PMID 24823949 .
- ^ Яковетто, MC; Мэтлок, Д.Д.; Макиллвеннан, CK; и другие. (2014). «Образовательные ресурсы для пациентов, рассматривающих возможность вспомогательного устройства для левого желудочка: перекрестный обзор интернет-, печатных и мультимедийных материалов» . Кровообращение: качество сердечно-сосудистой системы и исходы . 7 (6): 905–11. doi : 10.1161/CIRCOUTCOMES.114.000892 . PMID 25316772 .
- ^ Мэтлок, Д. Д.; Аллен, Луизиана; Томпсон, Дж. С.; Макилвеннан, CK (31 июля 2014 г.). «Помощь в принятии решения для вспомогательного устройства для левого желудочка (LVAD) для целевой терапии. Устройство для пациентов с прогрессирующей сердечной недостаточностью» (PDF) . Медицинский факультет Университета Колорадо.
- ↑ Ventracor была ликвидирована 3 июля 2009 г., в результате чего активы компании, включая ее интеллектуальную собственность, данные клинических испытаний, машины и оборудование, а также остаточные активы, будут выставлены на продажу Бойд, Тони (13 июля 2009 г.). «Нет сердца» . Деловой зритель . Проверено 15 сентября 2009 г.
- ↑ FDA (3 июня 2021 г.). «FDA предупреждает поставщиков медицинских услуг о прекращении установки новых имплантатов некоторых систем вспомогательных устройств для желудочков» . Управление по санитарному надзору за качеством пищевых продуктов и медикаментов . Проверено 8 июля 2021 г. .
внешние ссылки
- MyLVAD.com — небрендовый сайт с информацией о различных LVAD.
- Имплантаты (медицина)
- Кардиология
- Протезирование
- Интервенционная кардиология
- Медицинское оборудование